ХИМИЯ АНАЛИТИЧЕСКАЯ - наука о методах определения химического состава веществ. Химический анализ буквально пронизывает всю нашу жизнь. Его методами проводят скрупулезную проверку лекарственных препаратов. В сельском хозяйстве с его помощью определяют кислотность почв и содержание в них питательных веществ, что позволяет подобрать оптимальные условия обработки почвы, также оценивают содержание белка и влаги в разных сортах зерна. Химическому анализу подвергаются и товары широкого потребления: в зубной пасте контролируют содержание фтора, в маслах - содержание ненасыщенных соединений. В природоохранной деятельности методы аналитической химии применяют для контроля качества питьевой воды, для определения содержания вредных веществ в отходах и т.д. В судебной практике с их помощью обнаруживают следы пороха на руках подозреваемого, анализируют состав красок, которыми написана картина, чтобы отличить подлинник от подделки. Методы анализа различаются по степени сложности. Так, в медицине используются экспресс-тесты на беременность и сложные методы анализа крови на содержание сахара или холестерина, контроля уровня нейромедиаторов при исследовании мозга in vivo и пр. Из приведенных примеров видно, что все вопросы, которые решает аналитическая химия, можно свести к следующим: что представляет собой данное вещество, из каких компонентов оно состоит, каковы их количество и распределение? Чтобы ответить на эти вопросы, проводят самые разнообразные химические реакции, применяют широкий спектр химических, физических, физико-химических, биологических методов, разрабатывают новые методы анализа и совершенствуют уже существующие. Число методов аналитической химии чрезвычайно велико и постоянно растет. Аналитическая химия тесно связана с другими дисциплинами: химический анализ внедряется в различные области науки, химик-аналитик пользуется достижениями других разделов химии, а также математики, физики, биологии и многих областей техники.
ОСНОВНЫЕ ПОЛОЖЕНИЯ
Стадии анализа. Решение аналитических задач включает несколько стадий.
Постановка задачи. Эта несущественная на первый взгляд стадия на самом деле очень важна.
Предположим, нужно определить количество ртути в водоеме. А что именно подразумевается под словом "ртуть"? Это может быть вся ртуть, независимо от конкретной химической формы, или все органические соединения ртути (например, диметилртуть), или все ее неорганические соединения, или вся ртуть в определенной степени окисления, или идентификация всех ртутьсодержащих соединений и определение их количества. Аналогичным образом обстоит дело и с "водоемом". Следует ли ограничить определение растворенной ртутью или рассмотреть взвешенные в воде твердые частички, ил на дне водоема, обитающих в воде животных и растения? Нужно учесть и продолжительность анализа: достаточно ли единичное определение, или потребуется рассчитать среднюю величину из результатов нескольких измерений, сделанных в течение одного дня, а может быть, и целого года. Ответы на эти вопросы определят характер всего анализа.
Выбор метода. Метод анализа выбирают исходя из поставленной задачи, размеров объекта и образца, содержания определяемых веществ, наличия примесей, требуемой точности результатов и имеющегося оборудования; учитывают также возможную продолжительность и стоимость анализа. Рассмотрим, например, два случая определения свинца. В первом - по результатам анализа устанавливают стоимость переработки руды, которая зависит от содержания свинца. Имеется большой образец, концентрация свинца в нем высокая, ответ необходим точный. Во втором случае нужно определить, загрязнен ли свинцом металл, из которого изготовлена старинная монета. Содержание свинца низкое, требуется лишь приблизительная его оценка, в ходе анализа сама монета не должна пострадать. Понятно, что эти случаи требуют разного подхода. Для анализа образца руды можно применить такие методы, как гравиметрия или титрование. Для монеты потребуется другой, щадящий (неразрушающий) метод, например флуоресценция в рентгеновских лучах.
Отбор образца. Для разных аналитических методов требуются, конечно, и разные по величине образцы - в количестве от нанограммов (1 нг = 10-9 г) до нескольких граммов. Вряд ли возможно целиком проанализировать объект, который весит намного больше, чем требует выбранная для анализа методика. В этих случаях отбирают образец, или пробу, вещества. Эта проба должна быть репрезентативной, т.е. адекватной всему объекту или той его части, которая представляет наибольший интерес. В приведенном выше примере со ртутью в водоеме постановка задачи определяет и способ отбора пробы.
Подготовка образца к анализу. Если количественные измерения проводят в растворе, образец растворяют в подходящем растворителе; при этом концентрацию образца подбирают так, чтобы она находилась в пределах применимости метода. Иногда приходится выделять определяемое вещество из смеси, поскольку многие методы анализа неспецифичны и даже неселективны. Специфичным называют метод, при помощи которого определяется только конкретное вещество, а селективным - предпочтительный для данного вещества метод, пользуясь которым можно определять и другие вещества. Специфичных методов очень мало, селективных - значительно больше. Например, высоко-селективны масс-спектрометрия и иммунологический анализ.
Измерения. Чтобы определить количество анализируемого вещества или его состав, измеряют какую-либо его физическую величину: количество вещества, израсходованного или образовавшегося в результате химической реакции; скорость реакции; интенсивность поглощения, испускания или рассеяния света; ток, возникающий в ходе окислительно-восстановительных процессов; количество выделившегося или поглощенного тепла и т.д. Зная связь между результатами измерений и теми величинами, которые интересуют исследователя, а также сравнив эти результаты с соответствующими стандартами, устанавливают количество определяемого вещества или его состав.
Интерпретация результатов. Когда результаты уже получены, может возникнуть ряд вопросов: решена ли поставленная задача? как проводить дальнейшие исследования? Не исключено, что для получения более точных результатов нужно усовершенствовать методику анализа.
Рабочие кривые. Рабочая кривая - это графическая зависимость, связывающая концентрацию определяемого вещества с тем параметром, который измеряется в ходе анализа (оптической плотностью, интенсивностью флуоресценции, электродным потенциалом, скоростью реакции и т.д.). Масштаб координатных осей - линейный или логарифмический - выбирается в зависимости от конкретного эксперимента. Логарифмические оси используют, в частности, при изменении концентрации в широких пределах. Если нужны более точные результаты, предпочтительны линейные оси и узкие интервалы концентрации. Для построения рабочей кривой сначала готовят стандартные образцы известной концентрации. Затем для каждого из них измеряют тот или иной параметр и откладывают его значение в виде точки против соответствующей концентрации. По точкам проводят плавную кривую, на которую точки ложатся наилучшим образом. Для этого используют какую-либо подходящую математическую функцию или эмпирическую зависимость. Затем измеряют тот же параметр для исследуемого образца и по рабочей кривой определяют его концентрацию (рис. 1). У каждого метода есть свои рабочий диапазон, чувствительность, фон, порог обнаружения.
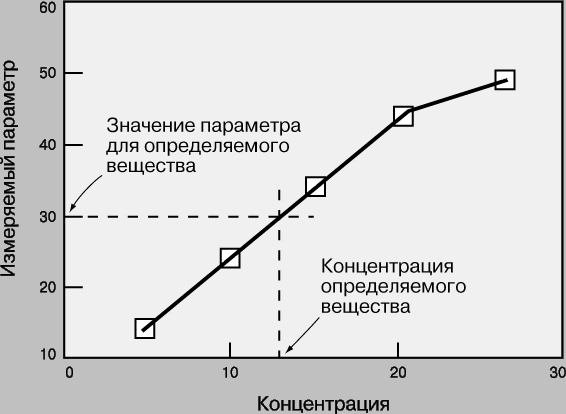
Рис. 1. РАБОЧАЯ КРИВАЯ - зависимость измеряемого параметра от концентрации для стандартного вещества. С ее помощью можно найти концентрацию определяемого вещества, соответствующую данному значению параметра.
Рабочий диапазон - это диапазон концентраций, в пределах которого применима данная методика. Линейный участок кривой отвечает области концентраций, в которой результаты наиболее надежны. При близких к предельным высоких и низких концентрациях рабочие кривые обычно становятся нелинейными. Это обусловлено ограниченными возможностями используемых методов анализа и оборудования. Если концентрация определяемого вещества попадает в нелинейную область высоких значений, то образец следует разбавить и анализ повторить. Чувствительность метода характеризуется величиной изменения измеряемого параметра при данном изменении концентрации. Она равна угловому коэффициенту (тангенсу угла наклона) рабочей кривой. Как правило, чем выше чувствительность, тем надежнее результаты и тем ниже порог обнаружения. Результат измерения часто включает составляющую, не связанную с определяемым веществом, - ее называют фоном. Наличие фона может быть связано с особенностями оборудования или влиянием матрицы, в которую включен образец (см. ниже). Чтобы оценить величину фона, проводят контрольный опыт. Для этого готовят контрольный образец, в котором нет определяемого вещества, а есть только все посторонние примеси, имеющиеся в матрице, а также реагенты, добавляемые в процессе анализа. Контрольный образец подвергают той же аналитической процедуре, что и определяемое вещество. Значение измеряемого параметра для этого контрольного образца считают равным фону. Порог обнаружения - это наименьшая концентрация определяемого вещества, при которой сигнал заметно отличается от фона. Величина порога обнаружения зависит от чувствительности и точности метода: чем они выше, тем ниже минимальные определяемые концентрации. Химики-аналитики систематически разрабатывают способы измерения все более низких концентраций. Сегодня для многих методов анализа порог обнаружения составляет 10-6 - 10-9 М, а некоторые недавно разработанные методы позволяют измерять пикомолярные концентрации (ниже 10-12 М), обнаруживать вещества в абсолютных количествах менее 10-18 молей (приблизительно несколько сотен тысяч молекул) и даже наблюдать отдельные атомы
(см. также ЭЛЕКТРОННЫЙ МИКРОСКОП).
Одна из задач, которые постоянно приходится решать в аналитической химии, - совершенствование методов, позволяющее работать со все более мелкими образцами. Те методы, для которых когда-то требовались миллилитровые количества, теперь обходятся микролитрами, а некоторые - и десятками пиколитров.
Матрица. Термин "матрица" относится к окружению определяемого вещества. Это все вещества, присутствующие в образце, в т.ч. и определяемые, отличные от данного. Так, хлор определяют в плазме крови, консервированной моркови, питьевой или морской воде. Эти образцы различаются по своим химическим и физическим свойствам, а следовательно, их матрицы тоже различны. Простейшая матрица - питьевая вода: она содержит относительно немного веществ, концентрация которых к тому же невелика. Консервированная морковь - сложная матрица, главным образом потому, что в ней содержатся разные органические соединения. Стандарты и определяемые при анализе вещества по возможности должны находиться в одинаковых или сравнимых матрицах, однако получить калиброванные матрицы удается очень редко. Чтобы решить эту проблему, используют синтетические матрицы, метод внутреннего стандарта и т.д. Если матрица данного образца обладает относительно постоянными физическими и химическими свойствами, не зависящими от того, когда и где был получен образец, то ее можно достаточно полно охарактеризовать и воспроизвести. Одна из таких матриц - морская вода. Концентрации ее основных компонентов (Na, Mg, Cl...) хорошо известны. Можно получить искусственную морскую воду и использовать ее для приготовления стандартных растворов других веществ, концентрация которых невелика (например, Al, Au, Ni, Zn). Состав биологических жидкостей, таких, как плазма крови или моча, также известен, что позволяет создавать искусственные матрицы для проведения определенных анализов. Другой метод состоит в том, что для стандартов и исследуемого вещества создают матрицы примерно одинакового состава. Для этого к образцу и стандартам добавляют большое количество какого-либо "инертного" вещества (для получения растворов одинаковой ионной силы к образцу и стандартам можно добавить 1 М NaClO4), так что небольшие различия в других компонентах матрицы становятся несущественными. Влияние матрицы при этом не исключается, напротив, оно усиливается, но теперь это влияние в исследуемом образце и стандарте практически одинаково. Удобный способ компенсации влияния матрицы, а также решения проблем, связанных с потерями вещества в ходе сложного анализа, - использование внутреннего стандарта. Метод состоит в следующем. Перед тем как определять вещество A, к содержащему его образцу добавляют известное количество вещества B. Количества A и B определяют по одной и той же методике. Установив соотношение между найденным и известным количествами B, корректируют полученное при анализе количество A. Внутренний стандарт должен отсутствовать в исходном образце и представлять собой химический аналог определяемого вещества. Например, для определения натрия в плазме крови методом пламенной эмиссионной спектроскопии в качестве внутреннего стандарта часто используют литий, поскольку он химически аналогичен натрию и в крови обычно отсутствует. В методе добавленных стандартов для приготовления стандартов сравнения используют сам исследуемый образец. Предположим, что мы хотим определить содержание натрия в плазме крови. Исходный образец делят на несколько частей, например на три. К одной из них ничего не добавляют, к двум другим добавляют известные количества определяемого вещества (в данном случае Na), так что его концентрация становится на 100 и 200 ммоль/л больше, чем в исходном образце. Далее по одной и той же методике определяют Na во всех частях образца и строят график зависимости измеряемой величины от прироста концентрации. Из графика определяют концентрацию натрия в исходном образце.
Равновесные и кинетические измерения. На рис. 2 графически представлен ход химической реакции Определяемое вещество + Реагенты Продукты Вначале концентрация линейно меняется во времени, затем изменение становится все более медленным, и, наконец, концентрация выходит на горизонталь - система достигает равновесия.
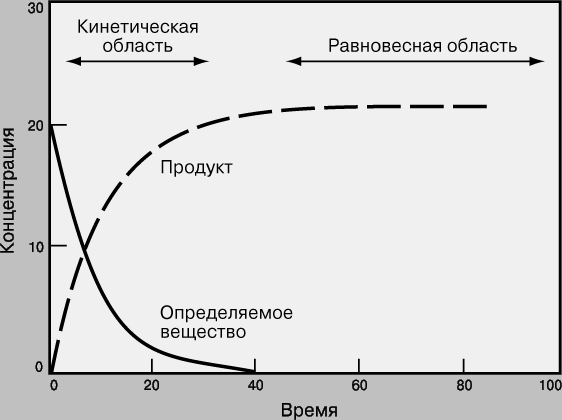
Рис. 2. ХОД ХИМИЧЕСКОЙ РЕАКЦИИ, представленный в виде графика зависимости концентрации реагента от времени.
Хотя считается, что многие химические реакции идут "до конца" (до полного исчерпания исходных веществ), на самом деле ни одна из них не протекает только в одном направлении. Химическая реакция идет до тех пор, пока концентрация всех участвующих в ней веществ не перестает меняться, т.е. пока система не достигнет равновесия. В этом состоянии концентрация некоторых веществ может быть очень мала, но все же она не равна нулю. Реакция не прекращается, просто скорость прямой реакции (Реагенты (r) Продукты) становится равной скорости обратной (Продукты (r) Реагенты), при этом происходит быстрое взаимное превращение реагентов и продуктов реакции, так что никакого суммарного изменения концентраций нет.
См. ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ. Аналитические определения можно проводить в химических системах, находящихся как в равновесном, так и в неравновесном состояниях. В первом случае концентрации веществ не меняются, поэтому продолжительность анализа несущественна и не влияет на выбор методики. Равновесные концентрации веществ связаны друг с другом через константу равновесия. Для химической реакции aA + bB cC + dD эта константа равна
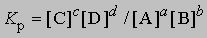
где в квадратных скобках указаны молярные концентрации соответствующих веществ, а показатели степени равны стехиометрическим коэффициентам уравнения химической реакции. Константы равновесия реакций, используемых в аналитической химии, изменяются от 1 до 10 100 и более. Многие методы анализа основаны на определении состояния равновесия. В качестве примера можно привести рассматриваемые ниже классические методы - гравиметрию и титрование. При анализе неравновесных систем определяют изменение концентрации реагирующих веществ во времени, т.е. скорость реакции. Она задается выражением
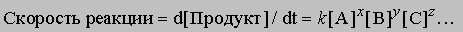
где k - константа скорости, [[A]], [[B]], [[C]] - молярные концентрации веществ A, B, C, сумма x, y, z - порядок реакции. Какие именно химические вещества фигурируют в уравнении скорости такой реакции и с какими степенями входят их концентрации, зависит от механизма химической реакции. При неравновесных определениях нужно успеть провести измерения за достаточно малое (по сравнению с продолжительностью самой реакции) время, так чтобы концентрации реагентов не изменились. Определения, основанные на измерении скорости реакции, могут быть выполнены в очень короткое время от начала реакции (иногда несколько секунд), поскольку не нужно ждать, когда система достигнет равновесия. Если определяемое вещество - катализатор, то измерения следует проводить до достижения равновесия, поскольку катализатор изменяет только скорость реакции, но не положение равновесия. Применение кинетических измерений в аналитической химии не ограничивается методами анализа, основанными на измерении скорости реакции. В основе многих аналитических методов, например флуоресцентного анализа, амперометрии, хроматографии, лежат кинетические процессы, хотя анализируются системы, находящиеся в состоянии равновесия. Ниже описаны некоторые распространенные методы анализа.
МЕТОДЫ АНАЛИЗА, ОСНОВАННЫЕ НА ОПРЕДЕЛЕНИИ ПОЛОЖЕНИЯ РАВНОВЕСИЯ
В аналитической химии есть несколько методов, основанных на определении положения химического равновесия. К ним относятся, в частности, классические гравиметрия и титриметрия, а также сравнительно новый иммунологический анализ.
Гравиметрия (весовой метод). В гравиметрии определяемое вещество переводят в химически чистое состояние или превращают в весовую форму - соединение с точно известным постоянным составом, которое можно легко выделить и взвесить. Количество анализируемого вещества рассчитывают исходя из массы весовой формы и уравнения реакции, связывающей это вещество с весовой формой. Химические стандарты не требуются. Весовые методы анализа очень точны, их часто используют в сомнительных случаях в качестве контроля. Точность анализа ограничивается точностью определения массы и полнотой образования и выделения чистого вещества. Гравиметрия - продолжительная процедура, поскольку и перевод определяемого вещества в весовую форму, и выделение ее из смеси требуют времени. Кроме того, необходимо убедиться в том, что весовая форма - это вещество точно известного постоянного состава, не содержащее примесей. Большинство весовых определений основано на образовании и выделении из раствора (как правило, водного) твердых нерастворимых осадков. Задача состоит в том, чтобы осадить по возможности максимальное количество определяемого вещества (по крайней мере, 99,99%), поэтому осадок (чаще всего соль) должен обладать как можно меньшей растворимостью. Растворимость соли определяется величиной константы равновесия реакции растворения, в которой образуются ионы. Количественное осаждение обычно осуществляют, добавляя к раствору с определяемым веществом стехиометрический избыток осаждающего реагента. Растворимость соли в присутствии избытка одного из ионов, входящих в ее состав, снижается. Для уменьшения влияния других равновесных реакций, приводящих к увеличению растворимости соли, необходимо контролировать состав раствора. Для разных анализируемых веществ применяют разные осаждающие реагенты. Некоторые из них приведены в табл. 1.
Одно из основных преимуществ весовых определений заключается в том, что не нужно калибровать приборы или готовить стандартные растворы. Результат получают, взвесив осадок и зная состав участвующих в реакции соединений. Пусть, например, мы хотим определить содержание марганца в образце. Для этого нужно перевести марганец в Mn3O4, отделить последний и взвесить. Предположим, что из 1,52 г образца образуется 0,126 г Mn3O4 (т.е. 0,00055 моль, так как 1 моль Mn3O4 содержит 228,8 г). В 1 моль Mn3O4 содержится 3 моль Mn, а в 0,00055 моль - соответственно 0,00165 моль Mn, или 0,0907 г (1 моль Mn содержит 54,94 г). Следовательно, содержание Mn в образце (0,0907/1,52)*100% = 5,97%. Как мы уже говорили, гравиметрия довольно медленная процедура; образование осадка, его отделение фильтрованием, высушивание - все это требует времени. Кроме того, весовые определения обычно не отличаются высокой селективностью, поэтому дополнительное время уходит на подбор условий (например, pH), переосаждение и т.п. Чем сложнее по составу образец, тем более вероятны ошибки: завышение весового содержания анализируемого вещества, связанное с соосаждением примесей, или занижение, обусловленное потерей вещества на стадии его выделения. Вследствие ограниченных селективности и чувствительности гравиметрию нет смысла применять, когда в наличии имеются лишь микро- или следовые количества определяемого вещества.
Титриметрия (объемный метод). В титриметрии концентрацию определяют, измеряя объем стандартного или титрованного реагента (титранта), израсходованного в химической реакции с определяемым веществом в растворе (или газовой фазе). Измерение проводят с помощью процедуры титрования. Это простой, относительно быстрый, универсальный и точный метод. При титровании титрант добавляют порциями или непрерывно с небольшой постоянной скоростью и измеряют его объем до тех пор, пока не будет достигнута точка эквивалентности, отвечающая объему титранта, при котором в реакцию вступает все определяемое вещество. Точку эквивалентности находят, непрерывно следя за изменением тех или иных свойств титруемого раствора (цвета, оптической плотности, электрохимических свойств и т.д.) при помощи специальных приборов или визуально. Чтобы данную химическую реакцию можно было использовать в титровании, участвующие в ней вещества должны находиться в строго определенных количественных (стехиометрических) соотношениях. Реакция должна протекать быстро и практически до конца, а точка эквивалентности точно фиксироваться. Чаще всего используют реакции нейтрализации (кислотно-основные), комплексообразования и окислительно-восстановительные. Реакции нейтрализации распространены наиболее широко; именно их мы и рассмотрим для пояснения ключевых моментов всех реакций титрования.
Кривые титрования. Кривая титрования - это график зависимости pH, оптической плотности или каких-либо других характеристик титруемого раствора (ось ординат) от объема добавленного титранта (ось абсцисс). Масштаб оси абсцисс всегда линейный, а оси ординат может быть линейным или логарифмическим. Линейный масштаб удобен для тех методов контроля за титрованием (спектрофотометрия, амперометрия), в которых контролируемый параметр меняется с концентрацией линейно, а логарифмический - в случае логарифмического изменения (например, при потенциометрии с ионоселективным электродом). Логарифмический масштаб часто используют при визуальном определении конечной точки титрования, поскольку именно в этом масштабе наиболее наглядно проявляется резкое изменение свойств раствора вблизи точки эквивалентности. Зависимость кривых титрования от концентрации и константы равновесия. Для точного определения конечной точки титрования необходимо, чтобы на кривой титрования вблизи точки эквивалентности наблюдался перегиб (скачок). Это требование устанавливает пределы как для минимальной определяемой концентрации, так и для минимальной константы равновесия, приемлемой для реакции титрования. На рис. 3 представлены кривые титрования сильной кислоты сильным основанием и слабой кислоты сильным основанием. Видно, что при уменьшении концентрации скачок становится менее выраженным. Нижний предел концентрации зависит от конкретной реакции и метода определения конечной точки титрования, но проводить титрование при концентрациях ниже 10-4 М уже затруднительно. Рисунок 4 иллюстрирует влияние константы равновесия реакции титрования на кривую титрования. Для реакций нейтрализации в водных растворах константа равновесия в случае сильной кислоты и сильного основания составляет 1014, а для слабой кислоты и сильного основания - 10 14Ka, где Ka - константа диссоциации кислоты. По мере уменьшения константы равновесия уменьшается и величина скачка. Чтобы визуальное определение конечной точки титрования было надежным, константа равновесия не должна быть меньше 106. При инструментальном контроле титрования или расчете положения конечной точки титрования на основании полученных данных константа равновесия может составлять всего 10 2.
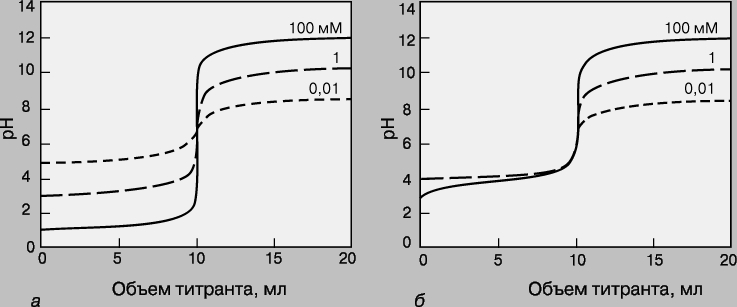
Рис. 3. КРИВЫЕ ТИТРОВАНИЯ сильной кислоты сильным основанием (а) и слабой кислоты (pKa = 5) сильным основанием (б) для разных концентраций определяемого вещества.
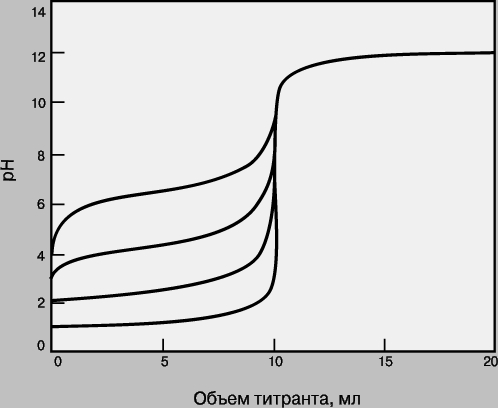
Рис. 4. КРИВЫЕ ТИТРОВАНИЯ ПРИ РАЗНЫХ КОНСТАНТАХ РАВНОВЕСИЯ. Титруемые кислоты (снизу вверх): сильная кислота типа HCl (Kр = 1014); кислота с pKa = 3 (Kр = 1011); кислота с pKa = 5 (Kр = 109); кислота с pKa = 7 (Kр = 107).
Смеси. Если в образце содержатся два определяемых вещества, взаимодействующие с одним и тем же титрантом, их можно определить в одной операции титрования при условии, что реакция каждого из этих веществ с титрантом имеет достаточно высокую константу равновесия и что эти константы существенно различаются (как правило, не менее чем на два порядка). На рис. 5 приведены кривые титрования для смесей анализируемых веществ с различными pKa. Первым титруется вещество, реакция которого с титрантом имеет большую константу равновесия. Объем от начала титрования до первой конечной точки позволяет определить концентрацию этого анализируемого вещества, а объем между конечными точками титрования - концентрацию второго анализируемого вещества. Если константы равновесия слишком близки, то локализовать первую конечную точку титрования будет сложно или вообще невозможно. В таком случае анализируемые вещества нельзя определить по отдельности, а суммарный объем титранта позволит рассчитать лишь сумму их концентраций.
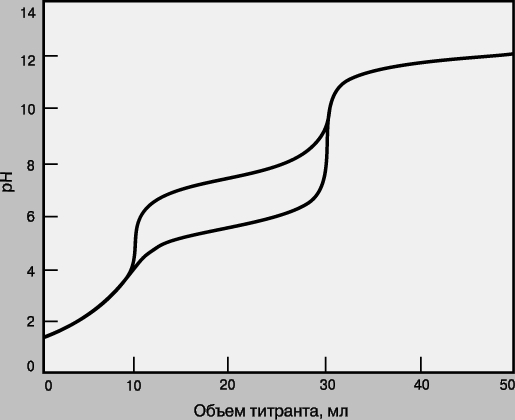
Рис. 5. КРИВЫЕ ТИТРОВАНИЯ для смеси двух определяемых веществ с pKa = 2 (Kр = 10 12) и pKa = 6 или 8 (Kр = 10 8 или 10 6).
Цветные индикаторы. Цветной индикатор - вещество, которое меняет свою окраску при взаимодействии с одним из компонентов титруемого раствора. Пусть, например, индикатор In взаимодействует с определяемым веществом A:
A + T P (реакция титрования) A + In AIn (реакция с индикатором)
где A - определяемое вещество, T - титрант, P - продукт реакции, In - индикатор, AIn - продукт взаимодействия определяемого вещества и индикатора. In можно использовать как индикатор в данной реакции титрования, если он и AIn по-разному окрашены. В качестве цветных индикаторов обычно используют вещества, вступающие в реакции того же типа, что и реакция между определяемым веществом и титрантом. Индикаторами кислотно-основного титрования, как правило, являются слабые кислоты, у которых кислая и основная формы имеют разную окраску. В реакциях комплексообразования индикаторами служат вещества, способные образовывать комплексы с определяемым ионом металла и имеющие разную окраску в зависимости от того, находятся ли они в свободном состоянии или входят в состав комплекса. Очень часто при титровании меняется pH раствора (кислотно-основное титрование) или потенциал (окислительно-восстановительные реакции). Для кислотно-основного титрования используют индикатор, который переходит из одной окрашенной формы в другую при pH, близком к pH точки эквивалентности. На рис. 6 представлена кривая титрования смеси двух слабых кислот и указаны интервалы изменения окраски нескольких индикаторов. Для фиксации первой конечной точки титрования следует взять бромкрезоловый зеленый, второй - тимолфталеин.
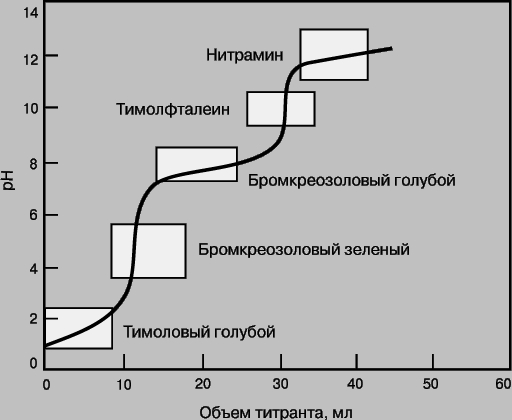
Рис. 6. КРИВАЯ ТИТРОВАНИЯ СМЕСИ ДВУХ СЛАБЫХ КИСЛОТ с pKa = 2 и 7. Указаны интервалы изменения окраски индикаторов в соответствующих диапазонах pH.
Инструментальное определение конечной точки титрования. Непрерывный контроль процесса титрования с помощью приборов позволяет получить данные о его ходе как до, так и после точки эквивалентности. Эти данные можно представить в виде графика и определять конечную точку графически или путем вычислений. Чаще всего используют спектрофотометрическое (измерение оптической плотности), амперометрическое и потенциометрическое (измерение электродного потенциала) титрование.
Кулонометрическое титрование. Кулонометрическое титрование обычно проводят при постоянном токе. Титрант образуется в результате электрохимических процессов на рабочем электроде в сосуде для титрования. Число молей анализируемого вещества равно произведению силы тока на время, необходимое для образования титранта в количестве, достаточном для достижения конечной точки титрования с учетом стехиометрии. Химические стандарты не требуются. К титрантам, которые образуются в ходе электрохимических процессов, относятся H+, OH-, Br2 и I2.
Прямое и обратное титрование. В простейшем варианте титрования анализируемое вещество взаимодействует непосредственно с титрантом. Количество анализируемого вещества рассчитывают исходя из молярной концентрации титранта, его объема, требуемого для достижения точки эквивалентности, и стехиометрии реакции между определяемым веществом и титрантом. Предположим, что для достижения конечной точки титрования 5,00 мл раствора, содержащего ионы Sn2+, потребовалось 12,51 мл 0,100 М раствора Ce(IV). Реакция титрования имеет вид Sn2+ + 2Ce4+ -> Sn4+ + 2Ce3+. Количество Ce4+, пошедшего на титрование, составляет (12,51*10-3 л)*(0,100 моль/л) = 12,51*10-4 моль, количество прореагировавшего Sn2+ в 2 раза меньше, т.е. 6,25*10-4 моль. Столько Sn2+ содержится в 5,00 мл раствора, так что его концентрация равна
(6,25*10-4 моль)/(5*10-3 л) = 0,125 М. В обратном титровании анализируемое вещество взаимодействует не с титрантом, а с другим реагентом, присутствующим в избытке. Избыток затем определяют титрованием. Если известно исходное количество реагента и определен его избыток, то разность между ними - это количество реагента, пошедшее на реакцию с определяемым веществом. Предположим, что к 5,00 мл образца, содержащего фенол, добавляют 20,00 мл 0,100 М раствора гидроксида натрия. В результате реакции образуется фенолят натрия. Избыток гидроксида натрия титруют 12,53 мл 0,0800 М раствора HCl. Соотношения между реагентами в реакциях гидроксида натрия и фенола или гидроксида натрия и соляной кислоты составляют 1:1. В таком случае исходное количество гидроксида натрия равно (20,00Ч10-3 л)*(0,100 моль/л) = 20,00*10-4 моль. Избыток гидроксида натрия равен количеству соляной кислоты, пошедшей на его титрование: (12,53Ч10-3 л)*(0,0800 моль/л) = 10,00*10-4 моль. На взаимодействие с анализируемым веществом израсходовано (20,00 - 10,00)*10-4 моль = 10,00*10-4 моль гидроксида натрия. Такое же количество фенола содержится в 5,00 мл образца. Следовательно, концентрация фенола составляет (10,00*10-4 моль)/(5,00*10-3 л) = 0,200 М. Обратное титрование используют, например, когда константа равновесия реакции прямого титрования слишком мала. Так, в рассмотренном выше примере фенол - довольно слабая кислота, и константа равновесия прямого титрования фенола гидроксидом натрия составляет величину лишь порядка 104. В то же время константа равновесия реакции обратного титрования между избытком гидроксида натрия (сильное основание) и соляной кислотой (сильная кислота) равна 1014. Среди других причин применения обратного титрования - отсутствие подходящего метода индикации или недостаточная скорость реакции при прямом титровании. Так, для прямого комплексонометрического титрования иона металла этилендиаминтетрауксусной кислотой (ЭДТА) обычно используют металлы-индикаторы. Понятно, что для определения конечных точек титрования всех ионов металлов нужно множество различных индикаторов. При обратном титровании к раствору, содержащему ион металла, добавляют избыточное количество ЭДТА, а избыток последнего затем определяют при помощи раствора, содержащего Mg2+. Тогда единственный необходимый индикатор - это индикатор на Mg2+, независимо от того, какой ион определяют.
Кислотно-основное титрование. Случаев применения титрования кислот и оснований множество. Чтобы конечная точка титрования определялась наиболее четко, в качестве титрантов применяют сильные кислоты и основания. Типичный кислотный титрант - HCl. Его стандартизуют по первичному стандартному карбонату натрия, используя в качестве индикаторов метиловый красный, метиловый оранжевый или бромкрезоловый зеленый. Типичный основный титрант - NaOH, его стандартизуют по первичному стандартному бифталату калия, используя в качестве индикатора фенолфталеин. Примером кислотно-основного титрования может служить метод определения содержания азота в различных соединениях (метод Кьельдаля): образец разлагают горячей серной кислотой, превращая азот в ион аммония; после охлаждения образец обрабатывают щелочью, чтобы перевести ион аммония в аммиак; аммиак улавливают кислым раствором, после чего избыток кислоты определяют титриметрически при помощи реакции нейтрализации.
Комплексонометрическое титрование. Чаще всего комплексонометрическое титрование применяют для определения ионов металлов с использованием ЭДТА в качестве титранта (например, при определении жесткости воды). Образец воды подщелачивают аммиачным буферным раствором, добавляют индикатор эриохром черный и полученный раствор титруют ЭДТА.
Окислительно-восстановительное титрование. Во многих наиболее распространенных реакциях окислительно-восстановительного титрования косвенным участником является иод. Конечная стадия титрования заключается в количественном определении иода при помощи титрования тиосульфатом натрия. В качестве индикатора на иод используют крахмал. Тиосульфат стандартизуют по трииодид-иону (I3-), который получается по реакции между KI и первичным стандартом KIO3. Таким способом определяют, например, степень ненасыщенности жирных кислот, содержание фенола, многоатомных спиртов (глицерина или этиленгликоля).
СПЕКТРОСКОПИЯ
Спектроскопические методы основаны на взаимодействии электромагнитного излучения с веществом, т.е. на определен