м.
Химический элемент, тяжёлый тугоплавкий металл серебристо-белого цвета, применяемый для нанесения защитных покрытий.
м.
Химический элемент, тяжёлый тугоплавкий металл серебристо-белого цвета, применяемый для нанесения защитных покрытий.
ИРИ́ДИЙ, иридия, мн. нет, муж. (иностр.) (хим.). Редко встречающийся химический элемент - тяжелый металл, близкий к платине.
ИРИДИЙ, ирид муж. весьма твердый, беловатый металл, находимый обычно в сплаве с осмием и вместе с платиной. Иридиевый, иридовый, к металлу иридию относящийся. Иридистый, содержащий примесь иридия.
ИРИ́ДИЙ -я; м. [от греч. iris (iridos) - радуга] Химический элемент (Ir), тяжёлый тугоплавкий редкоземельный металл серовато-белого цвета (используется для нанесения защитных покрытий). Добыча иридия.
◁ Ири́диевый, -ая, -ое. И. сплав. И. кончик пера.
* * *
ири́дий (лат. Iridium), химический элемент VIII группы периодической системы, относится к платиновым металлам. Плотность 22,65 г/см3, tпл 2447°C. Применяют для нанесения защитных покрытий. Компонент сплавов с Pt, Os и др. (химическая аппаратура, эталоны мер, детали измерительных приборов, напайка «вечных перьев»). Название от греческого íris - радуга.
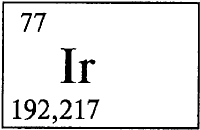
* * *
ИРИДИЙ - ИРИ́ДИЙ (лат. Iridium, от греческого «ирис» - радуга), Ir (читается «иридий»), химический элемент с атомным номером 77, атомная масса 192,22. Состоит из смеси двух стабильных изотопов 193Ir (62,7% по массе) и 191Ir (37,3%). Расположен в VIIIB группе, в 6 периоде периодической системы элементов. Входит в триаду осмий (см. ОСМИЙ)-иридий-платина, (см. ПЛАТИНА) является платиновым металлом. Конфигурация внешней и предвнешней электронных оболочек 5s2p6d76s2. Степени окисления от +1 до +6 (валентности I-VI). Наиболее характерны степени окисления +3 и +4.
Радиус атома 0,135 нм, ионный радиус иона Ir2+ - 0,089 нм, иона Ir3+ - 0,082 нм, Ir4+ - 0,077 нм, Ir5+- 0,071 нм. Энергии последовательной ионизации 9,1 и 17,0 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 2,2.
Иридий - тяжелый серебристо-белый металл.
История открытия
Открыт в 1804 английским химиком С. Теннантом (см. ТЕННАНТ Смитсон), который изучал состав платиновых минералов.
Нахождение в природе
Иридий - очень редкий элемент, содержание в земной коре 1·10-7% по массе. В природе встречается в виде сплавов с осмием (осмистый иридий), платиной, родием (см. РОДИЙ), рутением (см. РУТЕНИЙ) и другими платиновыми металлами (см. ПЛАТИНОВЫЕ МЕТАЛЛЫ). В рассеянной форме (10-4% по массе) содержится в сульфидных медно-никелевых железосодержащих рудах.
Получение
Основной источник иридия - анодные шламы медно-никелевого производства. Полученный шлам обогащают. Потом, действуя на него царской водкой (см. ЦАРСКАЯ ВОДКА), при нагревании переводят в раствор платину, палладий (см. ПАЛЛАДИЙ (химический элемент)), родий, иридий и рутений в виде хлоридных комплексов H2[PtCl6], H2[PdCl4], H3[RhCl6], H2[IrCl6] и H2[RuCl6]. Осмий остается в нерастворимом осадке. Из полученного раствора добавлением хлорида аммония NH4Cl сначала осаждают комплекс платины (NH4)2[PtCl6], а затем комплекс иридия (NH4)2[IrCl6] и рутения (NH4)2[RuCl6]. При прокаливании (NH4)2[IrCl6] на воздухе получают металлический иридий:
(NH4)2[IrCl6] = Ir + N2 + 6HCl + H2.
Физические и химические свойства
Иридий - тяжелый серебристо-белый металл (плотность при 20 °C 22,65 кг/дм3). Решетка кубическая гранецентрированная, а= 0,38387 нм. Температура плавления 2447 °C, кипения 4380 °C. В ряду стандартных потенциалов расположен правее водорода (см. ВОДОРОД). На воздухе иридий устойчив, с кислотами-неокислителями и водой не реагирует.
Отличается высокой химической стойкостью. С неметаллами взаимодействует только в мелкораздробленном состоянии при температуре красного каления. Взаимодействие с кислородом (см. КИСЛОРОД) происходит только при температуре выше 1000 °C, при этом образуется диоксид иридия IrO2.
Оксиды иридия не растворяются в воде, кислотах и щелочах.
Компактный иридий при температурах до 100 °C не реагирует со всеми известными кислотами и их смесями, в том числе и с царской водкой. Для перевода этих металлов в растворимые в воде хлорокомплексы порошок, содержащий эти металлы, хлорируют при нагревании в присутствии комплексообразователя NaCl:
Ir + 2Cl2 + 2NaCl = Na2[IrCl6]
Гидроксид Ir(OH)4 (IrO2·2H2O) образуется при нейтрализации растворов хлороиридатов(IV) в присутствии окислителей. Осадок Ir2O3·xH2O выпадает при нейтрализации щелочью хлороиридатов (III) и легко окисляется на воздухе до IrO2. Гидроксиды иридия практически не растворяются в воде. В растворимую форму оксиды иридия переводят, окисляя их в присутствии комплексообразователя:
IrO2 + 4HCl + 2NaCl = Na2[IrCl6] + 2H2O.
Высшая степень окисления +6 проявляется у иридия в гексафториде IrF6. Это очень сильный окислитель, способный окислить даже воду:
2IrF6 + 10H2O = 2Ir(OH)4 + 12HF + O2,
или NO:
NO + IrF6 = NO+[IrF6]- .
Как и для других d-элементов, для иридия характерно образование комплексных соединений с координационным числом 6. Известно большое число иридийорганических соединений со связью Ir-C.
Применение
Из чистого иридия изготавливают тигли для выращивания монокристаллов, фольгу для неамальгамирующихся катодов, ответственные детали контрольно-измерительных приборов. Иридий используется для иридирования поверхностей изделий. Радиоактивный изотоп 192Ir используют в качестве портативного источника g-излучения для радиографических исследований трубопроводов и радиотерапии онкологических заболеваний. До 1960 международным эталоном метра служил изготовленный из платино-иридиевого сплава брус, находящийся в Международном бюро мер и весов в Севре. На одной из плоскостей этого бруса нанесены два штриха, на расстоянии 1 м друг от друга.
ИРИДИЙ (лат. Iridium) - Ir, химический элемент VIII группы периодической системы, атомный номер 77, атомная масса 192,22, относится к платиновым металлам. Плотность 22,65 г/см³, tпл 2447 .С. Применяют для нанесения защитных покрытий. Компонент сплавов с Pt, Os и др. (химическая аппаратура, эталоны мер, детали измерительных приборов, напайка "вечных перьев"). Название от греч. iris - радуга.
-я, м.
Химический элемент, тяжелый тугоплавкий металл серовато-белого цвета.
[От греч. ’ι̃ρις, ’ίριδος - радуга]
ИРИДИЙ (Iridium), Ir, химический элемент VIII группы периодической системы, атомный номер 77, атомная масса 192,22; относится к платиновым металлам. Открыт английским химиком С. Теннантом в 1804.
ИРИДИЙ (от греч. iris - радуга). Металл, из группы платины, соединения которого отличаются радужными цветами.
- Платиновый металл.
- «Радуга» среди химических элементов.
- Химический элемент, Ir.
- Из этого химического элемента изготавливают тигли для выращивания монокристаллов.