м.
Ускорение химической реакции под влиянием некоторых веществ.
КАТА́ЛИЗ, катализа, муж. (от греч. katalysis - роспуск) (хим.). Ускорение или замедление химической реакции под влиянием катализаторов.
КАТА́ЛИЗ -а; м. [от греч. katalysis - роспуск, разрушение] Хим. Возбуждение химической реакции или изменение её скорости под влиянием катализатора.
◁ Каталити́ческий, -ая, -ое. К-ая реакция. К-ая активность.
* * *
катали́з (от греч. katálysis - разрушение), ускорение химическая реакции в присутствии веществ - катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. При гомогенном катализе исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой), при гетерогенном - газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Катализ обусловливает высокие скорости реакций при небольших температурах, предпочтительное образование определенного продукта из ряда возможных. Каталитические реакции являются основой многих химико-технологических процессов (например, производства серной кислоты, некоторых полимеров, аммиака). Большинство процессов, происходящих в живых организмах, также являются каталитическими (ферментативными).
* * *
КАТАЛИЗ - КАТА́ЛИЗ (от греч. katalysis - разрушение), ускорение химической реакции в присутствии веществ - катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. При гомогенном катализе исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой), при гетерогенном - газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Катализ обусловливает высокие скорости реакций при небольших температурах; предпочтительно образование определенного продукта из ряда возможных. Каталитические реакции являются основой многих химико-технологических процессов (напр., производства серной кислоты, некоторых полимеров, аммиака). Большинство процессов, происходящих в живых организмах, также являются каталитическими (ферментативными).
КАТАЛИЗ (от греч. katalysis - разрушение) - ускорение химической реакции в присутствии веществ - катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. При гомогенном катализе исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой), при гетерогенном - газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Катализ обусловливает высокие скорости реакций при небольших температурах; предпочтительно образование определенного продукта из ряда возможных. Каталитические реакции являются основой многих химико-технологических процессов (напр., производства серной кислоты, некоторых полимеров, аммиака). Большинство процессов, происходящих в живых организмах, также являются каталитическими (ферментативными).
-а, м. хим.
Возбуждение химической реакции или изменение ее скорости под влиянием катализатора.
[От греч. κατάλυσις - роспуск]
КАТАЛИЗ - ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни. Биологические катализаторы, называемые ферментами, участвуют в регуляции биохимических процессов. Без катализаторов не могли бы протекать многие промышленные процессы. Важнейшее свойство катализаторов - селективность, т.е. способность увеличивать скорость лишь определенных химических реакций из многих возможных. Это позволяет осуществлять реакции, протекающие в обычных условиях слишком медленно, чтобы им можно было найти практическое применение, и обеспечивает образование нужных продуктов. Применение катализаторов способствовало бурному развитию химической промышленности. Они широко используются при переработке нефти, получении различных продуктов, создании новых материалов (например, пластмасс), нередко более дешевых, чем применявшиеся прежде. Примерно 90% объема современного химического производства основано на каталитических процессах. Особую роль играют каталитические процессы в охране окружающей среды. В 1835 шведский химик Й. Берцелиус установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает. Для таких веществ он ввел термин "катализатор" (от греч. katalysis - расслабление). Как считал Берцелиус, катализаторы обладают особой способностью ослаблять связи между атомами в молекулах, участвующих в реакции, облегчая таким образом их взаимодействие. Большой вклад в развитие представлений о работе катализаторов внес немецкий физикохимик В.Оствальд, который в 1880 дал определение катализатора как вещества, которое изменяет скорость реакции. Согласно современным представлениям, катализатор образует комплекс с реагирующими молекулами, стабилизируемый химическими связями. После перегруппировки этот комплекс диссоциирует с высвобождением продуктов и катализатора. Для мономолекулярной реакции превращения молекулы X в Y весь этот процесс можно представить в виде X + Кат. -> X-Кат.
-> Y-Кат. -> Y + Кат. Высвободившийся катализатор вновь связывается с X, и весь цикл многократно повторяется, обеспечивая образование больших количеств продукта - вещества Y. Многие вещества при обычных условиях не вступают в химическую реакцию друг с другом. Так, водород и оксид углерода при комнатной температуре не взаимодействуют между собой, поскольку связь между атомами в молекуле H2 достаточно прочная и не разрывается при атаке молекулой CO. Катализатор сближает молекулы H2 и CO, образуя с ними связи. После перегруппировки комплекс катализатор - реагенты диссоциирует с образованием продукта, содержащего атомы C, H и O. Нередко при взаимодействии одних и тех же веществ образуются разные продукты. Катализатор может направить процесс по пути, наиболее благоприятному для образования определенного продукта. Рассмотрим реакцию между CO и H2. В присутствии медьсодержащего катализатора практически единственным продуктом реакции является метанол:
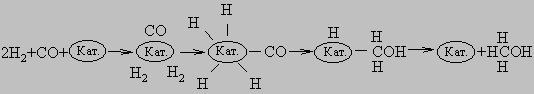
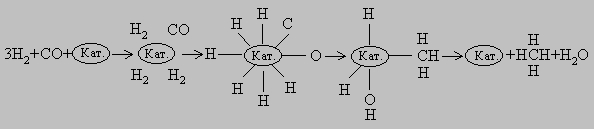
Вначале молекулы СО и Н2 адсорбируются на поверхности катализатора. Затем молекулы СО образуют с катализатором химические связи (происходит хемосорбция), оставаясь в недиссоциированной форме. Молекулы водорода также хемосорбируются на поверхности катализатора, но при этом диссоциируют. В результате перегруппировки образуется переходный комплекс Н-Кат.-CH2OH. После присоединения атома H комплекс распадается с высвобождением CH3OH и катализатора. В присутствии никелевого катализатора как СО, так и Н2 хемосорбируются на поверхности в диссоциированной форме, и образуется комплекс Кат.-СН3. Конечными продуктами реакции являются СН4 и Н2О:
Большинство каталитических реакций проводят при определенных давлении и температуре, пропуская реакционную смесь, находящуюся в газообразном или жидком состоянии, через реактор, заполненный частицами катализатора. Для описания условий проведения реакции и характеристики продуктов используются следующие понятия. Объемная скорость - объем газа или жидкости, проходящий через единицу объема катализатора в единицу времени. Каталитическая активность - количество реагентов, превращенных катализатором в продукты в единицу времени. Конверсия - доля вещества, превращенного в данной реакции. Селективность - отношение количества определенного продукта к суммарному количеству продуктов (обычно выражается в процентах). Выход - отношение количества данного продукта к количеству исходного материала (обычно выражается в процентах). Производительность - количество продуктов реакции, образующихся в единице объема в единицу времени.
ТИПЫ КАТАЛИЗАТОРОВ
Катализаторы классифицируют исходя из природы реакции, которую они ускоряют, их химического состава или физических свойств. Каталитическими свойствами обладают в той или иной степени практически все химические элементы и вещества - сами по себе или, чаще, в различных сочетаниях. По своим физическим свойствам катализаторы делятся на гомогенные и гетерогенные. Гетерогенные катализаторы - это твердые вещества, гомогенные диспергированы в той же газовой или жидкой среде, что и реагирующие вещества. Многие гетерогенные катализаторы содержат металлы. Некоторые металлы, особенно относящиеся к VIII группе периодической системы элементов, обладают каталитической активностью сами по себе; типичный пример - платина. Но большинство металлов проявляют каталитические свойства, находясь в составе соединений; пример - глинозем (оксид алюминия Al2O3). Необычным свойством многих гетерогенных катализаторов является большая площадь их поверхности. Они пронизаны многочисленными порами, суммарная площадь которых иногда достигает 500 м2 на 1 г катализатора. Во многих случаях оксиды с большой площадью поверхности служат подложкой, на которой в виде небольших кластеров осаждаются частички металлического катализатора. Это обеспечивает эффективное взаимодействие реагентов в газовой или жидкой фазе с каталитически активным металлом. Особый класс гетерогенных катализаторов составляют цеолиты - кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия). Хотя многие гетерогенные катализаторы обладают большой площадью поверхности, обычно они имеют лишь небольшое число активных центров, на долю которых приходится малая часть суммарной поверхности. Катализаторы могут утрачивать свою активность в присутствии небольших количеств химических соединений, называемых каталитическими ядами. Эти вещества связываются с активными центрами, блокируя их. Определение структуры активных центров является предметом интенсивных исследований. Гомогенные катализаторы имеют различную химическую природу - кислоты (Н2SO4 или Н3РО4), основания (NaOH), органические амины, металлы, чаще всего переходные (Fe или Rh), в форме солей, металлоорганических соединений или карбонилов. К катализаторам относятся также ферменты - белковые молекулы, регулирующие биохимические реакции. Активный центр некоторых ферментов содержит атом металла (Zn, Cu, Fe или Mo). Металлсодержащие ферменты катализируют реакции с участием малых молекул (О2, CO2 или N2). Ферменты обладают очень высокой активностью и селективностью, но работают только при определенных условиях, таких, в которых протекают реакции в живых организмах. В промышленности часто используют т.н. иммобилизованные ферменты.
КАК РАБОТАЮТ КАТАЛИЗАТОРЫ
Энергетика. Любая химическая реакция может протекать лишь при условии, что реагенты преодолеют энергетический барьер, а для этого они должны приобрести определенную энергию. Как мы уже говорили, каталитическая реакция X (r) Y состоит из ряда последовательных стадий. Для протекания каждой из них необходима энергия E, называемая энергией активации. Изменение энергии вдоль координаты реакции представлено на рис. 1.
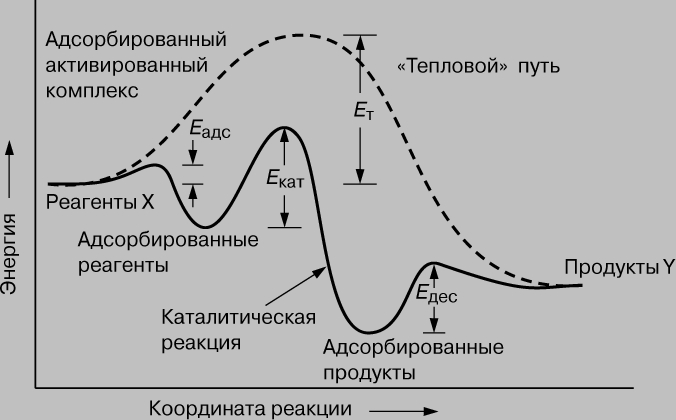
Рис. 1. ИЗМЕНЕНИЕ ЭНЕРГИИ РЕАГЕНТОВ при каталитическом и "тепловом" путях протекания реакции.
Рассмотрим сначала некаталитический, "тепловой" путь. Чтобы реакция смогла осуществиться, потенциальная энергия молекул X должна превысить энергетический барьер Eт. Каталитическая же реакция состоит из трех стадий. Первая - образование комплекса Х-Кат. (хемосорбция), энергия активации которой равна Еадс. Вторая стадия - перегруппировка Х-Кат. (r) Y-Кат. с энергией активации Екат, и наконец, третья - десорбция с энергией активации Едес; Еадс, Екат и Едес много меньше Ет. Поскольку скорость реакции экспоненциально зависит от энергии активации, каталитическая реакция протекает значительно быстрее тепловой при данной температуре. Катализатор можно уподобить инструктору-проводнику, который ведет альпинистов (реагирующие молекулы) через горный хребет. Он проводит одну группу через перевал и затем возвращается за следующей. Путь через перевал лежит значительно ниже того, который лежит через вершину (тепловой канал реакции), и группа совершает переход быстрее, чем без проводника (катализатора). Возможно даже, что самостоятельно группа вообще не смогла бы преодолеть хребет.
Теории катализа. Для объяснения механизма каталитических реакций были предложены три группы теорий: геометрические, электронные и химическая. В геометрических теориях основное внимание обращено на соответствие между геометрической конфигурацией атомов активных центров катализатора и атомов той части реагирующих молекул, которая ответственна за связывание с катализатором. Электронные теории исходят из представления, что хемосорбция обусловливается электронным взаимодействием, связанным с переносом заряда, т.е. эти теории связывают каталитическую активность с электронными свойствами катализатора. Химическая теория рассматривает катализатор как химическое соединение с характерными свойствами, которое образует химические связи с реагентами, в результате чего формируется нестабильный переходный комплекс. После распада комплекса с высвобождением продуктов катализатор возвращается в исходное состояние. Последняя теория считается сейчас наиболее адекватной. На молекулярном уровне каталитическую газофазную реакцию можно представить следующим образом. Одна реагирующая молекула связывается с активным центром катализатора, а другая взаимодействует с ней, находясь непосредственно в газовой фазе. Возможен и альтернативный механизм: реагирующие молекулы адсорбируются на соседних активных центрах катализатора, а потом взаимодействуют друг с другом. По-видимому, именно таким образом протекает большинство каталитических реакций. Другая концепция предполагает, что существует связь между пространственным расположением атомов на поверхности катализатора и его каталитической активностью. Скорость одних каталитических процессов, в том числе многих реакций гидрирования, не зависит от взаимного расположения каталитически активных атомов на поверхности; скорость других, напротив, существенно изменяется при изменении пространственной конфигурации поверхностных атомов. В качестве примера можно привести изомеризацию неопентана в изопентан и одновременный крекинг последнего до изобутана и метана на поверхности катализатора Pt-Al2O3.
ПРИМЕНЕНИЕ КАТАЛИЗА В ПРОМЫШЛЕННОСТИ
Тот бурный промышленный рост, который мы сейчас переживаем, был бы невозможен без развития новых химических технологий. В значительной мере этот прогресс определяется широким применением катализаторов, с помощью которых низкосортное сырье превращается в высокоценные продукты. Образно говоря, катализатор - это философский камень современного алхимика, только он превращает не свинец в золото, а сырье в лекарства, пластмассы, химические реактивы, топливо, удобрения и другие полезные продукты. Пожалуй, самый первый каталитический процесс, который человек научился использовать, - это брожение. Рецепты приготовления алкогольных напитков были известны шумерам еще за 3500 до н.э.
См. ВИНО; ПИВО. Значительной вехой в практическом применении катализа стало производство маргарина каталитическим гидрированием растительного масла. Впервые эта реакция в промышленном масштабе была осуществлена примерно в 1900. А начиная с 1920-х годов один за другим были разработаны каталитические способы получения новых органических материалов, прежде всего пластмасс. Ключевым моментом стало каталитическое получение олефинов, нитрилов, эфиров, кислот и т.д. - "кирпичиков" для химического "строительства" пластмасс. Третья волна промышленного использования каталитических процессов приходится на 1930-е годы и связана с переработкой нефти. По своему объему это производство вскоре оставило далеко позади все другие. Переработка нефти состоит из нескольких каталитических процессов: крекинга, риформинга, гидросульфирования, гидрокрекинга, изомеризации, полимеризации и алкилирования. И наконец, четвертая волна в использовании катализа связана с охраной окружающей среды. Наиболее известное достижение в этой области - создание каталитического нейтрализатора выхлопных газов автомобилей. Каталитические нейтрализаторы, которые устанавливают на автомобили с 1975, сыграли большую роль в улучшении качества воздуха и сберегли таким образом много жизней. За работы в области катализа и смежных областей было присуждено около десятка Нобелевских премий. О практической значимости каталитических процессов свидетельствует тот факт, что на долю азота, входящего в состав полученных промышленным путем азотсодержащих соединений, приходится около половины всего азота, входящего в состав пищевых продуктов. Количество соединений азота, образующихся естественным путем, ограничено, так что производство пищевого белка зависит от количества азота, вносимого в почву с удобрениями. Невозможно было бы прокормить и половину человечества без синтетического аммиака, который получают почти исключительно с помощью каталитического процесса Габера - Боша. Область применения катализаторов постоянно расширяется. Важно и то, что катализ позволяет значительно повысить эффективность ранее разработанных технологий. В качестве примера можно привести усовершенствование каталитического крекинга благодаря использованию цеолитов.
Гидрирование. Большое число каталитических реакций связано с активацией атома водорода и какой-либо другой молекулы, приводящей к их химическому взаимодействию. Этот процесс называется гидрированием и лежит в основе многих этапов переработки нефти и получения жидкого топлива из угля (процесс Бергиуса). Производство авиационного бензина и моторного топлива из угля было развито в Германии во время Второй мировой войны, поскольку в этой стране нет нефтяных месторождений. Процесс Бергиуса заключается в непосредственном присоединении водорода к углю. Уголь нагревают под давлением в присутствии водорода и получают жидкий продукт, который затем перерабатывают в авиационный бензин и моторное топливо. В качестве катализатора используют оксид железа, а также катализаторы на основе олова и молибдена. Во время войны на 12 заводах Германии с помощью процесса Бергиуса получали примерно 1400 т жидкого топлива в сутки. Другой процесс, Фишера - Тропша, состоит из двух стадий. Вначале уголь газифицируют, т.е. проводят реакцию его с водяным паром и кислородом и получают смесь водорода и оксидов углерода. Эту смесь превращают в жидкое топливо с помощью катализаторов, содержащих железо или кобальт. С окончанием войны производство синтетического топлива из угля в Германии было прекращено. В результате повышения цен на нефть, последовавшего за нефтяным эмбарго в 1973-1974, были предприняты энергичные усилия по разработке экономически выгодного способа получения бензина из угля. Так, прямое ожижение угля можно проводить более эффективно, используя двухстадийный процесс, в котором сначала уголь контактирует с алюмокобальтомолибденовым катализатором при относительно низкой, а затем при более высокой температуре. Стоимость такого синтетического бензина выше, чем получаемого из нефти.
Аммиак. Один из самых простых с химической точки зрения процессов гидрирования - синтез аммиака из водорода и азота. Азот весьма инертное вещество. Для разрыва связи N-N в его молекуле необходима энергия порядка 200 ккал/моль. Однако азот связывается с поверхностью железного катализатора в атомарном состоянии, и для этого нужно всего 20 ккал/моль. Водород связывается с железом еще более охотно. Синтез аммиака протекает следующим образом:
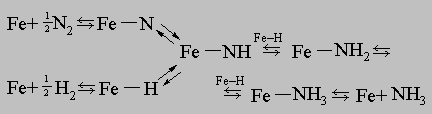
Этот пример иллюстрирует способность катализатора ускорять в равной степени как прямую, так и обратную реакцию, т.е. тот факт, что катализатор не изменяет положение равновесия химической реакции. Гидрирование растительного масла. Одна из важнейших в практическом отношении реакций гидрирования - неполное гидрирование растительных масел до маргарина, кулинарного жира и других пищевых продуктов. Растительные масла получают из соевых бобов, семян хлопчатника и других культур. В их состав входят эфиры, а именно триглицериды жирных кислот с разной степенью ненасыщенности. Олеиновая кислота СН3(СН2)7СН=СН(СН2)7СООН имеет одну двойную связь С=С, линолевая кислота - две и линоленовая - три. Присоединение водорода с разрывом этой связи предотвращает окисление масел (прогоркание). При этом повышается их температура плавления. Твердость большинства получаемых продуктов зависит от степени гидрирования. Гидрирование проводят в присутствии мелкодисперсного порошка никеля, нанесенного на подложку, или никелевого катализатора Ренея в атмосфере водорода высокой степени очистки.
Дегидрирование. Дегидрирование - это тоже важная в промышленном отношении каталитическая реакция, хотя масштабы ее применения несравнимо меньше. С ее помощью получают, например, стирол - важный мономер. Для этого дегидрируют этилбензол в присутствии катализатора, содержащего оксид железа; протеканию реакции способствуют также калий и какой-нибудь структурный стабилизатор. В промышленных масштабах осуществляют дегидрирование пропана, бутана и других алканов. Дегидрированием бутана в присутствии алюмохромового катализатора получают бутены и бутадиен.
Кислотный катализ. Каталитическая активность большого класса катализаторов обусловливается их кислотными свойствами. Согласно И.
Бренстеду и Т. Лоури, кислота - это соединение, способное отдавать протон. Сильные кислоты легко отдают свои протоны основаниям. Концепция кислотности получила дальнейшее развитие в работах Г.Льюиса, который дал определение кислоты как вещества, способного принимать электронную пару от вещества-донора с образованием ковалентной связи за счет обобществления этой электронной пары. Эти идеи вместе с представлениями о реакциях с образованием карбений-ионов помогли понять механизм разнообразных каталитических реакций, особенно тех, в которых участвуют углеводороды. Силу кислоты можно определить с помощью набора оснований, изменяющих цвет при присоединении протона. Оказывается, некоторые промышленно важные катализаторы ведут себя как очень сильные кислоты. К ним относится катализатор процесса Фриделя - Крафтса, такой, как HCl-AlCl2O3 (или HAlCl4), и алюмосиликаты. Сила кислоты - это очень важная характеристика, поскольку от нее зависит скорость протонирования - ключевого этапа процесса кислотного катализа. Активность таких катализаторов, как алюмосиликаты, применяющихся при крекинге нефти, определяется присутствием на их поверхности кислот Бренстеда и Льюиса. Их структура аналогична структуре кремнезема (диоксида кремния), в котором часть атомов Si4+ замещена атомами Al3+. Лишний отрицательный заряд, возникающий при этом, может быть нейтрализован соответствующими катионами. Если катионами являются протоны, то алюмосиликат ведет себя как кислота Бренстеда:
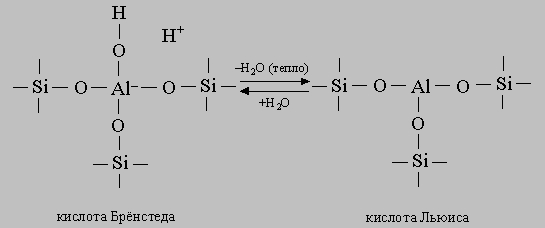
Активность кислотных катализаторов обусловливается их способностью реагировать с углеводородами с образованием в качестве промежуточного продукта карбений-иона. Алкилкарбений-ионы содержат положительно заряженный углеродный атом, связанный с тремя алкильными группами и/или атомами водорода. Они играют важную роль как промежуточные продукты, образующиеся во многих реакциях с участием органических соединений. Механизм действия кислотных катализаторов можно проиллюстрировать на примере реакции изомеризации н-бутана в изобутан в присутствии HCl-AlCl3 или Pt-Cl-Al2O3. Сначала малое количество олефина С4Н8 присоединяет положительно заряженный ион водорода кислотного катализатора с образованием третичного карбений-иона. Затем отрицательно заряженный гидрид-ион Н- отщепляется от н-бутана с образованием изобутана и вторичного бутилкарбений-иона. Последний в результате перегруппировки превращается в третичный карбений-ион. Эта цепочка может продолжаться с отщеплением гидрид-иона от следующей молекулы н-бутана и т.д.:
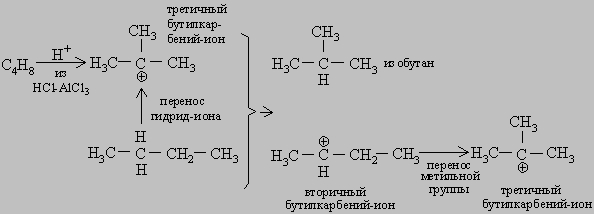
Существенно, что третичные карбений-ионы более стабильны, чем первичные или вторичные. Вследствие этого на поверхности катализатора присутствуют в основном именно они, а потому основным продуктом изомеризации бутана является изобутан. Кислотные катализаторы широко применяются при переработке нефти - крекинге, алкилировании, полимеризации и изомеризации углеводородов
(см. также ХИМИЯ И МЕТОДЫ ПЕРЕРАБОТКИ НЕФТИ).
Установлен механизм действия карбений-ионов, играющих роль катализаторов в этих процессах. При этом они участвуют в целом ряде реакций, включая образование малых молекул путем расщепления больших, соединение молекул (олефина с олефином или олефина с изопарафином), структурную перегруппировку путем изомеризации, образование парафинов и ароматических углеводородов путем переноса водорода. Одно из последних применений кислотного катализа в промышленности - получение этилированных топлив присоединением спиртов к изобутилену или изоамилену. Добавление кислородсодержащих соединений в бензин уменьшает концентрацию оксида углерода в выхлопных газах. Метил-трет-бутиловый эфир (МТБЭ) с октановым числом смешения 109 тоже позволяет получить высокооктановое топливо, необходимое для работы автомобильного двигателя с высокой степенью сжатия, не прибегая к введению в бензин тетраэтилсвинца. Организовано также производство топлив с октановыми числами 102 и 111.
Основной катализ. Активность катализаторов обусловливается их основными свойствами. Давним и хорошо известным примером таких катализаторов является гидроксид натрия, применяющийся для гидролиза или омыления жиров при получении мыла, а один из последних примеров - катализаторы, используемые при производстве полиуретановых пластиков и пенопластов. Уретан образуется при взаимодействии спирта с изоцианатом, а ускоряется эта реакция в присутствии оснвных аминов. В ходе реакции происходит присоединение основания к атому углерода в молекуле изоцианата, в результате чего на атоме азота появляется отрицательный заряд и его активность по отношению к спирту повышается. Особенно эффективным катализатором является триэтилендиамин. Полиуретановые пластики получают при взаимодействии диизоцианатов с полиолами (полиспиртами). Когда изоцианат реагирует с водой, ранее образовавшийся уретан разлагается с выделением CO2. При взаимодействии смеси полиспиртов и воды с диизоцианатами образующийся пенополиуретан вспенивается газообразным CO2.
Катализаторы двойного действия. Эти катализаторы ускоряют реакции двух типов и дают лучшие результаты, чем при пропускании реагентов последовательно через два реактора, каждый из которых содержит только один тип катализатора. Это связано с тем, что активные центры катализатора двойного действия находятся очень близко друг к другу, и промежуточный продукт, образующийся на одном из них, тут же превращается в конечный продукт на другом. Хороший результат дает объединение катализатора, активирующего водород, с катализатором, способствующим изомеризации углеводородов. Активацию водорода осуществляют некоторые металлы, а изомеризацию углеводородов - кислоты. Эффективным катализатором двойного действия, который применяется при переработке нефти для превращения нафты в бензин, является мелкодисперсная платина, нанесенная на кислый глинозем. Конверсия таких составляющих нафты, как метилциклопентан (МЦП), в бензол повышает октановое число бензина. Сначала МЦП дегидрируется на платиновой части катализатора в олефин с тем же углеродным остовом; затем олефин переходит на кислотную часть катализатора, где изомеризуется до циклогексена. Последний переходит на платиновую часть и дегидрируется до бензола и водорода. Катализаторы двойного действия существенно ускоряют риформинг нефти. Их используют для изомеризации нормальных парафинов в изопарафины. Последние, кипящие при тех же температурах, что и бензиновые фракции, ценны тем, что обладают более высоким октановым числом по сравнению с неразветвленными углеводородами. Кроме того, превращение н-бутана в изобутан сопровождается дегидрированием, способствуя получению МТБЭ.
Стереоспецифическая полимеризация. Важной вехой в истории катализа явилось открытие каталитической полимеризации a-олефинов с образованием стереорегулярных полимеров. Катализаторы стереоспецифической полимеризации были открыты К.Циглером, когда он пытался объяснить необычные свойства полученных им полимеров. Другой химик, Дж.Натта, предположил, что уникальность полимеров Циглера определяется их стереорегулярностью. Эксперименты по дифракции рентгеновских лучей показали, что полимеры, полученные из пропилена в присутствии катализаторов Циглера, высококристалличны и действительно имеют стереорегулярную структуру. Для описания таких упорядоченных структур Натта ввел термины "изотактический" и "синдиотактический". В том случае, когда упорядоченность отсутствует, используется термин "атактический":
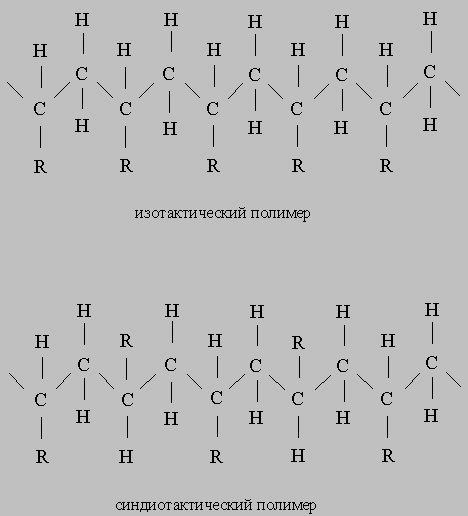
Стереоспецифическая реакция протекает на поверхности твердых катализаторов, содержащих переходные металлы групп IVA-VIII (такие, как Ti, V, Cr, Zr), находящиеся в неполностью окисленном состоянии, и какое-либо соединение, содержащее углерод или водород, который связан с металлом из групп I-III. Классическим примером такого катализатора является осадок, образующийся при взаимодействии TiCl4 и Al(C2H5)3 в гептане, где титан восстановлен до трехвалентного состояния. Эта исключительно активная система катализирует полимеризацию пропилена при обычных температуре и давлении.
Каталитическое окисление. Применение катализаторов для управления химизмом процессов окисления имеет большое научное и практическое значение. В некоторых случаях окисление должно быть полным, например при нейтрализации СО и углеводородных загрязнений в выхлопных газах автомобилей. Однако чаще нужно, чтобы окисление было неполным, например во многих широко применяемых в промышленности процессах превращения углеводородов в ценные промежуточные продукты, содержащие такие функциональные группы, как -СНО, -СООН, -С-СО, -СN. При этом применяются как гомогенные, так и гетерогенные катализаторы. Примером гомогенного катализатора является комплекс переходного металла, который используется для окисления пара-ксилола до терефталевой кислоты, эфиры которой служат основой производства полиэфирных волокон.
Катализаторы гетерогенного окисления. Эти катализаторы обычно являются сложными твердыми оксидами. Каталитическое окисление проходит в два этапа. Сначала кислород оксида захватывается адсорбированной на поверхности оксида молекулой углеводорода. Углеводород при этом окисляется, а оксид восстанавливается. Восстановленный оксид взаимодействует с кислородом и возвращается в исходное состояние. Используя ванадиевый катализатор, неполным окислением нафталина или бутана получают фталевый ангидрид.
Получение этилена путем дегидродимеризации метана. Синтез этилена посредством дегидродимеризации позволяет превращать природный газ в более легко транспортируемые углеводороды. Реакцию 2CH4 + 2O2 -> C2H4 + 2H2O проводят при 850° С с использованием различных катализаторов; наилучшие результаты получены с катализатором Li-MgO. Предположительно реакция протекает через образование метильного радикала путем отщепления атома водорода от молекулы метана. Отщепление осуществляется неполностью восстановленным кислородом, например О22-. Метильные радикалы в газовой фазе рекомбинируют с образованием молекулы этана и в ходе последующего дегидрирования превращаются в этилен. Еще один пример неполного окисления - превращение метанола в формальдегид в присутствии серебряного или железомолибденового катализатора.
Цеолиты. Цеолиты составляют особый класс гетерогенных катализаторов. Это алюмосиликаты с упорядоченной сотовой структурой, размер ячеек которой сравним с размером многих органических молекул. Их называют еще молекулярными ситами. Наибольший интерес представляют цеолиты, поры которых образованы кольцами, состоящими из 8-12 ионов кислорода (рис. 2). Иногда поры перекрываются, как у цеолита ZSМ-5 (рис. 3), который используется для высокоспецифичного превращения метанола в углеводороды бензиновой фракции. Бензин содержит в значительных количествах ароматические углеводороды и поэтому имеет высокое октановое число. В Новой Зеландии, например, с помощью этой технологии получают треть всего потребляемого бензина. Метанол же получают из импортируемого метана.
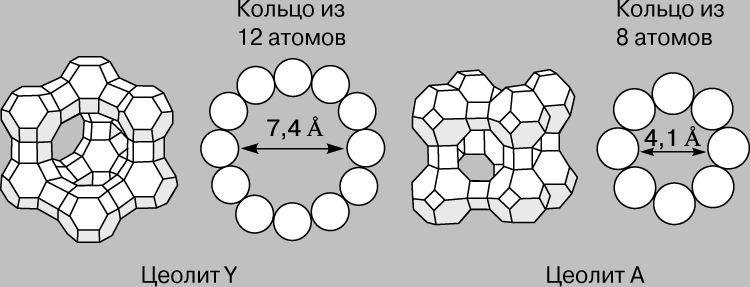
Рис. 2. СТРУКТУРА ЦЕОЛИТОВ с большими и малыми порами.

Рис. 3. ЦЕОЛИТ ZSM-5. Схематическое представление структуры в виде пересекающихся трубок.
Катализаторы, составляющие группу Y-цеолитов, существенно повышают эффективность каталитического крекинга благодаря в первую очередь своим необычным кислотным свойствам. Замена алюмосиликатов цеолитами позволяет увеличить выход бензина более чем на 20%. Кроме того, цеолиты обладают селективностью в отношении размера реагирующих молекул. Их селективность обусловлена размером пор, через которые могут проходить молекулы лишь определенных размеров и формы. Это касается как исходных веществ, так и продуктов реакции. Например, вследствие стерических ограничений пара-ксилол образуется легче, чем более объемные орто- и мета-изомеры. Последние оказываются "запертыми" в порах цеолита (рис. 4).
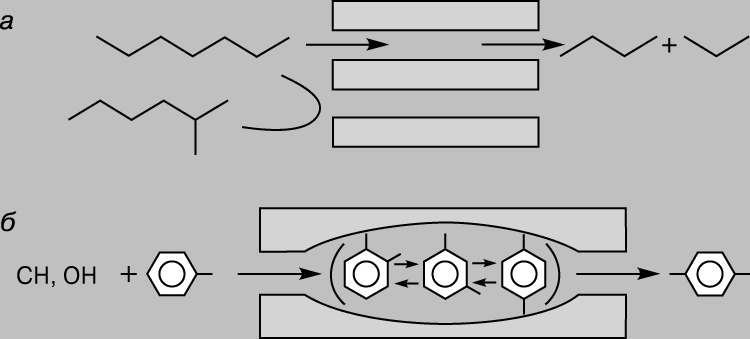
Рис. 4. СХЕМА, объясняющая селективность цеолитов в отношении реагентов (а) и продуктов (б).
Применение цеолитов произвело настоящую революцию в некоторых промышленных технологиях - депарафинизации газойля и машинного масла, получении химических полупродуктов для производства пластмасс алкилированием ароматических соединений, изомеризации ксилола, диспропорционировании толуола и каталитическом крекинге нефти. Особенно эффективен здесь цеолит ZSM-5.
Катализаторы и охрана окружающей среды. Применение катализаторов для уменьшения загрязнения воздуха началось в конце 1940-х годов. В 1952 А. Хаген-Смит установил, что углеводороды и оксиды азота, входящие в состав выхлопных газов, реагируют на свету с образованием оксидантов (в частности, озона), которые оказывают раздражающее действие на глаза и дают другие нежелательные эффекты. Примерно в это же время Ю.Хоудри разработал способ каталитической очистки выхлопных газов путем окисления CO и углеводородов до CO2 и Н2О. В 1970 была сформулирована Декларация о чистом воздухе (уточненная в 1977, расширенная в 1990), согласно которой все новые автомобили, начиная с моделей 1975, должны снабжаться каталитическими нейтрализаторами выхлопных газов. Были установлены нормы для состава выхлопных газов. Поскольку соединения свинца, добавляемые в бензин, отравляют катализаторы, принята программа поэтапного отказа от них. Обращалось внимание и на необходимость снижения содержания оксидов азота. Специально для автомобильных нейтрализаторов созданы катализаторы, в которых активные компоненты нанесены на керамическую подложку с сотовой структурой, через ячейки которой проходят выхлопные газы. Подложку покрывают тонким слоем оксида металла, например Al2O3, на который наносят катализатор - платину, палладий или родий. Содержание оксидов азота, образующихся при сжигании природных топлив на теплоэлектростанциях, можно уменьшить добавлением в дымовые газы малых количеств аммиака и пропусканием их через титанованадиевый катализатор.
Ферменты. Ферменты - это природные катализаторы, регулирующие биохимические процессы в живой клетке. Они участвуют в процессах энергообмена, расщеплении питательных веществ, реакциях биосинтеза. Без них не могут протекать многие сложные органические реакции. Ферменты функционируют при обычных температуре и давлении, обладают очень высокой селективностью и способны увеличивать скорость реакций на восемь порядков. Несмотря на эти преимущества, лишь ок. 20 из 15 000 известных ферментов применяются в широких масштабах. Человек тысячелетиями использовал ферменты при выпечке хлеба, получении алкогольных напитков, сыра и уксуса. Сейчас ферменты применяются и в промышленности: при переработке сахара, получении синтетических антибиотиков, аминокислот и белков. Протеолитические ферменты, ускоряющие процессы гидролиза, добавляют в детергенты. С помощью бактерий Clostridium acetobutylicum Х. Вейцман осуществил ферментативное превращение крахмала в ацетон и бутиловый спирт. Этот способ получения ацетона широко использовался в Англии во время Первой мировой войны, а во время Второй мировой войны с его помощью в СССР изготавливали бутадиеновый каучук. Исключительно большую роль сыграло применение ферментов, продуцируемых микроорганизмами, для синтеза пенициллина, а также стрептомицина и витамина B12. Этиловый спирт, получаемый ферментативным путем, широко используют в качестве автомобильного топлива. В Бразилии более трети из примерно 10 млн. автомобилей работают на 96%-ном этиловом спирте, получаемом из сахарного тростника, а остальные - на смеси бензина и этилового спирта (20%). Хорошо отработана технология производства топлива, представляющего собой смесь бензина и спирта, в США. В 1987 из зерен кукурузы было получено ок. 4 млрд. л спирта, из них примерно 3,2 млрд. л было использовано в качестве топлива. Разнообразное применение находят и т.н. иммобилизованные ферменты. Эти ферменты связаны с твердым носителем, например силикагелем, над которым пропускают реагенты. Преимущество этого метода состоит в том, что он обеспечивает эффективное контактирование субстратов с ферментом, разделение продуктов и сохранение фермента. Один из примеров промышленного использования иммобилизованных ферментов - изомеризация D-глюкозы во фруктозу.
ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ
Современные технологии невозможно представить без применения катализаторов. Каталитические реакции могут протекать при температурах до 650° С и давлениях 100 атм и более. Это заставляет по-новому решать проблемы, связанные с контактированием между газообразными и твердыми веществами и с переносом частиц катализатора. Чтобы процесс был эффективным, при его моделировании необходимо учитывать кинетические, термодинамические и гидродинамические аспекты. Здесь широко используются компьютерное моделирование, а также новые приборы и ме
КАТАЛИЗ (от греческого katalysis - разрушение), ускорение химической реакции в присутствии вещества - катализатора, который взаимодействует с реагентами, но в реакции не расходуется и не входит в состав конечных продуктов. Использование катализаторов позволяет проводить химические процессы при небольших температурах с предпочтительным образованием одного продукта из нескольких возможных. Каталитическими процессами являются производство аммиака, серной кислоты, многих полимеров и др. Многие процессы в живых организмах ускоряются катализаторами - ферментами.
ката́лиз, ката́лизы, ката́лиза, ката́лизов, ката́лизу, ката́лизам, ката́лизом, ката́лизами, ката́лизе, ката́лизах
ката́лиз
((гр. katalysis разрушение) возбуждение хим. реакции или изменение её скорости небольшими добавками веществ (катализаторов); хим. промышленность широко использует к. (при получении аммиака, серной и азотной кислот, моторного топлива, разнообразных полимеров и т. д.).
КАТАЛИЗ а, м. catalyse f. <гр. katalysis прекращение. Изменение скорости химической реакции под влиянием некоторых веществ (катализаторов). БАС-1. Заимствовано из фр. яз. в 1837 г. Впервые фиксируется в "Горном журнале" 1837 г. (2 5 380) в переведенной с фр. работе Берцелиуса "Некоторые идеи о новой силе, действующей при соединении органических тел". ЭС. Катализатор а, м. перен. В определенные моменты истории благодаря сочетанию факторов определенные личности становятся катализаторами процесса, приобретают большую, чем жизнь, значимость. Гилберт Докторов Не стоило этого делать. // Звезда 2003 6 180. - Лекс. САН 1908: катали/з; Уш. 1934: катали/з.
КАТАЛИЗА ИНСТИТУТ Сибирского отделения РАН - основан в 1958 в Новосибирске. Исследования по научным основам каталитических процессов; разработка новых каталитических процессов и катализаторов.
м.
1. Вещество, увеличивающее скорость химической реакции.
2. перен.
Факт, явление, являющиеся усилителем, ускорителем тех или иных процессов в жизни общества, способствующие его развитию.
КАТАЛИЗА́ТОР, катализатора, муж. (см. катализ) (хим.). Вещество, ускоряющее или замедляющее химическую реакцию, само при этом не изменяющееся.
КАТАЛИЗА́ТОР, -а, муж. (спец.). Вещество, изменяющее скорость химической реакции.
| прил. катализаторный, -ая, -ое.
КАТАЛИЗА́ТОР, -а, м Спец.
Вещество, ускоряющее химическую реакцию или возбуждающее такую реакцию.
Катализаторами служат синтетические силикаты, металлы платиновой группы, серебро, никель и др.
КАТАЛИЗА́ТОР -а; м. Хим.
1. Вещество, изменяющее скорость химической реакции.
2. О факте, явлении, способствующем ускорению, развитию чего-л. К. прогресса.
катализа́тор, катализа́торы, катализа́тора, катализа́торов, катализа́тору, катализа́торам, катализа́тором, катализа́торами, катализа́торе, катализа́торах
сущ., кол-во синонимов: 11
биокатализатор (1)
гопкалит (2)
нанокатализатор (1)
сиккатив (3)
сульфурилхлорид (2)
ускоритель (37)
фермент (253)
фотокатализатор (1)
экокатализатор (1)
энзим (33)
катализатор - вещество, которое влияет на химическую реакцию, оставаясь в итоге неизменным;
ускоритель взаимодействия.
ингибитор.
гопкалит. | промотор.
катализ. автокатализ.
катализа́тор
(см. катализ) вещество, изменяющее скорость хим. реакции; катализаторы играют огромную роль в промышленности (см ингибитор).
- «Педаль газа» для химиков.
- Погонщик химических процессов.
- «Допинг» для химической реакции.
- Вещество, изменяющее скорость химической реакции.
- Акселератор химической реакции.
Катализа́торы - вещества, ускоряющие химические реакции. Вещества, замедляющие реакции, называются ингибиторами. Биологические катализаторы называются ферментами. Катализаторами служат синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др.
* * *
КАТАЛИЗАТОРЫ - КАТАЛИЗА́ТОРЫ, вещества, ускоряющие химические реакции. Вещества, замедляющие реакции, называются ингибиторами. Биологические катализаторы называются ферментами. Катализаторами служат синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др.
КАТАЛИЗАТОРЫ - вещества, ускоряющие химические реакции. Вещества, замедляющие реакции, называются ингибиторами. Биологические катализаторы называются ферментами. Катализаторами служат синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др.
катализаторы
[< гр.; см. катализ] - вещества, которые изменяют скорость химических реакций одним только своим присутствием, сами же не изменяются (например, пористая платина и др.); играют огромную роль в технике
КАТАЛИЗИРОВАТЬ catalyser, нем. katalisieren. хим. Фиксируется только в Орфографическом сл. 1956 г. КатализИровать. ЭС. перен. Роль отечественной интеллигенции, катализирующей бесконечные идейные искания, весьма сомнительна. Звезда 2001 1 235. Катализироваться. Катализируется вещество при электролизе. Природа 1937 8 62. - Лекс. Орф. 1971: катализи/ровать, катализи/роваться.