м.
1. Химический элемент, газ без цвета и запаха, входящий в состав воздуха, необходимый для дыхания и горения и образующий в соединении с водородом воду.
2. перен.
Что-либо важное, необходимое для жизни (обычно духовной).
м.
1. Химический элемент, газ без цвета и запаха, входящий в состав воздуха, необходимый для дыхания и горения и образующий в соединении с водородом воду.
2. перен.
Что-либо важное, необходимое для жизни (обычно духовной).
КИСЛОРО́Д, кислорода, мн. нет, муж. Газ, химический элемент, входящий в состав воздуха и необходимый для дыхания. В тесной комнате чувствуется недостаток кислорода.
КИСЛОРО́Д, -а (-у), муж. Химический элемент, бесцветный газ, входящий в состав воздуха, необходимый для дыхания и горения.
| прил. кислородный, -ая, -ое. Кислородное голодание, кислородная недостаточность (пониженное содержание кислорода в организме; спец.).
КИСЛОРО́Д, -а (-у), м
Химический элемент, бесцветный газ, входящий в состав воздуха, необходимый для дыхания и горения и образующий вместе с водородом пену.
Кислород, будучи самым распространенным на Земле элементом, в виде соединений составляет около половины массы земной коры; входит в состав воды (88, 8 % по массе) и многих тканей живых организмов.
КИСЛОРО́Д -а; м. Химический элемент (O), газ без цвета и запаха, входящий в состав воздуха, необходимый для дыхания и горения и образующий в соединении с водородом воду.
◊ Перекрыть кислоро́д кому-л. Создать невыносимые условия жизни, работы.
◁ Кислоро́дный, -ая, -ое. К-ая среда. К-ые соединения. К-ая резка (газовая резка). К-ая сварка (газовая сварка). К-ое голодание; к-ая недостаточность (мед.; понижение содержания кислорода в тканях организма; гипоксия).
◊ Кислоро́дная подушка (см. Поду́шка).
* * *
кислоро́д (лат. Oxygenium), химический элемент VI группы периодической системы. В свободном виде встречается в виде двух модификаций - О2 («обычный» кислород) и О3 (озон). О2 - газ без цвета и запаха, плотность 1,42897 г/л, tпл -218,6ºC, tкип -182,96ºC. Химически самый активный (после фтора) неметалл. С большинством других элементов (водородом, галогенами, серой, многими металлами и т. д.) взаимодействует непосредственно (окисление) и, как правило, с выделением энергии. При повышении температуры скорость окисления возрастает и может начаться горение. Животные и растения получают необходимую для жизни энергию за счёт биологического окисления различных веществ кислородом, поступающим в организмы при дыхании. Самый распространённый на Земле элемент; в виде соединений составляет около 1/2 массы земной коры; входит в состав воды (88,8% по массе) и многих тканей живых организмов (около 70% по массе). Свободный кислород атмосферы (20,95% по объёму) образовался и сохраняется благодаря фотосинтезу. Кислород (или обогащённый им воздух) применяется в металлургии, химической промышленности, в медицине, кислородно-дыхательных аппаратах. Жидкий кислород - компонент ракетного топлива.

* * *
КИСЛОРОД - КИСЛОРО́Д (лат. Oхygenium), O (читается «о»), химический элемент с атомным номером 8, атомная масса 15,9994. В периодической системе элементов Менделеева расположен во втором периоде в группе VIA.
Природный кислород состоит из смеси трех стабильных нуклидов (см. НУКЛИД) с массовыми числами 16 (доминирует в смеси, его в ней 99,759 % по массе), 17 (0,037%) и 18 (0,204%). Радиус нейтрального атома кислорода 0,066 нм. Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кислорода 2s2р4. Энергии последовательной ионизации атома кислорода 13,61819 и 35,118 эВ, сродство к электрону 1,467 эВ. Радиус иона О2-при разных координационных числах от 0,121 нм (координационное число 2) до 0,128 нм (координационное число 8). В соединениях проявляет степень окисления -2 (валентность II) и, реже, -1 (валентность I). По шкале Полинга электроотрицательность кислорода 3,5 (второе место среди неметаллов после фтора (см. ФТОР) ).
В свободном виде кислород - газ без цвета, запаха и вкуса.
История открытия
История открытия кислорода, как и азота, связана с продолжавшимся несколько веков изучением атмосферного воздуха. О том, что воздух по своей природе не однороден, а включает части, одна из которых поддерживает горение и дыхание, а другая - нет, знали еще в 8 веке китайский алхимик Мао Хоа, а позднее в Европе - Леонардо да Винчи (см. ЛЕОНАРДО ДА ВИНЧИ). В 1665 английский естествоиспытатель Р. Гук (см. ГУК Роберт) писал, что воздух состоит из газа, содержащегося в селитре (см. СЕЛИТРЫ), а также из неактивного газа, составляющего большую часть воздуха. О том, что воздух содержит элемент, поддерживающий жизнь, в 18 веке было известно многим химикам. Шведский аптекарь и химик Карл Шееле (см. ШЕЕЛЕ Карл Вильгельм) начал изучать состав воздуха в 1768. В течение трех лет он разлагал нагреванием селитры (KNO3, NaNO3) и другие вещества и получал «огненный воздух», поддерживающий дыхание и горение. Но результаты своих опытов Шееле обнародовал только в 1777 году в книге «Химический трактат о воздухе и огне». В 1774 английский священник и натуралист Дж. Пристли (см. ПРИСТЛИ Джозеф) нагреванием «жженой ртути» (оксида ртути HgO) получил газ, поддерживающий горение. Будучи в Париже, Пристли, не знавший, что полученный им газ входит в состав воздуха, сообщил о своем открытии А. Лавуазье (см. ЛАВУАЗЬЕ Антуан Лоран) и другим ученым. К этому времени был открыт и азот. В 1775 Лавуазье пришел к выводу, что обычный воздух состоит из двух газов - газа, необходимого для дыхания и поддерживающего горение, и газа «противоположного характера» - азота. Лавуазье назвал поддерживающий горение газ oxygene - «образующий кислоты» (от греч. oxys - кислый и gennao - рождаю; отсюда и русское название «кислород»), так как он тогда считал, что все кислоты содержат кислород. Давно уже известно, что кислоты бывают как кислородсодержащими, так и бескислородными, но название, данное элементу Лавуазье, осталось неизменным. На протяжении почти полутора веков 1/16 часть массы атома кислорода служила единицей сравнения масс различных атомов между собой и использовалась при численной характеристике масс атомов различных элементов (так называемая кислородная шкала атомных масс).
Нахождение в природе
Кислород - самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов (см. СИЛИКАТЫ)), приходится около 47,4% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода - 88,8% (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % (по объему). Элемент кислород входит в состав более 1500 соединений земной коры.
Получение
В настоящее время кислород в промышленности получают за счет разделения воздуха при низких температурах. Сначала воздух сжимают компрессором, при этом воздух разогревается. Сжатому газу дают охладиться до комнатной температуры, а затем обеспечивают его свободное расширение. При расширении температура газа резко понижается. Охлажденный воздух, температура которого на несколько десятков градусов ниже температуры окружающей среды, вновь подвергают сжатию до 10-15 МПа. Затем снова отбирают выделившуюся теплоту. Через несколько циклов «сжатие-расширение» температура падает ниже температуры кипения и кислорода, и азота. Образуется жидкий воздух, который затем подвергают перегонке (дистилляции). Температура кипения кислорода (-182,9°C) более чем на 10 градусов выше, чем температура кипения азота (-195,8°C). Поэтому из жидкости азот испаряется первым, а в остатке накапливается кислород. За счет медленной (фракционной) дистилляции удается получить чистый кислород, в котором содержание примеси азота составляет менее 0,1 объемного процента.
Еще более чистый кислород можно получить при электролизе водных растворов щелочей (NaOH или KOH) или солей кислородсодержащих кислот (обычно используют раствор сульфата натрия Na2SO4). В лаборатории небольшие количества не очень чистого кислорода можно получить при нагревании перманганата калия KMnO4:
2KMnO4 = K2MnO4 + MnO2 + O2.
Более чистый кислород получают разложением пероксида водорода Н2О2 в присутствии каталитических количеств твердого диоксида марганца MnO2:
2Н2О2 = 2Н2О + О2.
Кислород образуется при сильном (выше 600°C) прокаливании нитрата натрия NaNO3:
2NaNO3 =2NaNO2 + О2,
при нагревании некоторых высших оксидов:
4CrO3= 2Cr2O3 + 3О2;
2PbO2 = 2PbO + О2;
3MnO2 = Mn3O4 + О2.
Ранее кислород получали разложением бертолетовой соли (см. БЕРТОЛЕТОВА СОЛЬ) KClO3 в присутствии каталитических количеств диоксида марганца MnO2:
2KClO3 = 2KCl + 3О2.
Однако бертолетова соль образует взрывчатые смеси, поэтому ее для получения кислорода в лабораториях теперь не используют. Разумеется, сейчас никому в голову не придет использовать для получения кислорода прокаливание оксида ртути HgO, так как образующийся в этой реакции кислород загрязнен ядовитыми парами ртути.
Источником кислорода в космических кораблях, подводных лодках и т. п. замкнутых помещениях служит смесь пероксида натрия Na2O2 и супероксида калия KO2. При взаимодействии этих соединений с углекислым газом освобождается кислород:
2Na2O2 + 2CO2 = 2Na2CO3 + O2,
4КО2 + 2СО2 = 2К2СО3 + 3О2.
Если использовать смесь Na2O2 и КО2, взятых в молярном отношении 1:1, то на каждый моль поглощенного из воздуха углекислого газа будет выделяться 1 моль кислорода, так что состав воздуха не будет изменяться за счет поглощения при дыхании кислорода и выделения СО2.
Особенности строения молекулы О 2
Атмосферный кислород состоит из двухатомных молекул. Межатомное расстояние в молекуле О2 0,12074 нм. Молекулярный кислород (газообразный и жидкий) - парамагнитное вещество, в каждой молекуле О2 имеется по 2 неспаренных электрона. Этот факт можно объяснить тем, что в молекуле на каждой из двух разрыхляющих орбиталей находится по одному неспаренному электрону.
Энергия диссоциации молекулы О2 на атомы довольно высока и составляет 493,57 кДж/моль.
Физические и химические свойства
При нормальных условиях плотность газа кислорода 1,42897 кг/м3. Температура кипения жидкого кислорода (жидкость имеет голубой цвет) -182,9°C. При температурах от -218,7°C до -229,4°C существует твердый кислород с кубической решеткой (a-модификация), при температурах от -229,4°C до -249,3°C - b-модификация с гексагональной решеткой и при температурах ниже -249,3°C - кубическая g-модификация. При повышенном давлении и низких температурах получены и другие модификации твердого кислорода.
При 20°C растворимость газа О2: 3,1 мл на 100 мл воды, 22 мл на 100 мл этанола, 23,1 мл на 100 мл ацетона. Существуют органические фторсодержащие жидкости (например, перфторбутилтетрагидрофуран), в которых растворимость кислорода значительно более высокая.
Высокая прочность химической связи между атомами в молекуле О2приводит к тому, что при комнатной температуре газообразный кислород химически довольно малоактивен. В природе он медленно вступает в превращения при процессах гниения. Кроме того, кислород при комнатной температуре способен реагировать с гемоглобином (см. ГЕМОГЛОБИН) крови (точнее с железом II гема (см. ГЕМ) ), что обеспечивает перенос кислорода от органов дыхания к другим органам.
Со многими веществами кислород вступает во взаимодействие без нагревания, например, с щелочными и щелочноземельными металлами (образуются соответствующие оксиды типа Li2O, CaO и др., пероксиды типа Na2O2, BaO2 и др. и супероксиды типа КО2, RbO2 и др.), вызывает образование ржавчины на поверхности стальных изделий. Без нагревания кислород реагирует с белым фосфором, с некоторыми альдегидами и другими органическими веществами.
При нагревании, даже небольшом, химическая активность кислорода резко возрастает. При поджигании он реагирует со взрывом с водородом, метаном, другими горючими газами, с большим числом простых и сложных веществ. Известно, что при нагревании в атмосфере кислорода или на воздухе многие простые и сложные вещества сгорают, причем образуются различные оксиды, например:
S+O2 = SO2; С + O2 = СО2
4Fe + 3O2 = 2Fe2O3; 2Cu + O2 = 2CuO
4NH3 + 3O2 = 2N2 + 6H2O; 2H2S + 3O2 = 2H2O + 2SO2
Если смесь кислорода и водорода хранить в стеклянном сосуде при комнатной температуре, то экзотермическая реакция образования воды
2Н2 + О2= 2Н2О + 571 кДж
протекает крайне медленно; по расчету, первые капельки воды должны появиться в сосуде примерно через миллион лет. Но при внесении в сосуд со смесью этих газов платины или палладия (играющих роль катализатора), а также при поджигании реакция протекает со взрывом.
С азотом N2 кислород реагирует или при высокой температуре (около 1500-2000°C), или при пропускании через смесь азота и кислорода электрического разряда. При этих условиях обратимо образуется оксид азота (II):
N2 + O2 = 2NO
Возникший NO затем реагирует с кислородом с образованием бурого газа (диоксида азота):
2NO + О2 = 2NO2
Из неметаллов кислород напрямую ни при каких условиях не взаимодействует с галогенами, из металлов - с благородными металлами серебром, золотом, платиной и др.
Бинарные соединения кислорода, в которых степень окисления атомов кислорода равна -2, называют оксидами (см. ОКСИДЫ) (прежнее название - окислы). Примеры оксидов: оксид углерода (IV) CO2,оксид серы (VI) SO3, оксид меди (I) Cu2O, оксид алюминия Al2O3, оксид марганца (VII) Mn2O7.
Кислород образует также соединения, в которых его степень окисления равна -1. Это - пероксиды (старое название - перекиси), например, пероксид водорода Н2О2, пероксид бария ВаО2, пероксид натрия Na2O2 и другие. В этих соединениях содержится пероксидная группировка - О - О -. С активными щелочными металлами, например, с калием, кислород может образовывать также супероксиды, например, КО2 (супероксид калия), RbO2 (супероксид рубидия). В супероксидах степень окисления кислорода -1/2. Можно отметить, что часто формулы супероксидов записывают как К2О4, Rb2O4 и т.д.
С самым активным неметаллом фтором кислород образует соединения в положительных степенях окисления. Так, в соединении O2F2 степень окисления кислорода +1, а в соединении O2F - +2. Эти соединения принадлежат не к оксидам, а к фторидам. Фториды кислорода можно синтезировать только косвенным путем, например, действуя фтором F2 на разбавленные водные растворы КОН.
Применение кислорода
Применение кислорода очень разнообразно. Основные количества получаемого из воздуха кислорода используются в металлургии. Кислородное (а не воздушное) дутье в домнах позволяет существенно повышать скорость доменного процесса, экономить кокс и получать чугун лучшего качества. Кислородное дутье применяют в кислородных конвертерах при переделе чугуна в сталь (см. ст. Железо (см. ЖЕЛЕЗО)). Чистый кислород или воздух, обогащенный кислородом, используется при получении и многих других металлов (меди (см. МЕДЬ), никеля (см. НИКЕЛЬ), свинца (см. СВИНЕЦ) и др.). Кислород используют при резке и сварке металлов. При этом применяют «баллонный» кислород. В баллоне кислород может находиться под давлением до 15 МПа. Баллоны с кислородом окрашены в голубой цвет.
Жидкий кислород - мощный окислитель, его используют как компонент ракетного топлива. Пропитанные жидким кислородом такие легко окисляющиеся материалы, как древесные опилки, вата, угольный порошок и др. (эти смеси называют оксиликвитами (см. ОКСИЛИКВИТЫ) ), используют как взрывчатые вещества, применяемые, например, при прокладке дорог в горах.
Биологическая роль кислорода
Кислород в атмосфере Земли начал накапливаться в результате деятельности первичных фотосинтезирующих организмов, появившихся, вероятно, около 2,8 млрд. лет назад. Полагают, что 2 млрд. лет назад атмосфера уже содержала около 1% кислорода; постепенно из восстановительной она превращалась в окислительную и примерно 400 млн. лет назад приобрела современный состав. Наличие в атмосфере кислорода в значительной степени определило характер биологической эволюции. Аэробный (с участием О2) обмен веществ возник позже анаэробного (без участия О2), но именно реакции биологического окисления, более эффективные, чем древние энергетические процессы брожения и гликолиза, снабжают живые организмы большей частью необходимой им энергии. Исключение составляют облигатные анаэробы, например, некоторые паразиты, для которых кислород является ядом. Использование кислорода, обладающего высоким окислительно-восстановительным потенциалом, в качестве конечного акцептора электронов в цепи дыхательных ферментов, привело к возникновению биохимического механизма дыхания современного типа. Этот механизм и обеспечивает энергией аэробные организмы.
Кислород - основной биогенный элемент (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ) , входящий в состав молекул всех важнейших веществ, обеспечивающих структуру и функции клеток - белков, нуклеиновых кислот, углеводов, липидов, а также множества низкомолекулярных соединений. В каждом растении или животном кислорода гораздо больше, чем любого другого элемента (в среднем около 70%). Мышечная ткань человека содержит 16% кислорода, костная ткань - 28.5%; всего в организме среднего человека (масса тела 70 кг) содержится 43 кг кислорода. В организм животных и человека кислород поступает в основном через органы дыхания (свободный кислород) и с водой (связанный кислород). Потребность организма в кислороде определяется уровнем (интенсивностью) обмена веществ, который зависит от массы и поверхности тела, возраста, пола, характера питания, внешних условий и др. В экологии как важную энергетическую характеристику определяют отношение суммарного дыхания (то есть суммарных окислительных процессов) сообщества организмов к его суммарной биомассе.
Небольшие количества кислорода используют в медицине: кислородом (из так называемых кислородных подушек) дают некоторое время дышать больным, у которых затруднено дыхание. Нужно, однако, иметь в виду, что длительное вдыхание воздуха, обогащенного кислородом, опасно для здоровья человека. Высокие концентрации кислорода вызывают в тканях образование свободных радикалов, нарушающих структуру и функции биополимеров. Сходным действием на организм обладают и ионизирующие излучения. Поэтому понижение содержания кислорода (гипоксия) в тканях и клетках при облучении организма ионизирующей радиацией обладает защитным действием - так называемый кислородный эффект (см. КИСЛОРОДНЫЙ ЭФФЕКТ). Этот эффект используют в лучевой терапии: повышая содержание кислорода в опухоли и понижая его содержание в окружающих тканях усиливают лучевое поражение опухолевых клеток и уменьшают повреждение здоровых. При некоторых заболеваниях применяют насыщение организма кислородом под повышенным давлением - гипербарическую оксигенацию (см. ГИПЕРБАРИЧЕСКАЯ ОКСИГЕНАЦИЯ).
КИСЛОРОД (лат. Oxygenium) - О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994. В свободном виде встречается в виде двух модификаций - О2 ("обычный" кислород) и О3 (озон). О2 - газ без цвета и запаха, плотность 1,42897 г/л, tпл -218,6 .С, tкип -182,96 .С. Химически самый активный (после фтора) неметалл. С большинством других элементов (водородом, галогенами, серой, многими металлами и т. д.) взаимодействует непосредственно (окисление) и, как правило, с выделением энергии. При повышении температуры скорость окисления возрастает и может начаться горение. Животные и растения получают необходимую для жизни энергию за счет биологического окисления различных веществ кислородом, поступающим в организмы при дыхании. Самый распространенный на Земле элемент; в виде соединений составляет ок. 1/2 массы земной коры; входит в состав воды (88,8% по массе) и многих тканей живых организмов (ок. 70% по массе). Свободный кислород атмосферы (20,95% по объему) образовался и сохраняется благодаря фотосинтезу. Кислород (или обогащенный им воздух) применяется в металлургии, химической промышленности, в медицине, кислородно-дыхательный аппаратах. Жидкий кислород - компонент ракетного топлива.
-а, м.
Химический элемент, газ без цвета и запаха, входящий в состав воздуха, необходимый для дыхания и горения и образующий в соединении с водородом воду.
O (oxygenium),
химический элемент VIA подгруппы периодической системы элементов: O, S, Se, Te, Po - член семейства халькогенов. Это наиболее распространенный в природе элемент, его содержание составляет в атмосфере Земли 21% (об.), в земной коре в виде соединений ок. 50% (масс.) и в гидросфере 88,8% (масс.). Кислород необходим для существования жизни на земле: животные и растения потребляют кислород в процессе дыхания, а растения выделяют кислород в процессе фотосинтеза. Живая материя содержит связанный кислород не только в составе жидкостей организма (в клетках крови и др.), но и в составе углеводов (сахар, целлюлоза, крахмал, гликоген), жиров и белков. Глины, горные породы состоят из силикатов и других кислородсодержащих неорганических соединений, таких, как оксиды, гидроксиды, карбонаты, сульфаты и нитраты.
Историческая справка. Первые сведения о кислороде стали известны в Европе из китайских рукописей 8 в. В начале 16 в. Леонардо да Винчи опубликовал данные, связанные с химией кислорода, не зная еще, что кислород - элемент. Реакции присоединения кислорода описаны в научных трудах С.Гейлса (1731) и П.Байена (1774). Заслуживают особого внимания исследования К.Шееле в 1771-1773 взаимодействия металлов и фосфора с кислородом. Дж.Пристли сообщил об открытии кислорода как элемента в 1774, спустя несколько месяцев после сообщения Байена о реакциях с воздухом. Название oxygenium ("кислород") дано этому элементу вскоре после его открытия Пристли и происходит от греческих слов, обозначающих "рождающий кислоту"; это связано с ошибочным представлением о том, что кислород присутствует во всех кислотах. Объяснение роли кислорода в процессах дыхания и горения, однако, принадлежит А. Лавуазье (1777).
Строение атома. Любой природный атом кислорода содержит 8 протонов в ядре, но число нейтронов может быть равно 8, 9 или 10. Наиболее распространенный из трех изотопов кислорода (99,76%) - это 168O (8 протонов и 8 нейтронов). Содержание другого изотопа, 188O (8 протонов и 10 нейтронов), составляет всего 0,2%. Этот изотоп используется как метка или для идентификации некоторых молекул, а также для проведения биохимических и медико-химических исследований (метод изучения нерадиоактивных следов). Третий нерадиоактивный изотоп кислорода 178O (0,04%) содержит 9 нейтронов и имеет массовое число 17. После того как в 1961 масса изотопа углерода 126C была принята Международной комиссией за стандартную атомную массу, средневзвешенная атомная масса кислорода стала равна 15,9994. До 1961 стандартной единицей атомной массы химики считали атомную массу кислорода, принятую для смеси трех природных изотопов кислорода равной 16,000. Физики за стандартную единицу атомной массы принимали массовое число изотопа кислорода 168O, поэтому по физической шкале средняя атомная масса кислорода составляла 16,0044
(см. также АТОМНАЯ МАССА). В атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов - на внешнем. Поэтому в химических реакциях кислород может принимать от доноров до двух электронов, достраивая свою внешнюю оболочку до 8 электронов и образуя избыточный отрицательный заряд
(см. также АТОМА СТРОЕНИЕ). Молекулярный кислород. Как большинство других элементов, у атомов которых для достройки внешней оболочки из 8 электронов не хватает 1-2 электронов, кислород образует двухатомную молекулу. В этом процессе выделяется много энергии (КИСЛОРОД490 кДж/моль) и соответственно столько же энергии необходимо затратить для обратного процесса диссоциации молекулы на атомы. Прочность связи O-O настолько высока, что при 2300° С только 1% молекул кислорода диссоциирует на атомы. (Примечательно, что при образовании молекулы азота N2 прочность связи N-N еще выше, КИСЛОРОД710 кДж/моль.)
Электронная структура. В электронной структуре молекулы кислорода не реализуется, как можно было ожидать, распределение электронов октетом вокруг каждого атома, а имеются неспаренные электроны, и кислород проявляет свойства, типичные для такого строения (например, взаимодействует с магнитным полем, являясь парамагнетиком).
Реакции. В соответствующих условиях молекулярный кислород реагирует практически с любым элементом, кроме благородных газов. Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Вероятно, большинство реакций протекает только после диссоциации кислорода на атомы, а диссоциация происходит лишь при очень высоких температурах. Однако катализаторы или другие вещества в реагирующей системе могут способствовать диссоциации O2. Известно, что щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы реагируют с молекулярным кислородом с образованием пероксидов:
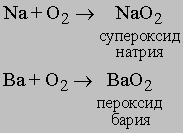
Получение и применение. Благодаря наличию свободного кислорода в атмосфере наиболее эффективным методом его извлечения является сжижение воздуха, из которого удаляют примеси, CO2, пыль и т.д. химическими и физическими методами. Циклический процесс включает сжатие, охлаждение и расширение, что и приводит к сжижению воздуха. При медленном подъеме температуры (метод фракционной дистилляции) из жидкого воздуха испаряются сначала благородные газы (наиболее трудно сжижаемые), затем азот и остается жидкий кислород. В результате жидкий кислород содержит следы благородных газов и относительно большой процент азота. Для многих областей применения эти примеси не мешают. Однако для получения кислорода особой чистоты процесс дистилляции необходимо повторять (см. также ВОЗДУХ). Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием. Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике.
Электролиз. Один из методов получения кислорода - электролиз воды, содержащей небольшие добавки NaOH или H2SO4 в качестве катализатора: 2H2O (r) 2H2 + O2. При этом образуются небольшие примеси водорода. С помощью разрядного устройства следы водорода в газовой смеси вновь превращают в воду, пары которой удаляют вымораживанием или адсорбцией.
Термическая диссоциация. Важный лабораторный метод получения кислорода, предложенный Дж.Пристли, заключается в термическом разложении оксидов тяжелых металлов: 2HgO (r) 2Hg + O2. Пристли для этого фокусировал солнечные лучи на порошок оксида ртути. Известным лабораторным методом является также термическая диссоциация оксосолей, например хлората калия в присутствии катализатора - диоксида марганца:
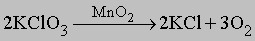
Диоксид марганца, добавляемый в небольших количествах перед прокаливанием, позволяет поддерживать требуемую температуру и скорость диссоциации, причем сам MnO2 в процессе не изменяется. Используются также способы термического разложения нитратов:
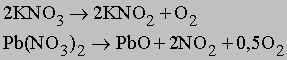
а также пероксидов некоторых активных металлов, например: 2BaO2 -> 2BaO + O2 Последний способ одно время широко использовался для извлечения кислорода из атмосферы и заключался в нагревании BaO на воздухе до образования BaO2 с последующим термическим разложением пероксида. Способ термического разложения сохраняет свое значение для получения пероксида водорода. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
Атомный номер 8 Атомная масса 15,9994 Температура плавления, ° С -218,4 Температура кипения, ° С -183,0 Плотность
твердый, г/см3 (при tпл) 1,27 жидкий г/см3 (при tкип) 1,14 газообразный, г/дм3 (при 0° С) 1,429 относительная по воздуху 1,105 критическая а, г/см3 0,430
Критическая температураа, ° С -118,8 Критическое давлениеа, атм 49,7 Растворимость, см3/100 мл растворителя
в воде (0° С) 4,89 в воде (100° С) 1,7 в спирте (25° С) 2,78
Радиус, 0,74
ковалентный 0,66 ионный (О2-) 1,40
Потенциал ионизации, В
первый 13,614 второй 35,146
Электроотрицательность (F = 4) 3,5 а Температура и давление, при которых плотность газа и жидкости одинаковы.
Физические свойства. Кислород при нормальных условиях - бесцветный газ без запаха и вкуса. Жидкий кислород имеет бледно-голубой цвет. Твердый кислород существует по крайней мере в трех кристаллических модификациях. Газообразный кислород растворим в воде и, вероятно, образует непрочные соединения типа O2*H2O, а возможно, и O2*2H2O.
Химические свойства. Как уже упоминалось, химическая активность кислорода определяется его способностью диссоциировать на атомы O, которые и отличаются высокой реакционной способностью. Только наиболее активные металлы и минералы реагируют с O2 c высокой скоростью при низких температурах. Наиболее активные щелочные (IA подгруппы) и некоторые щелочноземельные (IIA подгруппы) металлы образуют с O2 пероксиды типа NaO2 и BaO2. Другие же элементы и соединения реагируют только с продуктом диссоциации O2. В подходящих условиях все элементы, исключая благородные газы и металлы Pt, Ag, Au, реагируют с кислородом. Эти металлы тоже образуют оксиды, но при особых условиях. Электронная структура кислорода (1s22s22p4) такова, что атом O принимает для образования устойчивой внешней электронной оболочки два электрона на внешний уровень, образуя ион O2-. В оксидах щелочных металлов образуется преимущественно ионная связь. Можно полагать, что электроны этих металлов практически целиком оттянуты к кислороду. В оксидах менее активных металлов и неметаллов переход электронов неполный, и плотность отрицательного заряда на кислороде менее выражена, поэтому связь менее ионная или более ковалентная. При окислении металлов кислородом происходит выделение тепла, величина которого коррелирует с прочностью связи M-O. При окислении некоторых неметаллов происходит поглощение тепла, что свидетельствует об их менее прочных связях с кислородом. Такие оксиды термически неустойчивы (или менее стабильны, чем оксиды с ионной связью) и часто отличаются высокой химической активностью. В таблице приведены для сравнения значения энтальпий образования оксидов наиболее типичных металлов, переходных металлов и неметаллов, элементов A- и B-подгрупп (знак минус означает выделение тепла). Реакции Энтальпии образования, кДж/моль 4Na + O2 -> 2Na2O a -208 2Mg + O2 -> 2MgO -297 4Al + 3O2 -> 2Al2O3 -273 Si + O2 -> SiO2 -215 4P + 5O2 -> P4O10 -151 S + O2 -> SO2 -74 2Cl2 + 7O2 -> 2Cl2O7 +19 2Hg + O2 -> 2HgO -45 2Cr + 3O2 -> 2CrO3 -97 3Fe + 2O2 -> Fe3O4 -140 a При нормальных условиях предпочтительнее образование Na2O2. О свойствах оксидов можно сделать несколько общих выводов: 1. Температуры плавления оксидов щелочных металлов уменьшаются с ростом атомного радиуса металла; так, tпл (Cs2O) < tпл (Na2O). Оксиды, в которых преобладает ионная связь, имеют более высокие температуры плавления, чем температуры плавления ковалентных оксидов: tпл (Na2O) > tпл (SO2). 2. Оксиды химически активных металлов (IA-IIIA подгрупп) более термически стабильны, чем оксиды переходных металлов и неметаллов. Оксиды тяжелых металлов в высшей степени окисления при термической диссоциации образуют оксиды с более низкими степенями окисления (например, 2Hg2+O (r) (Hg+)2O + 0,5O2 (r) 2Hg0 + O2). Такие оксиды в высоких степенях окисления могут быть хорошими окислителями. 3. Наиболее активные металлы взаимодействуют с молекулярным кислородом при повышенных температурах с образованием пероксидов: Sr + O2 -> SrO2 4. Оксиды активных металлов образуют бесцветные растворы, тогда как оксиды большинства переходных металлов окрашены и практически нерастворимы. Водные растворы оксидов металлов проявляют основные свойства и являются гидроксидами, содержащими OH-группы, а оксиды неметаллов в водных растворах образуют кислоты, содержащие ион H+. 5. Металлы и неметаллы A-подгрупп образуют оксиды со степенью окисления, соответствующей номеру группы, например, Na, Be и B образуют Na12O, BeIIO и B2IIIO3, а неметаллы IVA-VIIA подгрупп C, N, S, Cl образуют CIVO2, NV2O5, SVIO3, ClVII2O7. Номер группы элемента коррелирует только с максимальной степенью окисления, так как возможны оксиды и с более низкими степенями окисления элементов. В процессах горения соединений типичными продуктами являются оксиды, например: 2H2S + 3O2 -> 2SO2 + 2H2O Углеродсодержащие вещества и углеводороды при слабом нагревании окисляются (сгорают) до CO2 и H2O. Примерами таких веществ являются топлива - древесина, нефть, спирты (а также углерод - каменный уголь, кокс и древесный уголь). Тепло от процесса горения утилизируется на производство пара (а далее электричества или идет на силовые установки), а также на отопление домов. Типичные уравнения для процессов горения таковы: а) древесина (целлюлоза): (C6H10O5)n + 6nO2 -> 6nCO2 + 5nH2O + тепловая энергия б) нефть или газ (бензин C8H18 или природный газ CH4): 2C8H18 + 25O2 -> 16CO2 + 18H2O + тепловая энергия CH4 + 2O2 -> CO2 + 2H2O + тепловая энергия в) спирт: C2H5OH + 3O2 -> 2CO2 + 3H2O + тепловая энергия г) углерод (каменный или древесный уголь, кокс): 2C + O2 -> 2CO + тепловая энергия 2CO + O2 -> 2CO2 + тепловая энергия Горению подвержены также ряд C-, H-, N-, O-содержащих соединений с высоким запасом энергии. Кислород для окисления может использоваться не только из атмосферы (как в предыдущих реакциях), но и из самого вещества. Для инициирования реакции достаточно небольшого активирования реакции, например удара или встряски. При этих реакциях продуктами горения также являются оксиды, но все они газообразны и быстро расширяются при высокой конечной температуре процесса. Поэтому такие вещества являются взрывчатыми. Примерами взрывчатых веществ служат тринитроглицерин (или нитроглицерин) C3H5(NO3)3 и тринитротолуол (или ТНТ) C7H5(NO2)3.
См. также ХИМИЧЕСКОЕ И БИОЛОГИЧЕСКОЕ ОРУЖИЕ. Оксиды металлов или неметаллов с низшими степенями окисления элемента реагируют с кислородом с образованием оксидов высоких степеней окисления этого элемента:
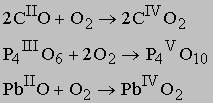
Оксиды природные, полученные из руд или синтезированные, служат сырьем для получения многих важных металлов, например, железа из Fe2O3 (гематит) и Fe3O4 (магнетит), алюминия из Al2O3 (глинозем), магния из MgO (магнезия). Оксиды легких металлов используются в химической промышленности для получения щелочей или оснований. Пероксид калия KO2 находит необычное применение, так как в присутствии влаги и в результате реакции с ней выделяет кислород. Поэтому KO2 применяют в респираторах для получения кислорода. Влага из выдыхаемого воздуха выделяет в респираторе кислород, а KOH поглощает CO2. Получение оксида CaO и гидроксида кальция Ca(OH)2 - многотоннажное производство в технологии керамики и цемента.
Вода (оксид водорода). Важность воды H2O как в лабораторной практике для химических реакций, так и в процессах жизнедеятельности требует особого рассмотрения этого вещества
(см. также ВОДОРОД; ВОДА, ЛЕД И ПАР).
Как уже упоминалось, при прямом взаимодействии кислорода и водорода в условиях, например, искрового разряда происходят взрыв и образование воды, при этом выделяется 143 кДж/(моль H2O). Молекула воды имеет почти тетраэдрическое строение, угол H-O-H равен 104°30ў. Связи в молекуле частично ионные (30%) и частично ковалентные с высокой плотностью отрицательного заряда у кислорода и соответственно положительных зарядов у водорода:
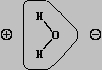
Из-за высокой прочности связей H-O водород с трудом отщепляется от кислорода и вода проявляет очень слабые кислотные свойства. Многие свойства воды определяются распределением зарядов. Например, молекула воды образует с ионом металла гидрат:
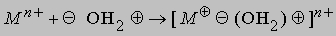
Одну электронную пару вода отдает акцептору, которым может быть H+:
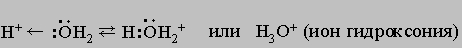
Молекулы воды связываются друг с другом в большие агрегаты (H2O)x слабыми водородными связями (энергия связи КИСЛОРОД21 кДж)
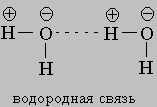
Вода в такой системе водородных связей подвергается диссоциации в очень слабой степени, достигающей концентрации 10-7 моль/л. Очевидно, расщепление связи, показанное квадратными скобками, приводит к образованию гидроксид-иона OH- и иона гидроксония H3O+:
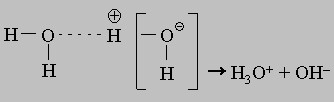
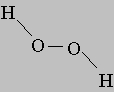
Пероксид водорода. Другим соединением, состоящим только из водорода и кислорода, является пероксид водорода H2O2. Название "пероксид" принято для соединений, содержащих связь -O-O-. Пероксид водорода имеет строение асимметрично изогнутой цепи:
Пероксид водорода получают по реакции пероксида металла с кислотой BaO2 + H2SO4 -> BaSO4 + H2O2 либо разложением пероксодисерной кислоты H2S2O8, которую получают электролитически:
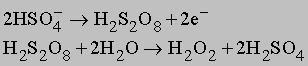
Концентрированный раствор H2O2 может быть получен специальными методами дистилляции. Пероксид водорода используют как окислитель в двигателях ракет. Разбавленные растворы пероксида служат антисептиками, отбеливателями и мягкими окислителями. H2O2 добавляют ко многим кислотам и оксидам для получения соединений, аналогичных гидратам. В присутствии сильного окислителя (например, MnO2 или MnO4-) H2O2 окисляется, выделяя кислород и воду. Оксоанионы и оксокатионы - кислородсодержащие частицы, имеющие остаточный отрицательный (оксоанионы) или остаточный положительный (оксокатионы) заряд. Ион O2- имеет высокое сродство (высокую реакционную способность) к положительно заряженным частицам типа H+. Простейшим представителем стабильных оксоанионов является гидроксид-ион OH-. Это объясняет неустойчивость атомов с высокой зарядовой плотностью и их частичную стабилизацию в результате присоединения частицы с положительным зарядом. Поэтому при действии активного металла (или его оксида) на воду образуется OH-, а не O2-: 2Na + 2H2O -> 2Na+ + 2OH- + H2 или Na2O + H2O -> 2Na+ + 2OH- Более сложные оксоанионы образуются из кислорода с ионом металла или неметаллической частицей, имеющей большой положительный заряд, в результате получается низкозаряженная частица, обладающая большей стабильностью, например:
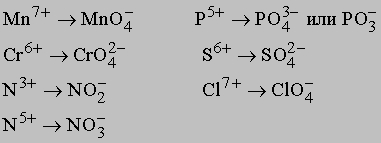
Озон. Кроме атомарного кислорода O и двухатомной молекулы O2 существует третья форма кислорода - озон O3, содержащий три кислородных атома. Все три формы являются аллотропными модификациями. Озон образуется при пропускании тихого электрического разряда через сухой кислород: 3O2 2O3. При этом образуется несколько процентов озона. Реакция катализируется ионами металлов. Озон имеет острый резкий запах, который можно обнаружить вблизи работающих электрических машин или в окрестности атмосферного электрического разряда. Газ имеет голубоватый цвет и конденсируется при -112° С в темноголубую жидкость, а при -193° С образуется темнопурпуровая твердая фаза. Жидкий озон слаборастворим в жидком кислороде, а в 100 г воды при 0° С растворяется 49 см3 O3. По химическим свойствам озон намного активнее кислорода и по окислительным свойствам уступает только O, F2 и OF2 (дифториду кислорода). При обычном окислении образуются оксид и молекулярный кислород O2. При действии озона на активные металлы в особых условиях образуются озониды состава K+O3-. Озон получают в промышленности для специальных целей, он является хорошим дезинфицирующим средством и используется для очистки воды и как отбеливатель, улучшает состояние атмосферы в закрытых системах, дезинфицирует предметы и пищу, ускоряет созревание зерна и фруктов. В химической лаборатории часто используют озонатор для получения озона, необходимого для некоторых методов химического анализа и синтеза. Каучук легко разрушается даже под действием малых концентраций озона. В некоторых промышленных городах значительная концентрация озона в воздухе приводит к быстрой порче резиновых изделий, если они не защищены антиоксидантами. Озон очень токсичен. Постоянное вдыхание воздуха даже с очень низкими концентрациями озона вызывает головную боль, тошноту и другие неприятные состояния.
ЛИТЕРАТУРА
Разумовский С.Д. Кислород - элементарные формы и свойства. М., 1979 Термодинамические свойства кислорода. М., 1981
Глотать кислород. Сиб. Ирон. Тонуть. ФСС, 43.
Перекрывать/ перекрыть кислород кому. Разг. Препятствовать осуществлению какого-л. важного дела, лишать кого-л. возможности действовать. ТС ХХ в., 295; Мокиенко 2003, 43.
Подышать кислороду. Жарг. шк. Шутл. Отдохнуть на перемене. Максимов, 179.
кислоро́д, кислоро́ды, кислоро́да, кислоро́дов, кислоро́ду, кислоро́дам, кислоро́дом, кислоро́дами, кислоро́де, кислоро́дах
Название этого газообразного химического элемента было образовано способом кальки с латинского oxygenium, где оху означает кислый, a genium является производным от genus - "род".
Латинское - oxigenium.
Слово получило распространение в русском языке во второй трети XIX в., заменив собой употреблявшееся ранее существительное «кислотвор». Название этого химического, элемента является калькой с латинского термина, введенного в научную лексику благодаря греческому языку, из которого была взята основа для образования слова.
Кислородом называют бесцветный газ, входящий в состав воздуха и различных органических кислот.
Производное: кислородный.
Словообразовательная калька лат. oxygenium, образованного путем сложения оху - "кислый" и genus- "род".
Словообразоват. калька франц. oxygène, неологизм Лаувазье, представляющего собой сложение греч. oxys «кислый» и gennaō «рождаю»). Окончательно закрепилось в I пол. XIX в. До того кислород назывался также кислородным газом, оксигеном, кислотвором.
- Количество этого химического элемента возрастает при уменьшении народа.
- Газ, без которого человечество «загнётся».
- Почти 86% массы морской воды приходится на этот элемент.
- Химический элемент, газ.
- Без него голодают лёгкие.
- Дефлогистированный воздух, небесный воздух, жизненный воздух или основа воздуха жизни, а как мы его называем сейчас?
- Первые химики называли его дефлогистированным воздухом, небесным воздухом, жизненным воздухом или основой воздуха жизни.
- Самый распространённый элемент на Луне.
- Самый распространённый химический элемент в земной коре.
- Из-за недостатка чего образуется горная болезнь?
- Химический элемент, O.
- Четырьмя основными химическими элементами, из которых состоит человеческий организм, являются азот, водород, углерод и он.
- Название этого газа означает «образующий кислоты».
- В отличие от рибозы, в дезоксирибозе нет атома именно этого элемента.
- Чего не хватает организму при гипоксии?
КИСЛОРО́ДИСТЫЙ и КИСЛОРОДНЫЙ, кислородная, кислородное. прил. к кислород.
Кислоро́дная ёмкость кро́ви - максимальное количество кислорода, обратимо связанное кровью; выражается в объёмных процентах; зависит от концентрации в крови гемоглобина. Кислородная ёмкость человека около 18-20%.
* * *
КИСЛОРОДНАЯ ЕМКОСТЬ КРОВИ - КИСЛОРО́ДНАЯ ЕМКОСТЬ КРО́ВИ, максимальное количество кислорода, обратимо связанное кровью; выражается в объемных процентах; зависит от концентрации в крови гемоглобина. Кислородная емкость крови человека ок. 18-20%.
КИСЛОРОДНАЯ ЕМКОСТЬ КРОВИ - максимальное количество кислорода, обратимо связанное кровью; выражается в объемных процентах; зависит от концентрации в крови гемоглобина. Кислородная емкость крови человека ок. 18-20%.
Кислоро́дная ре́зка (газовая резка), процесс, основанный на сгорании металла в струе кислорода и принудительном удалении этой струёй образующихся оксидов. Для материалов, трудно поддающихся резке, применяют флюс (кислородно-флюсовая резка).
* * *
КИСЛОРОДНАЯ РЕЗКА - КИСЛОРО́ДНАЯ РЕ́ЗКА (газовая резка, автогенная резка), процесс, основанный на сгорании металла в струе кислорода. Для материалов, трудно поддающихся резке, применяют флюс (кислородно-флюсовая резка).
КИСЛОРОДНАЯ РЕЗКА (газовая резка - автогенная резка), процесс, основанный на сгорании металла в струе кислорода. Для материалов, трудно поддающихся резке, применяют флюс (кислородно-флюсовая резка).
Кислоро́дная терапи́я - то же, что оксигенотерапия.
* * *
КИСЛОРОДНАЯ ТЕРАПИЯ - КИСЛОРО́ДНАЯ ТЕРАПИ́Я, то же, что оксигенотерапия (см. ОКСИГЕНОТЕРАПИЯ).
КИСЛОРОДНАЯ ТЕРАПИЯ - то же, что оксигенотерапия.
Кислоро́дно-конве́ртерный проце́сс - передел жидкого чугуна в сталь без подвода теплоты - продувкой металла в конвертере технически чистым кислородом. Под воздействием дутья примеси чугуна (Si, Mn, С и др.) окисляются с выделением значительного количества теплоты. По окончании продувки металл раскисляют (удаляют избыточный кислород). Благодаря высокой производительности кислородно-конвертерного процесса его роль в мировой выплавке стали постоянно растёт.
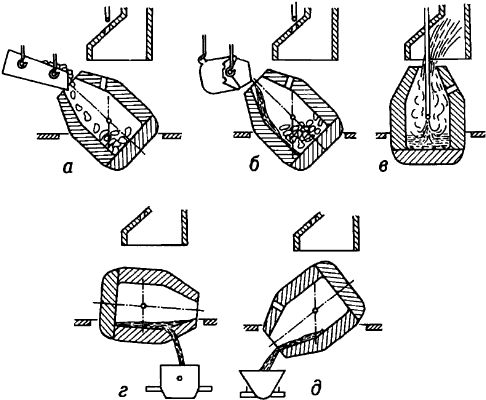
* * *
КИСЛОРОДНО-КОНВЕРТЕРНЫЙ ПРОЦЕСС - КИСЛОРО́ДНО-КОНВЕ́РТЕРНЫЙ ПРОЦЕ́СС, передел жидкого чугуна в сталь без подвода теплоты - продувкой металла в конвертере технически чистым кислородом. Под воздействием дутья примеси чугуна (Si, Mn, C и др.) окисляются с выделением значительного количества теплоты. По окончании продувки металл раскисляют (удаляют избыточный кислород). Благодаря высокой производительности кислородно-конвертерного процесса его роль в мировой выплавке стали постоянно растет.
КИСЛОРОДНО-КОНВЕРТЕРНЫЙ ПРОЦЕСС - передел жидкого чугуна в сталь без подвода теплоты - продувкой металла в конвертере технически чистым кислородом. Под воздействием дутья примеси чугуна (Si, Mn, C и др.) окисляются с выделением значительного количества теплоты. По окончании продувки металл раскисляют (удаляют избыточный кислород). Благодаря высокой производительности кислородно-конвертерного процесса его роль в мировой выплавке стали постоянно растет.
прил.
1. соотн. с сущ. кислород, связанный с ним
2. Свойственный кислороду, характерный для него.
3. Производимый с использованием кислорода.
4. Служащий вместилищем для кислорода; предназначенный для подачи кислорода.
КИСЛОРО́Д, -а (-у), м. Химический элемент, бесцветный газ, входящий в состав воздуха, необходимый для дыхания и горения.
-ая, -ое.
прил. к кислород.
Кислородная среда. Кислородные соединения.
◊
кислородное голодание
кислородная недостаточность
мед.
понижение содержания кислорода в тканях организма; гипоксия.
кислородная подушка
медицинский прибор для вдыхания кислорода.
- кислородная резка
- кислородная сварка
кислоро́дный, кислоро́дная, кислоро́дное, кислоро́дные, кислоро́дного, кислоро́дной, кислоро́дных, кислоро́дному, кислоро́дным, кислоро́дную, кислоро́дною, кислоро́дными, кислоро́дном, кислоро́ден, кислоро́дна, кислоро́дно, кислоро́дны, кислоро́днее, покислоро́днее, кислоро́дней, покислоро́дней
Кислоро́дный эффе́кт - в радиобиологии, свойство молекулярного кислорода, присутствующего в клетках и тканях, усиливать биологическое действие ионизирующих излучений. Уменьшение содержания О2 перед облучением - один из способов защиты организма от излучений.
* * *
КИСЛОРОДНЫЙ ЭФФЕКТ - КИСЛОРО́ДНЫЙ ЭФФЕ́КТ в радиобиологии, свойство молекулярного кислорода, присутствующего в клетках и тканях, усиливать биологическое действие ионизирующих излучений. Уменьшение содержания О2 перед облучением - один из способов защиты организма от излучений.
КИСЛОРОДНЫЙ ЭФФЕКТ в радиобиологии - свойство молекулярного кислорода, присутствующего в клетках и тканях, усиливать биологическое действие ионизирующих излучений. Уменьшение содержания О2 перед облучением - один из способов защиты организма от излучений.