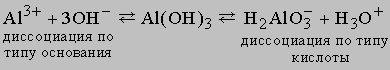S (sulfur),
неметаллический химический элемент, член семейства халькогенов (O, S, Se, Te и Po) - IVA подгруппы периодической системы элементов. Cера, как и многие ее применения, известны с далекой древности. А.Лавуазье утверждал, что сера - это элемент. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
Применение. Около половины ежегодного потребления серы идет на производство таких промышленных химических продуктов, как серная кислота, диоксид серы и дисульфид углерода (сероуглерод). Кроме того, сера широко используется в производстве инсектицидов, спичек, удобрений, взрывчатых веществ, бумаги, полимеров, красок и красителей, при вулканизации каучука. Ведущее место в добыче серы занимают США, страны СНГ и Канада.
Распространенность в природе. Сера встречается в свободном состоянии (самородная сера). Кроме того, имеются огромные запасы серы в виде сульфидных руд, прежде всего руд свинца (свинцовый блеск), цинка (цинковая обманка), меди (медный блеск) и железа (пирит). При извлечении металлов из этих руд освобождаются от серы обычно обжигом в присутствии кислорода, при этом образуется диоксид серы(IV), который часто выбрасывается в атмосферу без использования. Кроме сульфидных руд достаточно много серы встречается в виде сульфатов, например, сульфата кальция (гипс), сульфата бария (барит). В морской воде и многих минеральных водах присутствуют растворимые в воде сульфаты магния и натрия. В некоторых минеральных водах встречается сульфид водорода (сероводород). В промышленности серу можно получать как побочный продукт процессов в плавильных, коксовых печах, при нефтепереработке, из топочных или природных газов. Из природных подземных отложений серу добывают, расплавляя ее перегретой водой и доставляя на поверхность сжатым воздухом и насосами. Во фраш-процессе извлечения серы из сероносных отложений на установке в виде концентрических труб, запатентованной Г.Фрашем в 1891, сера получается чистотой до 99,5%.
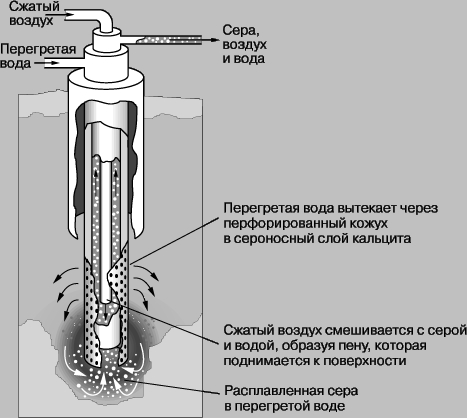
ФРАШ-ПРОЦЕСС для извлечения природной серы из подземных месторождений.
Свойства. Сера имеет вид желтого порошка или хрупкой кристаллической массы без запаха и вкуса и нерастворима в воде. Для серы характерны несколько аллотропных модификаций. Наиболее известны следующие: кристаллическая сера - ромбическая (самородная сера, a-S) и моноклинная (призматическая сера, b-S); аморфная - коллоидная (серное молоко) и пластическая; промежуточная аморфно-кристаллическая - сублимированная (серный цвет). СВОЙСТВА СЕРЫ
Атомный номер 16 Атомная масса 32,066 Изотопы
стабильные 32, 33, 34, 36
нестабильные 31, 35, 37
Температура плавления, ° С 112,8 (a , ромбич.), 119,0 (b , моноклин.) Температура кипения, ° С 444,6 Плотность, г/см3 2,06 (ромбич.), 1,957 (моноклин.) Твердость (по Моосу) 1,5-2,5 Содержание в земной коре, % (масс.) 0,052 Степени окисления -2, +2, +4, +6 (реже -1, 0, +1, +3, +5 )
Кристаллическая сера. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2. Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично "срезаны" углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
Некристаллическая сера. Твердая сера существует также в двух некристаллических, аморфных, формах. Коллоидная сера получается при осаждении серы из раствора (например, при кипячении серы с известью) и фильтровании с последующим добавлением хлороводородной кислоты к прозрачному фильтрату. Осадок представляет собой мелкодисперсную белую и хорошо растворимую в CS2 серу. Коллоидную серу используют в медицине как антисептик, слабительное и противопаразитическое средство в виде порошков и мазей. Другая некристаллическая форма - пластическая сера - образуется при резком охлаждении расплава, например, холодной водой. Пластическая сера бывает темнокрасного или коричневого цвета, она каучукоподобна (плотность 2,046 г/см3) и не растворяется в CS2; при хранении становится хрупкой, желтеет и по мере превращения в ромбическую все лучше растворяется в CS2. В дополнение к этим кристаллическим и аморфным формам существует промежуточная форма, известная как серный цвет или сублимированная сера, которая получается конденсацией паров серы, минуя жидкую фазу. Она состоит из мельчайших зерен, имеющих центр кристаллизации и аморфную поверхность. Эта форма медленно и не полностью растворяется в CS2. После обработки аммиаком для очистки от таких примесей, как мышьяк, получается продукт, известный в медицине как промытая сера, которая используется аналогично коллоидной сере.
Жидкое состояние. Молекулы серы состоят из замкнутой цепочки восьми атомов (S8). Жидкая сера обладает необычным свойством: с повышением температуры ее вязкость увеличивается. Ниже 160° С сера - типичная жидкость желтоватого цвета, ее состав соответствует формуле S8 и обозначается l-S. С повышением температуры кольцевые молекулы S8 начинают разрываться и соединяться друг с другом, образуя длинные цепи (m-S), цвет жидкой серы становится темнокрасным, вязкость возрастает, достигая максимума при 200-250° С. При дальнейшем повышении температуры жидкая сера светлеет, длинные цепи рвутся, образуя короткие, с меньшей способностью к переплетению, что приводит к меньшей вязкости.
Газ. Сера кипит при 444,6° C, образуя оранжево-желтые пары, состоящие преимущественно из молекул S8. С повышением температуры окраска паров переходит в темнокрасную, затем в палевую, а при 650° C в соломенно-желтую. При дальнейшем нагревании молекулы S8 диссоциируют, образуя равновесные формы S6, S4 и S2 при разных температурах. И, наконец, при >1000° С пары состоят практически из молекул S2, а при 2000° С - из одноатомных молекул.
Химические свойства. Сера - типичный неметалл. На внешней электронной оболочке у нее шесть электронов, и она легче присоединяет электроны других элементов, чем отдает свои. Со многими металлами реагирует с выделением тепла (например, при соединении с медью, железом, цинком). Она соединяется и почти со всеми неметаллами, хотя не так энергично.
Соединения. Диоксид серы образуется при сжигании серы на воздухе, в частности, при обжиге сульфидных руд металлов. Диоксид серы - бесцветный газ с удушающим запахом. Это ангидрид сернистой кислоты, он легко растворяется в воде с образованием сернистой кислоты. Диоксид легко сжижается (т. кип. -10° C) и его хранят в стальных цилиндрах. Диоксид используют в производстве серной кислоты, в холодильных установках, для отбеливания текстиля, древесной массы, соломы, свекловичного сахара, для консервации фруктов и овощей, для дезинфекции, в пивоваренных и пищевых производствах. Сернистая кислота H2SO3 существует только в разбавленных растворах (менее 6%). Это слабая кислота, образующая средние и кислые соли (сульфиты и гидросульфиты). Сернистая кислота - хороший восстановитель, реагируя с кислородом образует серную кислоту. Сернистая кислота находит несколько областей применения, среди которых - обесцвечивание шелка, шерсти, бумаги, древесной массы и аналогичных веществ. Она используется как антисептик и консервант, особенно для предотвращения брожения вина в бочках, для предотвращения ферментации зерна при извлечении крахмала. Кислоту используют и для сохранения продуктов. Наибольшее значение из ее солей имеет гидросульфит кальция Ca(HSO3)2, используемый при переработке древесной щепы в целлюлозу. Триоксид серы SO3 (серный ангидрид), образующий с водой серную кислоту, представляет собой либо бесцветную жидкость, либо белое кристаллическое вещество (кристаллизуется при 16,8° С; т. кип. 44,7° С). Он образуется при окислении диоксида серы кислородом в присутствии соответствующего катализатора (платина, пентаоксид ванадия). Триоксид серы сильно дымит во влажном воздухе и растворяется в воде, образуя серную кислоту и выделяя много тепла. Его используют в производстве серной кислоты и получении синтетических органических веществ.
Серная кислота H2SO4. Безводная H2SO4 - бесцветная маслянистая жидкость, растворяет SO3, образуя олеум. Смешивается с водой в любых отношениях. При растворении в воде образуются гидраты с выделением очень большого количества теплоты; поэтому во избежание разбрызгивания кислоты обычно при растворении осторожно, постепенно добавляют кислоту в воду, а не наоборот. Концентрированная кислота хорошо поглощает пары воды и поэтому применяется для осушения газов. По этой же причине она приводит к обугливанию органических веществ, особенно углеводов (крахмала, сахара и т.п.). При попадании на кожу вызывает сильные ожоги, пары разъедают слизистую дыхательных путей и глаз. Серная кислота - сильный окислитель. Конц. H2SO4 окисляет HI, HBr до I2 и Br2 соответственно, уголь - до CO2, серу - до SO2, металлы - до сульфатов. Разбавленная кислота тоже окисляет металлы, стоящие в ряду напряжений до водорода. H2SO4 - сильная двухосновная кислота, образующая средние и кислые соли - сульфаты и гидросульфаты; большинство ее солей растворимы в воде, за исключением сульфатов бария, стронция и свинца, малорастворим сульфат кальция. Серная кислота - один из важнейших продуктов химической промышленности (производящей щелочи, кислоты, соли, минеральные удобрения, хлор). Ее получают главным образом контактным или башенным способом по принципиальной схеме:
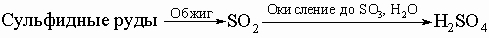
Большая часть получаемой кислоты идет на производство минеральных удобрений (суперфосфат, сульфат аммония). Серная кислота служит исходным сырьем для получения солей и других кислот, для синтеза органических веществ, искусственных волокон, для очистки керосина, нефтяных масел, бензола, толоуола, при изготовлении красок, травлении черных металлов, в гидрометаллургии урана и некоторых цветных металлов, для получения моющих и лекарственных средств, как электролит в свинцовых аккумуляторах и как осушитель. Тиосерная кислота H2S2O3 структурно аналогична серной кислоте за исключением замены одного кислорода на атом серы. Наиболее важным производным кислоты является тиосульфат натрия Na2S2O3 - бесцветные кристаллы, образующиеся при кипячении сульфита натрия Na2SO3 с серным цветом. Тиосульфат (или гипосульфит) натрия используется в фотографии как закрепитель (фиксаж). Сульфонал (CH3)2C(SO2C2H5)2 - белое кристаллическое вещество, без запаха, слабо растворимое в воде, является наркотиком и используется как седативное и снотворное средство. Сульфид водорода H2S (сероводород) - бесцветный газ с резким неприятным запахом тухлых яиц. Он несколько тяжелее воздуха (плотность 1,189 г/дм3), легко сжижается в бесцветную жидкость и хорошо растворим в воде. Раствор в воде является слабой кислотой с рН СЕРА 4. Жидкий сероводород используют как растворитель. Раствор и газ широко применяют в качественном анализе для отделения и определения многих металлов. Вдыхание незначительного количества сероводорода вызывает головную боль и тошноту, большие количества или непрерывное вдыхание сероводорода вызывают паралич нервной системы, сердца и легких. Паралич наступает неожиданно, в результате нарушения жизненных функций организма. Монохлорид серы S2Cl2 - дымящая масляная жидкость янтарного цвета с едким запахом, слезоточивая и затрудняющая дыхание. Она дымит во влажном воздухе и разлагается водой, но растворима в сероуглероде. Монохлорид серы - хороший растворитель для серы, иода, галогенидов металлов и органических соединений. Монохлорид используется для вулканизации каучука, в производстве типографской краски и инсектицидов. При реакции с этиленом образуется летучая жидкость, известная как горчичный газ (ClC2H4)2S - токсичное соединение, используемое как боевое химическое отравляющее вещество раздражающего действия. Дисульфид углерода CS2 (сероуглерод) - бледножелтая жидкость, ядовитая и легко воспламеняющаяся. CS2 получают синтезом из элементов в электрической печи. Вещество нерастворимо в воде, имеет высокий коэффициент светопреломления, высокое давление паров, низкую температуру кипения (46° C). Сероуглерод - эффективный растворитель жиров, масел, каучука и резин - широко используют для экстракции масел, в производстве искусственного шелка, лаков, резиновых клеев и спичек, уничтожения амбарных долгоносиков и одежной моли, для дезинфекции почв. См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Справочник сернокислотчика. М., 1971 Бусев А.И., Симонова Л.Н. Аналитическая химия серы. М., 1975