ПОДГРУППА VIIB. СЕМЕЙСТВО МАРГАНЦА
МАРГАНЕЦ, ТЕХНЕЦИЙ, РЕНИЙ
Электронная конфигурация этих элементов марганца Mn, технеция Tc, рения Re характерна для переходных металлов. Каждый элемент имеет наполовину заполненную внутреннюю d-оболочку, т.е. имеет пять d-электронов на пяти d-орбиталях и 2 электрона на внешней s-орбитали. Исходя из факта наполовину заполненной каждой d-орбитали можно предсказать некоторые свойства элементов. Соединения марганца(II) отличаются хорошей устойчивостью к окислению и восстановлению, а соединения Mn(III) склонны переходить в соединения Mn(II). Все элементы подгруппы покрываются пассивирующей пленкой; при разрушении пленки Mn становится реакционноспособным и вытесняет водород из кислот HCl и H2SO4. Ни Tc, ни Re не растворяются в кислотах, не являющихся окислителями. Все металлы растворяются в HNO3, причем технеций и рений окисляются до M(VII), образуя HTcO4 и HReO4, а марганец переходит в M(VII) только под действием сильных окислителей. Состояние M(VII) более стабильно для Tc и Re: Mn2O7 при нагревании взрывается, а Re2O7 и Tc2O7 устойчивы даже при выпаривании их растворов. Все элементы подгруппы образуют соединения в низких степенях окисления, но более тяжелые образуют более устойчивые соединения. Состояние в степени окисления V не очень характерно, но некоторые соединения и ионы описаны. В целом Tc по свойствам ближе к Re: оба образуют сходные соединения и комплексные ионы. В подгруппе нет элемента, близкого по свойствам к Mn. Марганец более всего похож по свойствам на железо элемент, стоящий за Mn в ряду переходных металлов. Re отличается исключительно высокой температурой плавления, а по плотности ближе к платиновым металлам, наиболее тяжелым из всех металлов (табл. 14).
Марганец занимает важное место среди стратегических металлов, так как для производства каждой тонны стали требуется ок. 5,5 кг марганца. Большую часть марганца получают из пиролюзита MnO2, который существует в нескольких аллотропных модификациях от относительно хорошо закристаллизованных до почти аморфных. Металл получают восстановлением углеродом или алюминием из диоксида марганца. Руду нагревают до высоких температур в электрических печах в присутствии генераторного газа (влажный CO) с последующей обработкой продукта серной кислотой для получения MnSO4, из которого марганец выделяют электролизом. Эту же соль можно окислить до товарного продукта MnO2, используемого в технологии аккумуляторов. Около 90% Mn идет на производство железомарганцевых сплавов, получаемых термической обработкой смеси MnO2 с углеродом и оксидами железа. Один из двух таких важнейших марганецсодержащих продуктов ферромарганец состава Mn:Fe = 8:2, другой "зеркальный чугун", получаемый из шихты Mn:C:Fe = 25:5:70 в доменной печи и применяемый для раскисления и обуглероживания стали. Марганец связывает серу, содержащуюся в стали, в безопасный для стали MnS. Это очень важно, так как высокая концентрация серы в стали вызывает ее охрупчивание при высоких температурах, что препятствует горячей обработке стали. Марганцевые стали обладают высокими механическими характеристиками и пригодны для изготовления рельсов, сейфов и механизмов, а с добавками Cu, Zn и Sn (бронза) устойчивы к коррозии в морской воде и используются для изготовления корабельных винтов. Большие количества MnO2 определенных модификаций расходуются на производство сухих аккумуляторов. Некоторое количество MnO2 расходуется в производстве стекла для удаления зеленой окраски, вызванной примесью железа. Другое применение марганца в качестве дезинфицирующего средства в виде KMnO4; перманганат калия хороший реагент для количественного анализа многих веществ, например Fe, Ti, иодид-иона и др.
Технеций искусственный элемент. Впервые Tc был получен в 1937 при бомбардировке молибдена нейтронами и дейтерием:
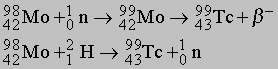
В ядерном реакторе заметные количества Tc получаются из изотопа 9942Mo продукта распада
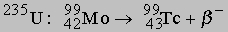
.
Конечным продуктом распада 9943Tc является стабильный изотоп рутения 9944Ru. Для отделения Tc от U их переводят в хлориды, после обработки пероксидом водорода получают UO2Cl2 и действием сероводорода на получившийся раствор с добавлением к нему PtCl4 осаждают Tc2S7 и PtS2. Осадок сульфидов растворяют в гидроксиде аммония, из которого после добавления кислоты перегонкой выделяют Tc2O7. Металлический технеций получают из пертехнетата аммония NH4TcO4, превращая его в оксид и восстанавливая последний водородом.
Рений. Металлический рений получают водородным восстановлением перрената аммония NH4ReO4. В природе рений встречается чаще в рудах молибдена, чем марганца, как можно было бы предполагать исходя из общности их подгруппы. Сегодня рений получают в количестве, достаточном для промышленного применения, например, при каталитическом гидрировании. Термоэлектронная эмиссия рения более технологична, чем у вольфрама, и поэтому находит применение в специальном оборудовании.
Реакции и соединения. Все эти металлы реагируют с галогенами, однако степени окисления, проявляемые марганцем, сильно отличаются от степеней окисления более тяжелых металлов. Марганец не проявляет высоких степеней окисления, образуя лишь MnF2 и MnF3. MnF3 хороший фторирующий агент, он легко разлагается, выделяя фтор, хорошо растворяется в воде, что не характерно для соединений Mn(III), но эти растворы не электропроводны, по-видимому, из-за димеризации. Рений в реакциях со фтором образует соединения с более высокими степенями окисления, например ReF4 и ReF6. При хлорировании марганца получается стабильный и хорошо растворимый в воде MnCl2. MnCl3 и MnCl4 существуют, но легко разлагаются. MnCl4 получается при действии HCl на MnO2 (пиролюзит), однако MnCl4 даже при комнатной температуре разлагается на MnCl2 и Cl2, что можно использовать как удобный метод получения хлора. Рений при взаимодействии с хлором образует трихлорид ReCl3 и пентахлорид ReCl5. Бром и иод с этими металлами образуют галогениды только в низших степенях окисления металла, например MnCl2.
Комплексообразование. Все галогениды металлов подгруппы Mn, принимая электронную пару от галогенид-иона (донора), образуют комплексные ионы и соединения. Вот некоторые примеры. [[ReF6]]2 гексафтороренат(IV), [[ReCl6]]2 гексахлороренат(IV), [[MnCl4]]2 тетрахлороманганат(II), [[ReCl6]] гексахлороренат(V). Галогениды подвергаются гидролизу, образуя оксогалогениды, которые можно получать и другими способами. Соединение MnVIIO3F получается при обработке KMnO4 фтороводородом. Оксохлорид рения(VI) ReOCl4 получается не только при гидролизе ReCl6, но и при действии O2 на ReCl5. Известны оксогалогениды и другого состава, например ReVO2F, ReVIIOF5, ReVIOF4. Ион Mn(II) является комплексообразователем большого количества ионов октаэдрического строения, проявляя в соединениях координационное число 6. Многие ионы и молекулы, способные предоставлять для химической связи электронную пару, образуют такие комплексные соединения. Особый интерес представляют [[Mn(SCN)6]]4 и [[Mn(CN)6]]4, так как эти ионы хорошо восстанавливаются электролитически, образуя с K комплексы одновалентного, а возможно, и нульвалентного марганца.
Оксиды. С увеличением степени окисления уменьшается стабильность оксидов марганца. При прямом окислении марганца получается MnO, но при нагревании образуются Mn2O3, MnO2 и Mn3O4, в чем проявляется сходство марганца с железом. Гептаоксид марганца Mn2O7 образуется при добавлении к KMnO4 сильной кислоты, но даже при низкой температуре он легко разлагается, часто со взрывом. Рений и технеций проявляют сходство, образуя гептаоксиды либо при прямом окислении, либо при действии HNO3 на оксиды в низших степенях окисления. Re2O7 и Tc2O7 значительно стабильнее, чем Mn2O7. Известен также красный оксид рения ReO3.
Амфотерность. Все элементы подгруппы проявляют амфотерные свойства в низких степенях окисления элементов. При нагревании MnO2 с основаниями образуются манганаты: Mn IVO32, голубой MnVO43, зеленый и устойчивый до 500° C MnVIO42, а также фиолетовый MnVIIO4. Манганат(V)-ион MnO43получают несколькими способами, среди которых мягкое восстановление MnO4иодид-ионом, действие основания на KMnO4 при высокой температуре. Соответствующий ион ReO33не так хорошо изучен. Перренаты и рениевая кислота образуются при окислении ReO2: при сплавлении металла или ReO2 со щелочью получается перренат натрия NaReO4; рениевая кислота HReO4 образуется в результате окисления ReO2 хлором. При обычном нагревании ReO2 происходит реакция диспропорционирования с образованием Re0 и Re2O7. Необычную степень окисления I рений проявляет при нагревании перрената с цинком, образуя Kre*4H2O, по-видимому, имеющий структуру плоского квадрата.
Другие соединения. Mn(II) образует с сульфид-ионом бледнорозовый MnS, растворимый в кислотных растворах. MnS2 получается при прямом взаимодействии металла с серой, но Mn не проявляет степень окисления IV, а образует соединение, подобное пириту FeS2. Высшие сульфиды, известные для Re и Tc, имеют соответственно состав Re2S7 и Tc2S7. При прямом синтезе марганца с C, N и Si получаются соответственно Mn3C, Mn5N3, MnSi и Mn2Si.