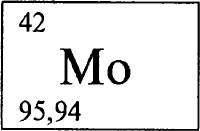МОЛИБДЕ́Н [дэ́], -а; м. [лат. Molybdaenum] Химический элемент (Mo), твёрдый тугоплавкий металл с серебристо-белым блеском (применяется в электротехнической промышленности и в виде сплавов в машиностроении). Проволока из молибдена.
◁ Молибде́новый, -ая, -ое. М-ые руды. М-ая сталь. М-ая проволока.
* * *
молибде́н (лат. Molybdaenum), химический элемент VI группы периодической системы. Название от греческого mólybdos - свинец (по сходству минералов Mo и Pb). Светло-серый металл, плотность 10,2 г/см3, tпл 2623°C. Химически стоек (на воздухе окисляется при температуре выше 400°C). Главный минерал - молибденит. Более 75% молибдена применяют для легирования чугунов и сталей, используемых в авиа- и автомобилестроении, при изготовлении лопаток турбин и др. Весьма перспективны жаропрочные (для реактивных двигателей) и кислотоупорные (аппараты химической промышленности) сплавы; так, сплав Fe-Ni-Мо стоек ко всем кислотам (кроме HF) до 100°C. Важный конструкционный материал в производстве нитей для электрических ламп и катодов для электровакуумных приборов. Оксиды МоО2, МоО3 - катализаторы нефтехимических и других процессов.
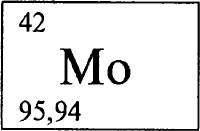
* * *
МОЛИБДЕН - МОЛИБДЕ́Н (лат. Molibdaenum), Mo (читается «молибден»), химический элемент с атомным номером 42, атомная масса 95,94. Природный молибден состоит из семи стабильных изотопов:92Мо (15,86% по массе), 94Мо (9,12%), 95Мо (15,70), 96Мо (16,50%), 97Мо (9,45%), 98Мо (23,75) и 100Мо (9,62% по массе). Конфигурация двух внешних электронных слоев 4s2p6d55s1. Степени окисления от +2 (валентность II) до +6 (VI) - наиболее характерна. Расположен в группе VIВ в 5 периоде периодической системы элементов.
Радиус атома 0,140 нм, радиус иона Mо3+ - 0,083 нм, иона Mо4+ - 0,079 нм, иона Мо5+ - 0,075 нм, иона Мо6+- от 0,055 нм (координационное число 4) до 0,087 (7). Энергии последовательной ионизации 7,10, 16,15, 27,13, 40,53, 55,6 и 71,7 эВ. Работа выхода электрона 4,3 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,8.
История открытия
Открыт в 1778 шведским химиком К. Шееле (см. ШЕЕЛЕ Карл Вильгельм), который прокаливая молибденовую кислоту, получил оксид МоО 3. Восстановив его углем, он получил молибден. Этот металл был загрязнен углем и карбидом молибдена. Чистый молибден в 1817 получил Й. Берцелиус (см. БЕРЦЕЛИУС Йенс Якоб). Название элемента происходит от греч. «молюбдос» - свинец, так как минерал - молибденовый блеск - внешне похож на свинец и его минерал - свинцовый блеск
Нахождение в природе
Содержание в земной коре 3·10 -4 % по массе. В свободном виде молибден не встречается. Известно около 20 минералов молибдена. Важнейшие из них: молибденит (см. МОЛИБДЕНИТ) МоS2, повеллит (см. ПОВЕЛЛИТ) СаМоО4, молибдит Fe(MoO 4)3.nH2O и вульфенит (см. ВУЛЬФЕНИТ) PbMoO4.
Получение
Промышленное получение молибдена начинается с обогащения руд флотационным методом. Полученный концентрат обжигают до образования оксида МоО3:
2МоS2 + 7O2 = 2MoO3 + 4SO2,
который подвергают дополнительной очистке. Далее МоО3 восстанавливают H2. Полученные заготовки обрабатывают давлением (ковка, прокатка, протяжка).
Физические и химические свойства
Молибден - светло-серый металл с кубической объемно центрированной решеткой типа a-Fe, а = 0,314 нм. Температура плавления 2623°C, кипения 4800°C, плотность 10,2 кг/дм3. Парамагнитен. Механические свойства определяются чистотой металла и предшествующей механической и термической обработкой.
При комнатной температуре на воздухе Mo устойчив. Начинает окисляться при 400°C. Выше 600°C быстро окисляется до триоксида МоО3. Этот оксид получают также окислением дисульфида молибдена МоS2 и термолизом молибдата аммония (NH4)6Mo7O24.4H2O.
Мо имеет оксид молибдена (IV) МоО2 и ряд оксидов, промежуточных между МоО3 и МоО2.
С галогенами (см. ГАЛОГЕНЫ) Mo образует ряд соединений в разных степенях окисления. При взаимодействии порошка молибдена или МоО3 с F2 получают гексафторид молибдена МоF6, бесцветную легкокипящую жидкость.
Mo (+4 и +5) образует твердые галогениды МоHal4 и МоHal5 (Hal = F, Cl, Br). С иодом известен только дииодид молибдена MoI2.
Mo образует оксигалогениды: MoOF4, MoOCl4, MoO2F2, MoO2Cl2, MoO2Br2, MoOBr3 и другие.
При нагревании молибдена с серой (см. СЕРА) образуется дисульфид молибдена МоS2, с селеном (см. СЕЛЕН) - диселенид молибдена состава MoSe2. Известны карбиды молибдена Mo2C и MoC - кристаллические высокоплавкие вещества и силицид молибдена МоSi2.
Особая группа соединений молибдена - молибденовые сини (см. МОЛИБДАТЫ). При действии сернистого газа, цинковой пыли, алюминия или других восстановителей на слабокислые (рН 4) суспензии оксида молибдена образуются ярко-синие вещества переменного состава: Мо2О5·Н2О, Мо4О11·Н2О и Мо8О23·8Н2О.
Mo образует молибдаты, соли не выделенных в свободном состоянии слабых молибденовых кислот, хН2О·уМоО3 (парамолибдат аммония 3(NH4)2O·7MoO3·zH2O; СаМоО4, Fe2(МоО4)3 - встречаются в природе). Молибдаты металлов I и III групп содержат тетраэдрические группировки [МоО4].
При подкислении водных растворов нормальных молибдатов образуются ионы MoO3OH-, затем ионы полимолибдатов: гепта-, (пара-) Мо7О266-, тетра-(мета-) Мо4О132-, окта- Мо8О26 4- и другие. Безводные полимолибдаты синтезируют спеканием МоО3 с оксидами металлов.
Существуют двойные молибдаты, в состав которых входят сразу два катиона, например, М+1М+3(МоО4)2, М+15М+3(МоО4)4. Оксидные соединения, содержащие молибден в низших степенях окисления - молибденовые бронзы, например, красная K0,26MoO3 и синяя К0,28МоО3. Эти соединения обладают металлической проводимостью и полупроводниковыми свойствами.
Применение
Молибден используется для легирования сталей, как компонент жаропрочных и коррозионно стойких сплавов. Молибденовая проволока (лента) служит для изготовления нагревателей для высокотемпературных печей, вводов электрического тока в лампочках. Соединения молибдена - сульфид, оксиды, молибдаты - являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы МоSi2 используется как твердая высокотемпературная смазка. Mo входит в состав микроудобрений. Радиоактивные изотопы 93Mo (T1/2 6,95 ч) и 99Mo (T1/2 66 ч) - изотопные индикаторы.
Физиологическое значение
Микроколичества Mo необходимы для нормального развития растений.