прил.
1. соотн. с сущ. псевдогаллюцинация, связанный с ним
2. Вызванный или сопровождаемый псевдогаллюцинациями.
прил.
1. соотн. с сущ. псевдогаллюцинация, связанный с ним
2. Вызванный или сопровождаемый псевдогаллюцинациями.
ПСЕВДОГАЛЛЮЦИНАТО́РНЫЙ -ая, -ое. Спец. Вызванный или сопровождаемый псевдогаллюцинациями. П-ые явления.
ж.
Психопатологическое явление, родственное галлюцинации, но отличающееся от нее отсутствием связи с реальным пространством.
ПСЕВДОГАЛЛЮЦИНА́ЦИЯ -и; ж. Спец. Психопатологическое явление, родственное галлюцинации, но отличающееся от неё отсутствием связи с реальным пространством. Зрительные, слуховые псевдогаллюцинации.
* * *
псевдогаллюцина́ция (от псевдо... и галлюцинация), расстройство восприятия в виде ощущений, образов, возникающих непроизвольно без соответствующего внешнего раздражения. От галлюцинации отличается тем, что больной воспринимает эти образы как особые, отличные от реальных, «сделанные», обусловленные чьим-то влиянием.
* * *
ПСЕВДОГАЛЛЮЦИНАЦИЯ - ПСЕВДОГАЛЛЮЦИНА́ЦИЯ (от псевдо... (см. ПСЕВДО... (приставка)) и галлюцинация (см. ГАЛЛЮЦИНАЦИЯ)), расстройство восприятия в виде ощущений, образов, возникающих непроизвольно, без соответствующего внешнего раздражения. От галлюцинации отличается тем, что больной воспринимает эти образы как особые, отличные от реальных, «сделанные», обусловленные чьим-то влиянием.
ПСЕВДОГАЛЛЮЦИНАЦИЯ (от псевдо... и галлюцинация) - расстройство восприятия в виде ощущений, образов, возникающих непроизвольно, без соответствующего внешнего раздражения. От галлюцинации отличается тем, что больной воспринимает эти образы как особые, отличные от реальных, "сделанные", обусловленные чьим-то влиянием.
- Расстройство восприятия в виде ощущений, образов, возникающих непроизвольно, без соответствующего внешнего раздражения.
С (carboneum), неметаллический химический элемент IVA подгруппы (C, Si, Ge, Sn, Pb) периодической системы элементов. Встречается в природе в виде кристаллов алмаза (рис. 1), графита или фуллерена и других форм и входит в состав органических (уголь, нефть, организмы животных и растений и др.) и неорганических веществ (известняк, пищевая сода и др.). Углерод широко распространен, но содержание его в земной коре всего 0,19% (см. также АЛМАЗ; ФУЛЛЕРЕНЫ).
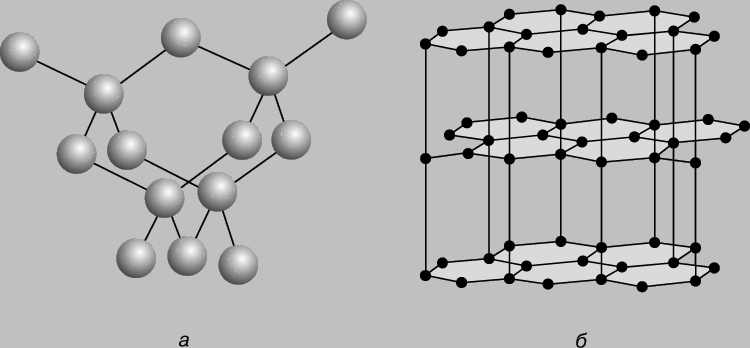
Рис. 1. СТРУКТУРА алмаза (а) и графита (б).
Углерод широко используется в виде простых веществ. Кроме драгоценных алмазов, являющихся предметом ювелирных украшений, большое значение имеют промышленные алмазы - для изготовления шлифовального и режущего инструмента. Древесный уголь и другие аморфные формы углерода применяются для обесцвечивания, очистки, адсорбции газов, в областях техники, где требуются адсорбенты с развитой поверхностью. Карбиды, соединения углерода с металлами, а также с бором и кремнием (например, Al4C3, SiC, B4C) отличаются высокой твердостью и используются для изготовления абразивного и режущего инструмента. Углерод входит в состав сталей и сплавов в элементном состоянии и в виде карбидов. Насыщение поверхности стальных отливок углеродом при высокой температуре (цементация) значительно увеличивает поверхностную твердость и износостойкость.
См. также СПЛАВЫ. В природе существует множество различных форм графита; некоторые получены искусственно; имеются аморфные формы (например, кокс и древесный уголь). Сажа, костяной уголь, ламповая сажа, ацетиленовая сажа образуются при сжигании углеводородов при недостатке кислорода. Так называемый белый углерод получается сублимацией пиролитического графита при пониженном давлении - это мельчайшие прозрачные кристаллики графитовых листочков с заостренными кромками.
Историческая справка. Графит, алмаз и аморфный углерод известны с древности. Издавна известно, что графитом можно маркировать другой материал, и само название "графит", происходящее от греческого слова, означающего "писать", предложено А.Вернером в 1789. Однако история графита запутана, часто за него принимали вещества, обладающие сходными внешними физическими свойствами, например молибденит (сульфид молибдена), одно время считавшийся графитом. Среди других названий графита известны "черный свинец", "карбидное железо", "серебристый свинец". В 1779 К.Шееле установил, что графит можно окислить воздухом с образованием углекислого газа. Впервые алмазы нашли применение в Индии, а в Бразилии драгоценные камни приобрели коммерческое значение в 1725; месторождения в Южной Африке были открыты в 1867. В 20 в. основными производителями алмазов являются ЮАР, Заир, Ботсвана, Намибия, Ангола, Сьерра-Леоне, Танзания и Россия. Искусственные алмазы, технология которых была создана в 1970, производятся для промышленных целей.
Аллотропия. Если структурные единицы вещества (атомы для одноатомных элементов или молекулы для полиатомных элементов и соединений) способны соединяться друг с другом в более чем одной кристаллической форме, это явление называется аллотропией. У углерода три аллотропические модификации - алмаз, графит и фуллерен. В алмазе каждый атом углерода имеет 4 тетраэдрически расположенных соседа, образуя кубическую структуру (рис. 1,а). Такая структура отвечает максимальной ковалентности связи, и все 4 электрона каждого атома углерода образуют высокопрочные связи С-С, т.е. в структуре отсутствуют электроны проводимости. Поэтому алмаз отличается отсутствием проводимости, низкой теплопроводностью, высокой твердостью; он самый твердый из известных веществ (рис. 2). На разрыв связи С-С (длина связи 1,54 , отсюда ковалентный радиус 1,54/2 = 0,77 ) в тетраэдрической структуре требуются большие затраты энергии, поэтому алмаз, наряду с исключительной твердостью, характеризуется высокой температурой плавления (3550° C).
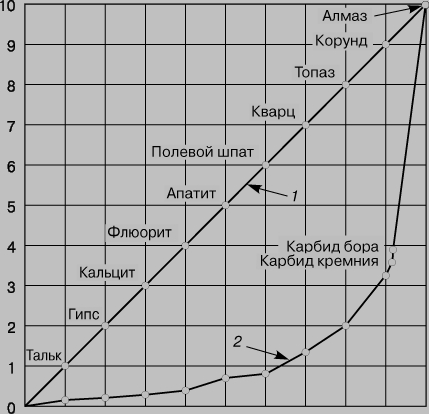
Рис. 2. СРАВНИТЕЛЬНАЯ ТВЕРДОСТЬ МИНЕРАЛОВ по шкале Мооса (качественная оценка) (1) и по шкале истинной относительной твердости (количественная оценка) (2). По кривой 2 видно, насколько алмаз тверже наиболее твердых материалов.
Другой аллотропической формой углерода является графит, сильно отличающийся от алмаза по свойствам. Графит - мягкое черное вещество из легко слоящихся кристалликов, отличающееся хорошей электропроводностью (электрическое сопротивление 0,0014 Ом*см). Поэтому графит применяется в дуговых лампах и печах (рис. 3), в которых необходимо создавать высокие температуры. Графит высокой чистоты применяют в ядерных реакторах в качестве замедлителя нейтронов. Температура плавления его при повышенном давлении равна 3527° C. При обычном давлении графит сублимируется (переходит из твердого состояния в газ) при 3780° C.
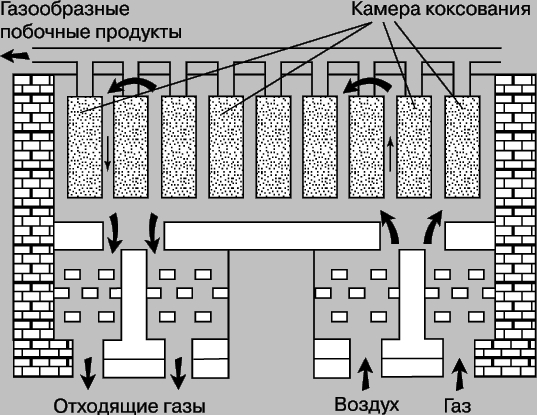
Рис. 3. СХЕМА КОКСОВОЙ ПЕЧИ для коксования битумных углей в отсутствие воздуха (газовоздушная обогревающая смесь не попадает в камеру, где находится коксуемый уголь).
Структура графита (рис. 1,б) представляет собой систему конденсированных гексагональных колец с длиной связи 1,42 (значительно короче, чем в алмазе), но при этом каждый атом углерода имеет три (а не четыре, как в алмазе) ковалентные связи с тремя соседями, а четвертая связь (3,4 ) слишком длинна для ковалентной связи и слабо связывает параллельно уложенные слои графита между собой. Именно четвертый электрон углерода определяет тепло- и электропроводность графита - эта более длинная и менее прочная связь формирует меньшую компактность графита, что отражается в меньшей твердости его в сравнении с алмазом (плотность графита 2,26 г/см3, алмаза - 3,51 г/см3). По той же причине графит скользкий на ощупь и легко отделяет чешуйки вещества, что и используется для изготовления смазки и грифелей карандашей. Свинцовый блеск грифеля объясняется в основном наличием графита. Волокна углерода имеют высокую прочность и могут использоваться для изготовления искусственного шелка или другой пряжи с высоким содержанием углерода. При высоких давлении и температуре в присутствии катализатора, например железа, графит может превращаться в алмаз. Этот процесс реализован для промышленного получения искусственных алмазов. Кристаллы алмаза растут на поверхности катализатора. Равновесие графит алмаз существует при 15 000 атм и 300 K или при 4000 атм и 1500 K. Искусственные алмазы можно получать и из углеводородов. К аморфным формам углерода, не образующим кристаллов, относят древесный уголь, получаемый нагревом дерева без доступа воздуха, ламповую и газовую сажу, образующуюся при низкотемпературном сжигании углеводородов при недостатке воздуха и конденсируемую на холодной поверхности, костяной уголь - примесь к фосфату кальция в процессе деструкции костной ткани, а также каменный уголь (природное вещество с примесями) и кокс, сухой остаток, получаемый при коксовании топлив методом сухой перегонки каменного угля или нефтяных остатков (битуминозных углей), т.е. нагреванием без доступа воздуха. Кокс применяется для выплавки чугуна, в черной и цветной металлургии. При коксовании образуются также газообразные продукты - коксовый газ (H2, CH4, CO и др.) и химические продукты, являющиеся сырьем для получения бензина, красок, удобрений, лекарственных препаратов, пластмасс и т.д. Схема основного аппарата для производства кокса - коксовой печи - приведена на рис. 3. Различные виды угля и сажи отличаются развитой поверхностью и поэтому используются как адсорбенты для очистки газа, жидкостей, а также как катализаторы. Для получения различных форм углерода применяют специальные методы химической технологии. Искусственный графит получают прокаливанием антрацита или нефтяного кокса между углеродными электродами при 2260° С (процесс Ачесона) и используют в производстве смазочных материалов и электродов, в частности для электролитического получения металлов.
Строение атома углерода. Ядро наиболее стабильного изотопа углерода массой 12 (распространенность 98,9%) имеет 6 протонов и 6 нейтронов (12 нуклонов), расположенных тремя квартетами, каждый содержит 2 протона и два нейтрона аналогично ядру гелия. Другой стабильный изотоп углерода - 13C (ок. 1,1%), а в следовых количествах существует в природе нестабильный изотоп 14C с периодом полураспада 5730 лет, обладающий b-излучением. В нормальном углеродном цикле живой материи участвуют все три изотопа в виде СO2. После смерти живого организма расход углерода прекращается и можно датировать С-содержащие объекты, измеряя уровень радиоактивности 14С. Снижение b-излучения 14CO2 пропорционально времени, прошедшему с момента смерти. В 1960 У.Либби за исследования с радиоактивным углеродом был удостоен Нобелевской премии.
См. также ДАТИРОВКА ПО РАДИОАКТИВНОСТИ. В основном состоянии 6 электронов углерода образуют электронную конфигурацию 1s22s22px12py12pz0. Четыре электрона второго уровня являются валентными, что соответствует положению углерода в IVA группе периодической системы (см. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ). Поскольку для отрыва электрона от атома в газовой фазе требуется большая энергия (ок. 1070 кДж/моль), углерод не образует ионные связи с другими элементами, так как для этого необходим был бы отрыв электрона с образованием положительного иона. Имея электроотрицательность, равную 2,5, углерод не проявляет и сильного сродства к электрону, соответственно не являясь активным акцептором электронов. Поэтому он не склонен к образованию частицы с отрицательным зарядом. Но с частично ионным характером связи некоторые соединения углерода существуют, например, карбиды. В соединениях углерод проявляет степень окисления 4. Чтобы четыре электрона смогли участвовать в образовании связей, необходимо распаривание 2s-электронов и перескок одного из этих электронов на 2pz-орбиталь; при этом образуются 4 тетраэдрические связи с углом между ними 109°. В соединениях валентные электроны углерода лишь частично оттянуты от него, поэтому углерод образует прочные ковалентные связи между соседними атомами типа С-С с помощью общей электронной пары. Энергия разрыва такой связи равна 335 кДж/моль, тогда как для связи Si-Si она составляет всего 210 кДж/моль, поэтому длинные цепочки -Si-Si- неустойчивы. Ковалентный характер связи сохраняется даже в соединениях высокореакционноспособных галогенов с углеродом, CF4 и CCl4. Углеродные атомы способны предоставлять на образование связи более одного электрона от каждого атома углерода; так образуются двойная С=С и тройная СєС связи. Другие элементы также образуют связи между своими атомами, но только углерод способен образовывать длинные цепи. Поэтому для углерода известны тысячи соединений, называемых углеводородами, в которых углерод связан с водородом и другими углеродными атомами, образуя длинные цепи или кольцевые структуры.
См. ХИМИЯ ОРГАНИЧЕСКАЯ. В этих соединениях возможно замещение водорода на другие атомы, наиболее часто на кислород, азот и галогены с образованием множества органических соединений. Важное значение среди них занимают фторуглеводороды - углеводороды, в которых водород замещен на фтор. Такие соединения чрезвычайно инертны, и их используют как пластичные и смазочные материалы (фторуглероды, т.е. углеводороды, в которых все атомы водорода замещены на атомы фтора) и как низкотемпературные хладагенты (хладоны, или фреоны, - фторхлоруглеводороды). В 1980-х годах физиками США был обнаружены очень интересные соединения углерода, в которых атомы углерода соединены в 5- или 6-угольники, образующие молекулу С60 по форме полого шара, имеющего совершенную симметрию футбольного мяча. Поскольку такая конструкция лежит в основе "геодезического купола", изобретенного американским архитектором и инженером Бакминстером Фуллером, новый класс соединений был назван "бакминстерфуллеренами" или "фуллеренами" (а также более коротко - "фазиболами" или "бакиболами"). Фуллерены - третья модификация чистого углерода (кроме алмаза и графита), состоящая из 60 или 70 (и даже более) атомов, - была получена действием лазерного излучения на мельчайшие частички углерода. Фуллерены более сложной формы состоят из нескольких сотен атомов углерода. Диаметр молекулы С60 УГЛЕРОД 1нм. В центре такой молекулы достаточно пространства для помещения большого атома урана.
См. также ФУЛЛЕРЕНЫ.
Стандартная атомная масса. В 1961 Международные союзы теоретической и прикладной химии (ИЮПАК) и по физике приняли за единицу атомной массы массу изотопа углерода 12C, упразднив существовавшую до того кислородную шкалу атомных масс. Атомная масса углерода в этой системе равна 12,011, так как она является средней для трех природных изотопов углерода с учетом их распространенности в природе.
См. АТОМНАЯ МАССА. Химические свойства углерода и некоторых его соединений. Некоторые физические и химические свойства углерода приведены в статье ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ. Реакционная способность углерода зависит от его модификации, температуры и дисперсности. При низких температурах все формы углерода достаточно инертны, но при нагревании окисляются кислородом воздуха, образуя оксиды:

Мелкодисперсный углерод в избытке кислорода способен взрываться при нагревании или от искры. Кроме прямого окисления существуют более современные методы получения оксидов. Субоксид углерода C3O2 образуется при дегидратации малоновой кислоты над P4O10:
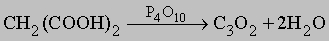
C3O2 имеет неприятный запах, легко гидролизуется, вновь образуя малоновую кислоту.
Монооксид углерода(II) СО образуется при окислении любой модификации углерода в условиях недостатка кислорода. Реакция экзотермична, выделяется 111,6 кДж/моль. Кокс при температуре белого каления реагирует с водой: C + H2O = CO + H2; образующаяся газовая смесь называется "водяной газ" и является газообразным топливом. СO образуется также при неполном сгорании нефтепродуктов, в заметных количествах содержится в автомобильных выхлопах, получается при термической диссоциации муравьиной кислоты:
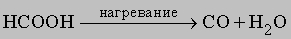
Степень окисления углерода в СО равна +2, а поскольку углерод более устойчив в степени окисления +4, то СО легко окисляется кислородом до CO2: CO + O2 (r) CO2, эта реакция сильно экзотермична (283 кДж/моль). СО применяют в промышленности в смеси с H2 и другими горючими газами в качестве топлива или газообразного восстановителя. При нагревании до 500° C CO в заметной степени образует С и CO2, но при 1000° C равновесие устанавливается при малых концентрациях СO2. CO реагирует с хлором, образуя фосген - COCl2, аналогично протекают реакции с другими галогенами, в реакции с серой получается сульфид карбонила COS, с металлами (M) СO образует карбонилы различного состава M(CO)x, являющиеся комплексными соединениями. Карбонил железа образуется при взаимодействии гемоглобина крови с CO, препятствуя реакции гемоглобина с кислородом, так как карбонил железа - более прочное соединение. В результате блокируется функция гемоглобина как переносчика кислорода к клеткам, которые при этом погибают (и в первую очередь поражаются клетки мозга). (Отсюда еще одно название СО - "угарный газ"). Уже 1% (об.) СO в воздухе опасен для человека, если он находится в такой атмосфере более 10 мин. Некоторые физические свойства СО приведены в таблице. Диоксид углерода, или оксид углерода(IV) CO2 образуется при сгорании элементного углерода в избытке кислорода c выделением тепла (395 кДж/моль). CO2 (тривиальное название - "углекислый газ") образуется также при полном окислении СО, нефтепродуктов, бензина, масел и др. органических соединений. При растворении карбонатов в воде в результате гидролиза также выделяется СО2:
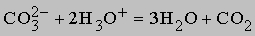
Такой реакцией часто пользуются в лабораторной практике для получения CO2. Этот газ можно получить и при прокаливании бикарбонатов металлов:
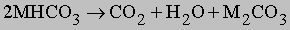
при газофазном взаимодействии перегретого пара с СО:

при сжигании углеводородов и их кислородпроизводных, например:
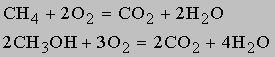
Аналогично окисляются пищевые продукты в живом организме с выделением тепловой и других видов энергии. При этом окисление протекает в мягких условиях через промежуточные стадии, но конечные продукты те же - СO2 и H2O, как, например, при разложении сахаров под действием ферментов, в частности при ферментации глюкозы:
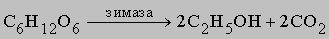
Многотоннажное производство углекислого газа и оксидов металлов осуществляется в промышленности термическим разложением карбонатов:

CaO в больших количествах используется в технологии производства цемента. Термическая стабильность карбонатов и затраты теплоты на их разложение по этой схеме возрастают в ряду CaCO3 < SrCO3 < BaCO3. Углекислый газ - химически неактивное соединение, однако в некоторых случаях он может поддерживать процесс горения, например, магний горит в среде СО2. Материалы, горящие при низких температурах - дерево, нефтепродукты, бумага и др., - не горят в среде СО2. Поэтому, а также из-за большей, чем у воздуха, плотности (СO2 в 1,5 раза тяжелее), углекислый газ используют в огнетушителях. В твердом состоянии СО2 известен как "сухой лед". При высоких концентрациях CO2 опасен для человека, так как блокирует доступ кислорода
(см. также ПОЖАРНАЯ ПРОФИЛАКТИКА И ПРОТИВОПОЖАРНАЯ ЗАЩИТА). Электронное строение оксидов углерода. Электронное строение любого оксида углерода можно описать тремя равновероятными схемами с различным расположением электронных пар - тремя резонансными формами:
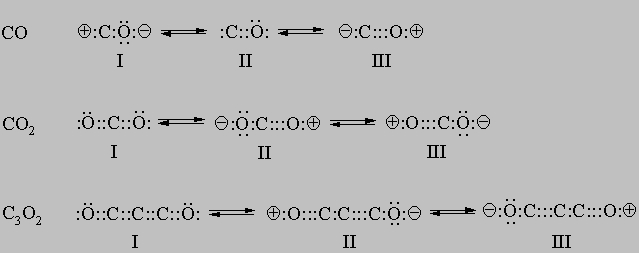
Все оксиды углерода имеют линейное строение.
Угольная кислота. При взаимодействии СO2 с водой образуется угольная кислота H2CO3. В насыщенном растворе CO2 (0,034 моль/л) только часть молекул образует H2CO3, а большая часть CO2 находится в гидратированном состоянии CO2*H2O.
Карбонаты. Карбонаты образуются при взаимодействии оксидов металлов с CO2, например, Na2O + CO2 -> NaHCO3 которые при нагревании разлагаются с выделением СО2: 2NaHCO3 -> Na2CO3 + H2O + CO2 Карбонат натрия, или соду, производят в содовой промышленности в больших количествах преимущественно методом Сольве:
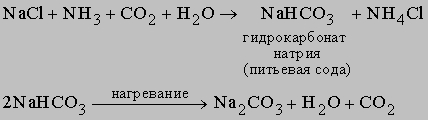
Другим методом соду получают из CO2 и NaOH
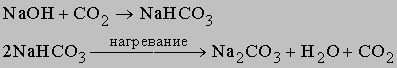
Карбонат-ион CO32- имеет плоское строение с углом O-C-O, равным 120°, и длиной СО-связи 1,31
(см. также ЩЕЛОЧЕЙ ПРОИЗВОДСТВО).
Галогениды углерода. Углерод непосредственно реагирует с галогенами при нагревании, образуя тетрагалогениды, но скорость реакции и выход продукта невелики. Поэтому галогениды углерода получают другими методами, например, хлорированием дисульфида углерода получают CCl4: CS2 + 2Cl2 -> CCl4 + 2S Тетрахлорид CCl4 - негорючее вещество, используется в качестве растворителя в процессах сухой чистки, но не рекомендуется применять его как пламегаситель, так как при высокой температуре происходит образование ядовитого фосгена (газообразное отравляющее вещество). Сам ССl4 также ядовит и при вдыхании в заметных количествах может вызвать отравление печени. СCl4 образуется и по фотохимической реакции между метаном СH4 и Сl2; при этом возможно образование продуктов неполного хлорирования метана - CHCl3, CH2Cl2 и CH3Cl. Аналогично протекают реакции и с другими галогенами.
Реакции графита. Графит как модификация углерода, отличающаяся большими расстояниями между слоями гексагональных колец, вступает в необычные реакции, например, щелочные металлы, галогены и некоторые соли (FeCl3) проникают между слоями, образуя соединения типа KC8, KC16 (называемые соединениями внедрения, включения или клатратами). Сильные окислители типа KClO3 в кислой среде (серной или азотной кислоты) образуют вещества с большим объемом кристаллической решетки (до 6 между слоями), что объясняется внедрением кислородных атомов и образованием соединений, на поверхности которых в результате окисления образуются карбоксильные группы (-СООН) - соединения типа оксидированного графита или меллитовой (бензолгексакарбоновой) кислоты С6(COOH)6. В этих соединениях отношение С:O может изменяться от 6:1 до 6:2,5.
Карбиды. Углерод образует с металлами, бором и кремнием разнообразные соединения, называемые карбидами. Наиболее активные металлы (IA-IIIA подгрупп) образуют солеподобные карбиды, например Na2C2, CaC2, Mg4C3, Al4C3. В промышленности карбид кальция получают из кокса и известняка по следующим реакциям:
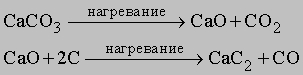
Карбиды неэлектропроводны, почти бесцветны, гидролизуются с образованием углеводородов, например CaC2 + 2H2O = C2H2 + Ca(OH)2 Образующийся по реакции ацетилен C2H2 служит исходным сырьем в производстве многих органических веществ. Этот процесс интересен, так как он представляет переход от сырья неорганической природы к синтезу органических соединений. Карбиды, образующие при гидролизе ацетилен, называются ацетиленидами. В карбидах кремния и бора (SiC и B4C) связь между атомами ковалентная. Переходные металлы (элементы B-подгрупп) при нагревании с углеродом тоже образуют карбиды переменного состава в трещинах на поверхности металла; связь в них близка к металлической. Некоторые карбиды такого типа, например WC, W2C, TiC и SiC, отличаются высокой твердостью и тугоплавкостью, обладают хорошей электропроводностью. Например, NbC, TaC и HfC - наиболее тугоплавкие вещества (т.пл. = 4000-4200° С), карбид диниобия Nb2C - сверхпроводник при 9,18 К, TiC и W2C по твердости близки алмазу, а твердость B4C (структурного аналога алмаза) составляет 9,5 по шкале Мооса (см. рис. 2). Инертные карбиды образуются, если радиус переходного металла < 1,3 , а при большем радиусе образуются реакционноспособные карбиды типа Mn3C, Ni3C3, Fe3C.
Азотпроизводные углерода. К этой группе относится мочевина NH2CONH2 - азотное удобрение, применяемое в виде раствора. Мочевину получают из NH3 и CO2 при нагревании под давлением:
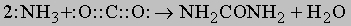
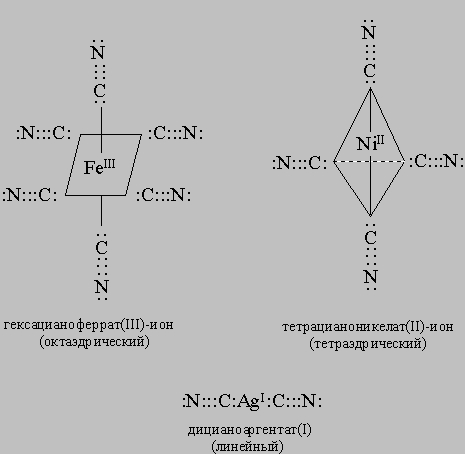
Дициан (CN)2 по многим свойствам подобен галогенам и его часто называют псевдогалоген. Дициан получают мягким окислением цианид-иона кислородом, пероксидом водорода или ионом Cu2+: 2CN-> (CN)2 + 2e. Цианид-ион, являясь донором электронов, легко образует комплексные соединения с ионами переходных металлов. Подобно СО, цианид-ион является ядом, связывая жизненно важные соединения железа в живом организме. Цианидные комплексные ионы имеют общую формулу [[M(CN)x]]-0,5x, где х - координационное число металла (комплексообразователя), эмпирически равно удвоенному значению степени окисления иона металла. Примерами таких комплексных ионов являются (строение некоторых ионов приведено ниже) тетрацианоникелат(II)-ион [[Ni(CN)4]]2-, гексацианоферрат(III) [[Fe(CN)6]]3-, дицианоаргентат [[Ag(CN)2]]-:
Карбонилы. Монооксид углерода способен непосредственно реагировать со многими металлами или ионами металлов, образуя комплексные соединения, называемые карбонилами, например Ni(CO)4, Fe(CO)5, Fe2(CO)9, [[Fe(CO)4]]3, Mo(CO)6, [[Co(CO)4]]2. Связь в этих соединениях аналогична связи в описанных выше цианокомплексах. Ni(CO)4 - летучее вещество, используется для отделения никеля от других металлов. Ухудшение структуры чугуна и стали в конструкциях часто связано с образованием карбонилов. Водород может входить в состав карбонилов, образуя карбонилгидриды, такие, как H2Fe(CO)4 и HCo(CO)4, проявляющие кислотные свойства и реагирующие со щелочью: H2Fe(CO)4 + NaOH -> NaHFe(CO)4 + H2O Известны также карбонилгалогениды, например Fe(CO)X2, Fe(CO)2X2, Co(CO)I2, Pt(CO)Cl2, где Х - любой галоген
(см. также МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ).
Углеводороды. Известно огромное количество соединений углерода с водородом
(см. ХИМИЯ ОРГАНИЧЕСКАЯ).
ЛИТЕРАТУРА
Сюняев З.И. Нефтяной углерод. М., 1980 Химия гиперкоординированного углерода. М., 1990
ГРУППА 0. БЛАГОРОДНЫЕ (ИНЕРТНЫЕ) ГАЗЫ ГЕЛИЙ, НЕОН, АРГОН, КРИПТОН, КСЕНОН, РАДОН
Атомы элементов нулевой группы имеют полностью завершенную внешнюю электронную оболочку, что соответствует наиболее стабильной электронной конфигурации, и в течение многих лет считалось, что эти элементы не образуют химических соединений. Поэтому рассматриваемое семейство называли "инертные газы". Однако в 1962 в Университете Британской Колумбии (Канада) был синтезирован гексафтороплатинат ксенона Xe2PtF6. Позже были синтезированы другие соединения ксенона, а также криптона и радона. Молекулы благородных газов одноатомны в отличие от большинства распространенных газов, содержащихся в атмосфере (азот, кислород), и водорода, молекулы которых двухатомны. Благородные газы имеют очень низкие температуры сжижения и затвердевания (табл. 1) при нормальном давлении. Например, для гелия, самого легкого элемента, эти температуры находятся вблизи абсолютного нуля (0 K = 273,16° C). Также очень малы температурные области существования этих газов в жидком состоянии (разность температур кипения и плавления) и значения энергий перехода твердое состояние жидкость газ. Эти данные свидетельствуют об очень слабом межмолекулярном взаимодействии (вандерваальсовы силы очень малы), поэтому благородные газы максимально близки к состоянию идеальных газов и для них наиболее строго соблюдаются фундаментальные газовые законы (закон Бойля и др.). В случае сильной ионизации (например, в сильном магнитном поле или искровом разряде в неоновых трубках) электроны атомов этих газов могут вылетать, образуя заряженные частицы (см. энергию ионизации в табл. 1). В этих условиях затраты энергии велики.
Гелий. Гелий был открыт в 1868 при изучении солнечного затмения. При спектроскопическом анализе солнечной хроносферы была обнаружена желтая спектральная линия, первоначально отнесенная к спектру натрия, однако в 1871 Н.Локьер и Ж.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Э.Франкленд назвал новый элемент гелием от греческого слова "гелиос", означающего "солнце". В 1895 У.Рамзай выделил и идентифицировал гелий из минерала клевеита и доказал, что спектральные линии газа, выделяющегося из этого минерала, идентифицируются с линиями, наблюдаемыми при спектральном исследовании хромосферы солнца. Гелий получают в настоящее время в больших количествах из некоторых скважин природного газа в США. Особенно богатые выходы (до 8% гелия) находятся вблизи Декстера (шт. Канзас). Выделение гелия из природных газов нефтяных месторождений возможно методом фракционного охлаждения.
Гелий обладает рядом необычных физических свойств. Например, при свободном расширении гелий нагревается вместо охлаждения, характерного для большинства газов. При Ј 40 K (233,15° C) термический эффект расширения становится нормальным. При 3 K (270,15° C) образуется необычная форма жидкого гелия гелий II, обладающий сверхтекучестью свойством подниматься по стенкам сосуда и перетекать, а также необычно высокой проводимостью и малой вязкостью.
Применение. Гелий находит многочисленные применения. Поскольку он значительно легче воздуха, то используется в воздухоплавательных аппаратах. Самый легкий газ это водород (мол. масса 2,016), который легче гелия, но способен взрываться в смеси с воздухом, тогда как гелий инертен и поэтому предпочтительнее для наполнения воздушных шаров. Шар, заполненный гелием, должен быть в объеме всего на 8% больше, чем водородный шар, чтобы поднять такой же груз. Гелий, как и другие инертные газы, применяют для создания инертной среды в химических процессах (например, для предотвращения реакций с воздухом или кислородом). Сварка магния, алюминия и титана, а также специальных стальных сплавов проводится в гелиевой среде. В кислородную смесь для водолазов часто добавляют гелий вместо азота, т.к. такая смесь исключает проблемы, связанные с декомпрессионной болезнью (растворимость гелия в крови меньше, чем азота, что уменьшает время декомпрессии и соответственно болезненные ощущения). Жидкий гелий обеспечивает возможность охлаждать вещества до температур, близких к абсолютному нулю; при таких температурах часто обнаруживаются необычные свойства вещества.
Реакции образования. Наиболее общей формой гелия является изотоп 42He, называемый гелий-4. (Нижняя цифра перед символом элемента обозначает атомный номер, т.е. заряд ядра, а верхняя цифра массовое число изотопа, или общее число протонов и нейтронов, в данном случае 2 протона и 2 нейтрона.) Гелий 42He получается из a-частицы, состоящей из 2 протонов и 2 нейтронов, при присоединении 2 электронов, а a-частица является продуктом распада радиоактивного материала. Другой изотоп гелия 32He (2 протона и 1 нейтрон) стабилен, но его содержание составляет всего 14 атомов на 10 000 атомов гелия-4. Он образуется в результате космических превращений, например при бомбардировке дейтерия 21H космическими лучами получается нестабильный тритий 31H, который, испуская b-частицу, образует 32He.
См. также ГЕЛИЙ.
Неон впервые был выделен У.Рамзаем и М.Траверсом в 1898 при фракционном разделении воздуха. Из 44 т жидкого воздуха можно получить всего около 450 г неона. В газоразрядной трубке возбужденный неон имеет приятный красно-оранжевый или розовый цвет. Существенные количества неона используются в неоновой рекламе. При смешении неона с парами ртути можно получать различную окраску.
Аргон был открыт как инертный газ в атмосфере в 1894 Дж.Рэлеем, который обнаружил, что атмосферный азот на 0,5% тяжелее, чем полученный химическим путем. Разница объяснялась присутствием ничтожного количества более тяжелых инертных газов, преимущественно аргона. Этот элемент был первым из инертных газов, обнаруженных в природе на нашей планете. Содержание аргона в атмосфере составляет 0,93%(об.), причем его несколько больше над поверхностью больших водоемов, чем над сушей, так как азот и кислород более растворимы в воде. В электротехнической промышленности ежемесячно расходуется несколько тысяч кубических метров аргона для создания инертной среды в лампах накаливания: аргоновая среда позволяет снизить скорость испарения вольфрамовой нити и предотвращает ее окисление.
Криптон был открыт У. Рамзаем и М. Траверсом в 1898 при анализе остатков воздуха после разделения. Необычное свойство газа заключается в возможности создания при его возбуждении интенсивной вспышки, длящейся только 0,00002 с. Поэтому его используют для высокоскоростной фотографии.
Ксенон и радон. Ксенон, тяжелый благородный газ со стабильным ядром, был открыт У.Рамзаем и М.Траверсом в 1898. Радон, самый тяжелый из благородных газов, был открыт в 1900 Э.Резерфордом (220Rn) и Ф.Дорном и А.Дебьерном (222Rn), а в 1903 Ф.Гизель и Дебьерн открыли 219Rn. Атом радона имеет три короткоживущих изотопа 222, 220 и 219 и отличается чрезвычайно нестабильной структурой ядра; он испускает a-частицы, образуя полоний. Радий распадается до радона, и поэтому все минералы, содержащие радий, содержат радон. Для выделения радона из таких минералов требуется сильное нагревание. Радон из радия собирают в ловушки и размещают в золотых ампулах для лечения больных раком. g-Излучение радона идентично излучению радия, и раковые больные получают лечение с помощью ампулы, вшитой в участок тела вблизи злокачественной опухоли.
ВОДОРОД
Водород наиболее распространенный элемент во Вселенной. Он соcтавляет большую часть вещества звезд и межзвездной материи. С кислородом он образует наиболее распространенное на земле вещество воду, а совместно с углеродом входит в состав каждого органического соединения. Водород самый легкий элемент с атомным номером 1; ядро протия наиболее стабильного изотопа водорода состоит только из одного протона без нейтронов. Всего у водорода три изотопа: 1) наиболее распространенный протий 11H, 2) дейтерий 21H (или 21D) часто называют "тяжелый" водород, 3) наименее распространенный изотоп тритий 31H (или 31T) является радиоактивным и поэтому в природе не встречается в сколько-нибудь значительном количестве. Водород бесцветный газ, без запаха, легко возгорается при комнатной температуре, плохо растворяется в воде. Он находит широкое применение в промышленности, например при гидрогенизации жиров и масел. Водород занимает особое положение в периодической системе (см. рис. 1), так как его электронная структура состоит всего из одного электрона. Способность отдавать его, образуя ионную связь, роднит водород со щелочными металлами, и его располагают в верху подгруппы щелочных металлов (подгруппа IА). Но водород может и принимать один электрон, проявляя отрицательную степень окисления, как галогены (фтор, хлор и др.), поэтому его иногда называют "псевдогалоген" и размещают в верху подгруппы галогенов (подгруппа VIIA). См. также ВОДОРОД.