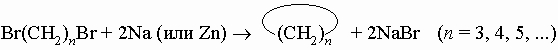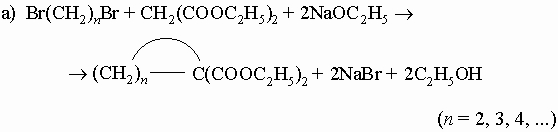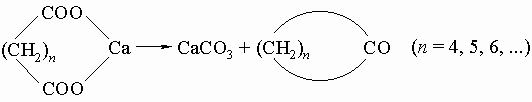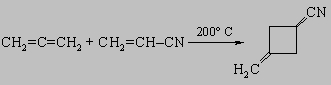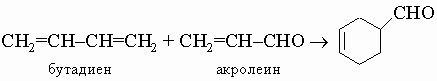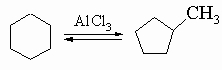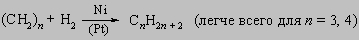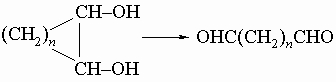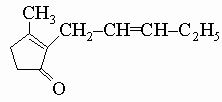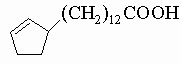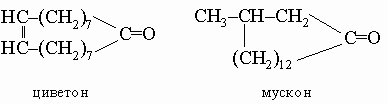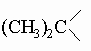Встречаются в самых разнообразных природных соединениях,
в частности, в нефти.
Алициклические соединения определяют как карбоциклические (в цикле присутствуют только атомы углерода) соединения, которые в своих реакциях обнаруживают преимущественно алифатический характер в противоположность поведению ароматических соединений. Их удобно подразделить по числу колец в молекуле на моноциклические (одноядерные) и полициклические (многоядерные - бициклические, трициклические и т.д.) кольцевые системы. Многие насыщенные алициклические углеводороды найдены в нефти. Ненасыщенные алициклические углеводороды, возникающие, по крайней мере формально, при полимеризации изопрена CH2=C(CH3)CH=CH2 и известные под названием терпенов, в изобилии встречаются во многих эфирных маслах. Алициклические системы часто встречаются в природных соединениях, иных, чем терпены, например в каротиноидах и стероидах.
А. МОНОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
1. Синтез. Следующие реакции иллюстрируют общие методы синтеза. Обычно пяти- и шестичленные кольца образуются легче всего, так как углерод может сохранить в них нормальные валентные углы. 1) Из дигалогенидов:
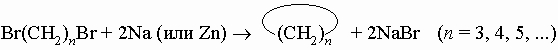
2) Из малонового или ацетоуксусного эфира:
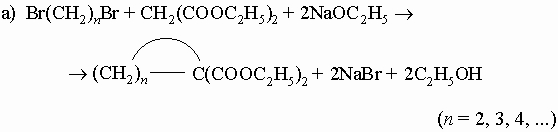
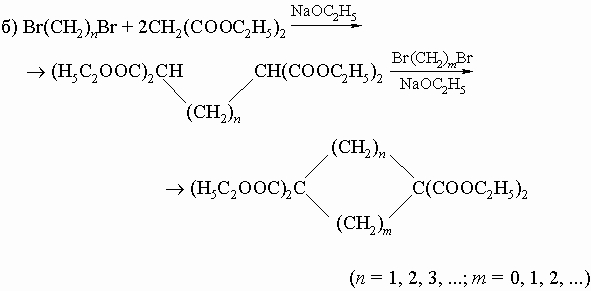
3) Конденсация эфиров двухосновных кислот (реакция Дикмана):
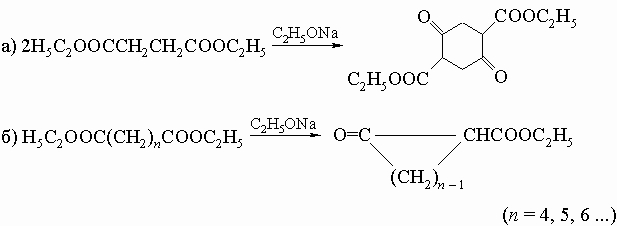
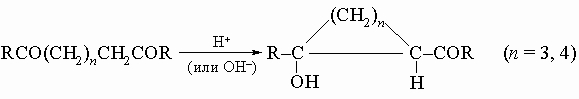
В развитие метода получения кетонов с большими циклами разработан метод внутримолекулярной ацилоиновой конденсации путем кипячения эфиров дикарбоновых кислот с металлическим натрием; образующиеся оксикетоны могут быть легко превращены в циклические кетоны. 4) Внутримолекулярная альдольная конденсация некоторых дикетонов:
5) Сухая перегонка кальциевых, бариевых или ториевых солей адипиновой кислоты (n = 4) и ее высших гомологов:
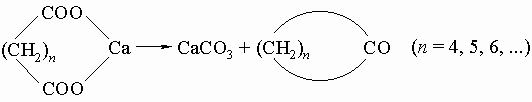
6) (2 + 2)-циклоприсоединением получают 4-членные циклы:
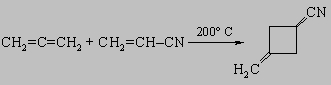
7) Диеновый синтез используется для получения 6-членных циклов:
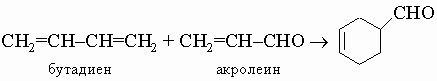
Существует еще много других методов синтеза алициклических соединений, среди них гидрирование производных бензола, внутримолекулярная конденсация g- и d-дикетонов, полимеризация ацетилена в особых условиях с образованием 8- и 10-членных циклов, прямая циклизация насыщенных углеводородов и т.д. Кроме того, возможны превращения циклов друг в друга, при этом может происходить расширение или сужение цикла.
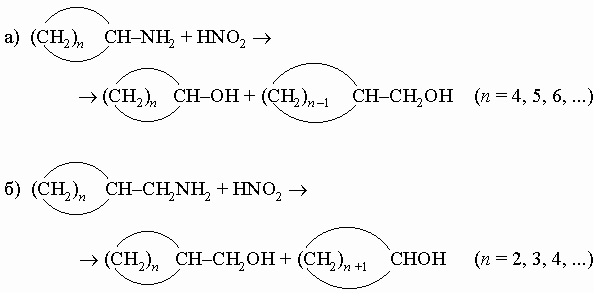
2. Расширение и сужение цикла. Методы расширения и сужения цикла главным образом основаны на способности циклических систем претерпевать молекулярные перегруппировки. В связи с этим особенно широко используется перегруппировка Вагнера - Мейервейна и родственные перегруппировки (RX + Y (r) RўY + X), сопровождающие многие реакции замещения в алифатическом ряду, в которых в качестве промежуточных частиц возникают неустойчивые ионы R+. Ниже следуют примеры: 1) Диазотирование циклических аминов (реакция Демьянова):
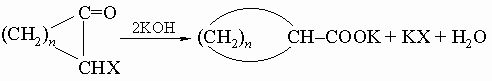
2) Действие щелочи на 2-галогеноциклоалканоны (перегруппировка Фаворского):
3) Пинаколиновая перегруппировка циклических гликолей:
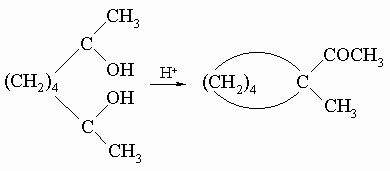
4) Многие циклопарафины можно мягко и обратимо изомеризовать над хлоридом алюминия, например:
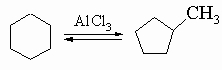
3. Стереоизомерия (см. разд. II.Б, "Оптическая изомерия") алициклических соединений включает как геометрическую (цис-транс), так и оптическую изомерию. Явление геометрической изомерии возникает всякий раз, когда два или более заместителей присоединены к кольцу, поскольку атомы углерода кольца не могут свободно вращаться один относительно другого. Когда изомер не может быть совмещен со своим зеркальным изображением, имеет место оптическая изомерия, т.е. его можно разделить на право- и левовращающую формы. Если же изомер обладает плоскостью симметрии, он не может быть разделен на энантиомеры. Когда алициклическое кольцо несет различные заместители на каждом из n углеродных атомов, возможно 2n - 1 геометрических изомеров. Любой из этих изомеров, если он асимметричен, может быть разделен на право- и левовращающую формы. Когда два или более заместителей одинаковы, вследствие симметрии достаточно часто число изомеров оказывается меньше теоретического максимума. Так, инозит (CHOH)6 (см. разд. IV-2.А.6) имеет только 8 изомеров, и лишь один из них можно разделить на правую и левую формы. Проблема стереоизомерии алициклических соединений играет решающую роль при определении структуры физиологически активных природных соединений и в их синтезе. Часто только один изомер из сотен теоретически возможных имеет заметную физиологическую активность.
4. Реакции. Между реакциями алифатических и алициклических соединений наблюдается существенное сходство. Те реакции, которые требуют подхода внешнего реагента (например, реакции присоединения по карбонилу, реакции замещения), часто протекают быстрее с алициклическими, чем с алифатическими соединениями, содержащими то же число углеродных атомов. Эта ситуация возникает в результате жесткости кольца, ограничивающей стерические препятствия, обусловленные неупорядоченным движением заместителей, присоединенных к атакуемому атому углерода. В то же время, внутримолекулярные реакции могут ускоряться или затрудняться благоприятным или неблагоприятным расположением реагирующих групп. Так, цис-дикарбоновые кислоты, как правило, легко образуют ангидриды, тогда как у транс-изомеров это превращение обычно затруднено или просто невозможно. Цис-гидроксикислоты легко образуют лактоны, а транс-изомеры - нет. Отщепление элементов галогеноводорода под действием сильных оснований с образованием олефина требует транс-расположения отщепляющихся H и X. Соответственно водород в транс-положении к соседнему галогену достаточно лабилен, а в цис-положении необычайно стабилен. Из-за сходства алициклических и алифатических соединений детальное обсуждение отдельных алициклов будет опущено. Особую группу реакций составляют реакции разрыва колец (раскрытия цикла): 1) гидрогенолиз:
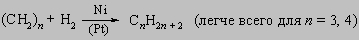
2) окисление циклоолефинов:
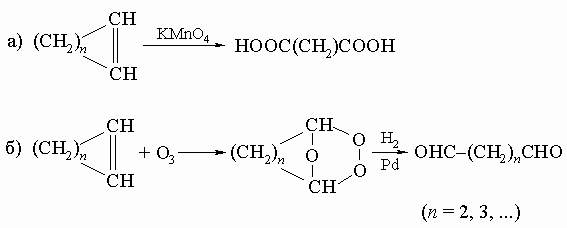
3) окислительное расщепление циклических гликолей под действием HIO4 (см. разд. IV-1.Б.1):
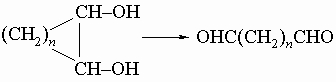
4) окисление циклических кетонов азотной кислотой (см. разд. IV-1.Б.6, "Адипиновая кислота"); 5) бекмановская перегруппировка циклических кетоксимов:
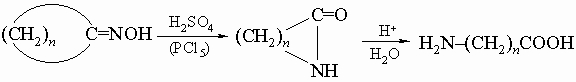
Ниже рассмотрены примеры наиболее важных природных соединений циклопентанового и циклогексанового рядов.
5. Природные производные циклопентана. Некоторые природные душистые вещества, например жасмон из масла жасмина, содержат циклопентановую структуру
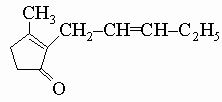
Из кислот ряда циклопентана хаульмугровая кислота
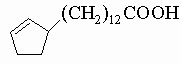
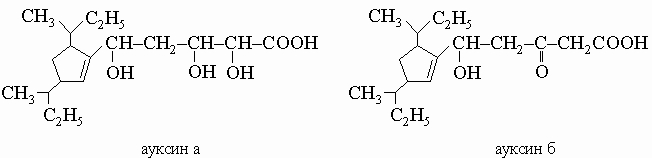
из масла хаульмугровой пальмы применяется для лечения проказы. Ауксины а и б, факторы роста растений, являются ненасыщенными гидроксикислотами, производными циклопентана:
6. Природные производные циклогексана. Терпены, являющиеся производными циклогексана, достаточно часто встречаются в природе, особенно в эфирных маслах. Наиболее обычны моноциклические терпены со скелетом ментана:
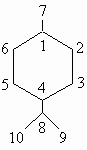
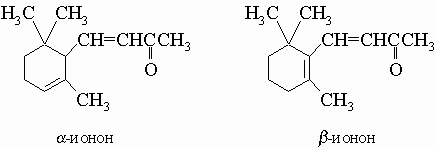
Ментадиены C10H16 можно рассматривать как продукты конденсации двух молекул изопрена CH2=C(CH3)-CH=CH2. Для них возможны многочисленные изомеры, существование которых обусловлено различным расположением двойных связей (D) и оптической изомерией. Типичным примером является лимонен (D1,8), который встречается в виде D-формы в маслах апельсина и тмина, в виде L-формы в сосновом и еловом масле и в рацемической форме (дипентен) в скипидаре. Из ментенов C10H18 наиболее важен D3-ментен (из масла тмина), который может быть получен дегидратацией ментола (см. ниже). Многие спирты, например ментол (ментанол-3 из масла перечной мяты) и a-терпинеол (D1-ментенол-8 из масел кардамона и майорана), являются производными этих углеводородов. Двухатомные спирты этого ряда известны под названием терпины. Из них наибольший интерес представляет терпингидрат (ментандиол-1,8), который образуется во многих эфирных маслах при стоянии. Среди кетонов этого ряда заслуживают упоминания изомеры ментона-3 и пулегона (D4(8)-ментенона-3), которые содержатся в мятном масле, и карвон (D1,8-ментадиенон-6), найденный в маслах тмина и укропа. Терпены представляют собой летучие приятно пахнущие жидкости; их применяют как отдушки и в производстве духов. Для парфюмерной промышленности большое значение имеют два родственных терпенам кетона, а именно a- и b-иононы. Они обладают запахом фиалок. Их смесь получают синтетически альдольной конденсацией ацетона с цитралем (CH3)2C=CH-(CH2)2-C(CH3)=CH-CH=O.
Полигидроксипроизводные циклогексана. Некоторые природные полигидроксициклогексаны в химическом отношении занимают среднее положение между сахарами и таннинами (см. разд. IV-3.А.2, "Ароматические кислоты"). Выше уже упоминался гексаатомный спирт инозит. Одна из неактивных форм, называемая мезо-инозитом, широко распространена в растительных и животных тканях. Метиловые эфиры D- и L-форм находятся соответственно в Pinus lambertiana и в коре квебрахо. Кверцит (циклогексанпентол) встречается в правовращающей форме в желудях. Хининовые алкалоиды находятся в хинной корке в соединении с хинной (1,3,4,5-тетрагидроксициклогексанкарбоновой) кислотой. Эта кислота при дегидратации дает шикимовую кислоту (3,4,5-D1-тригидроксициклогексенкарбоновую кислоту), которая найдена в плодах японского звездчатого аниса (бадьяна).
7. Макроциклические системы. Алициклические соединения с большими, чем циклогексан, кольцами встречаются редко и имеют относительно небольшое значение. Исключениями являются очень большие кольца пахучих начал циветты и мускуса, например:
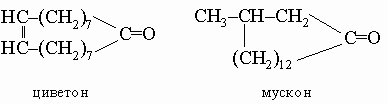
Б. БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
1. Бициклические терпены. Наиболее часто встречаются бициклические терпены, которые можно рассматривать как производные следующих четырех углеводородов:
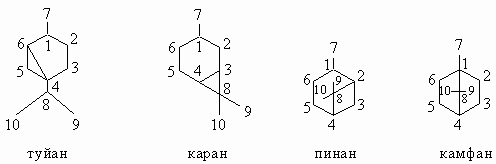
Можно заметить, что туйановая система включает метиленовый мостик. В пинане, каране и камфане имеется изопропилиденовый мостик
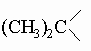
.
Циклопропановые кольца в производных карана и туйана и циклобутановое кольцо в производных пинана легко расщепляются сильными кислотами. Из группы туйана наиболее широко распространен в различных эфирных маслах (например, в цейлонском кардамоне и майоране) сабинен (D1(7)-туйен). Известны также два изомерных туйона (туйанона-2). Карен (D1(6)-карен) содержится в индийском скипидаре (из сосны длиннохвойной Pinus longifolia); карон (каранон-2) получен синтетически действием щелочи на 8-бромментанон-2 (дигидрокарвонгидробромид). a-Пинен (D1(6)) и b-пинен (D1(7)) являются главными компонентами скипидара. a-Пинен легко окисляется кислородом воздуха с раскрытием циклобутанового кольца. Разбавленные неорганические кислоты превращают его в терпин (см. разд. IV-2.А.6). Присоединение хлороводорода дает неустойчивый пиненгидрохлорид (1-хлорпинан), который быстро изомеризуется в борнилхлорид (2-хлоркамфан); эта реакция играет ключевую роль в синтезе камфоры. Наиболее важным членом группы камфана является камфора (камфанон-2). Она находится в японском камфарном масле в виде правовращающей формы. Рацемическую форму получают из борнилхлорида обработкой последнего щелочью. Образующийся при этом камфен при гидратации и окислении дает камфору.
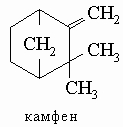
Камфора широко используется в производстве нитроцеллюлозы, целлулоида, бездымного пороха и в медицине. Восстановление камфоры или гидратация камфена дают смесь стереоизомерных спиртов - камфанолов-2 - борнеола и изоборнеола, каждый из которых можно разделить на D- и L-формы. Обе формы борнеола встречаются в природе, например, в Dryobalanops camphora и розмариновом, пихтовом и других маслах.
Декалин и сесквитерпены. Декалиновая (декагидронафталиновая) система колец также встречается в природных соединениях, в основном в сесквитерпенах, которые содержат 15 атомов углерода (тримеры изопрена).
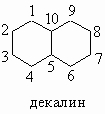
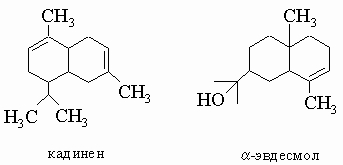
Декалин может существовать в цис- и транс-формах, так как второе кольцо может быть присоединено к первому двумя различными путями, каждый из которых ведет к ненапряженному и неплоскому изомеру. Бициклические сесквитерпены являются диметилизопропилдекалинами с двумя двойными связями. Как и терпены, они построены из изопреновых единиц C5H8. Примером служит кадинен. Кадинен и a-эвдесмол из эвкалиптового масла имеют следующую структуру:
В. ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
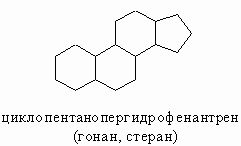
Наиболее важными полициклическими соединениями являются стероиды, в основе структуры которых лежит скелет циклопентанопергидрофенантрена. Стероиды входят в состав растительных и животных организмов. К стероидам относятся стерины (например, холестерин), желчные кислоты (например, холевая кислота), половые гормоны (например, эстрон, прогестерон, тестостерон), гормоны коры надпочечников (например, кортикостерон, кортизон), сердечные гликозиды (например, дигитоксин). Трициклические системы встречаются у сесквитерпенов (например, санталена) и дитерпенов (например, абиетиновой кислоты).