БАТАРЕЯ (в артиллерии) - БАТАРЕ́Я (франц. batterie, от battre - бить), огневое и тактическое подразделение артиллерийского дивизиона (полка); может быть отдельной. Состоит из 2-3 огневых взводов, взвода (отделения) управления. Имеет 2-8 орудий (минометов, боевых машин реактивной артиллерии или противотанковых управляемых ракет).
батарея (в технике)
батарея 1
батарея 2
батарея де реверс
батарея крошет
батарея электропитания
Энциклопедия Кольера
БАТАРЕЯ ЭЛЕКТРОПИТАНИЯ - автономный источник постоянного тока, не связанный с машинным электрогенератором. Представляет собой преобразователь энергии в виде одного или нескольких элементов питания, не имеющий движущихся частей. Батареи электропитания преобразуют в электричество химическую, солнечную или ядерную энергию. Батарея электропитания - удобный переносный источник электроэнергии. Поэтому круг ее возможных применений практически не ограничен. Батареи электропитания используются в качестве источников питания для электросхем в автомобилях, двигателей электрокаров и электропогрузчиков. Они служат источниками питания для контрольно-измерительной аппаратуры, телеметрических и других систем искусственных спутников Земли, межпланетных космических станций, многоразовых воздушно-космических аппаратов. В своей повседневной жизни мы пользуемся батареями электропитания в аудио- и видеоаппаратуре, такой, как портативные радиоприемники и телевизоры, в электродрелях и электропилах, фотоаппаратах и кинокамерах, электробритвах, игрушках, слуховых аппаратах, электронных часах, калькуляторах и другом оборудовании. Основные характеристики батареи электропитания - электродвижущая сила (ЭДС), предельная сила тока и емкость в ампер-часах. ЭДС одного элемента батареи составляет ок. 1,5 В. Чтобы получить более высокое напряжение (до нескольких сот вольт), нужное число элементов соединяют последовательно. Емкость батареи электропитания в ампер-часах равна произведению предельного тока на продолжительность разрядки. Например, если батарея может давать ток силой 3 А в течение 20 ч, то ее емкость равна 60 АЧч.
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА
Химические источники тока (электрохимические генераторы, ЭХГ) преобразуют энергию химической реакции в электрическую. Реакция протекает с потреблением активных материалов внутри элемента. Когда такие материалы расходуются полностью, ЭХГ теряет способность давать электрический ток. Химические источники тока делятся на первичные и вторичные. Первичные источники не перезаряжаются, т.е. израсходованные активные материалы в них не могут быть регенерированы или заменены, и батарею электропитания приходится выбрасывать. Вторичная (аккумуляторная) батарея может быть перезаряжена. Израсходованные активные материалы в ней могут быть регенерированы, и такая батарея электропитания допускает многократное повторное использование. Топливный элемент (см. ниже) теоретически имеет неограниченный срок службы, поскольку в нем пополняется израсходованный активный материал (топливо), а продукты реакции выводятся. До Второй мировой войны первичные ЭХГ использовались обычно в тех случаях, когда требовались источники тока малой мощности, а вторичные - при большой потребляемой мощности. В настоящее время в распоряжении конструктора переносного электрооборудования имеется широкий спектр первичных и вторичных источников тока.
См. также
ТОПЛИВНЫЙ ЭЛЕМЕНТ. Во всяком ЭХГ имеются два электрода (положительный и отрицательный) и химическое вещество, называемое электролитом, в которое погружены эти электроды. В ЭХГ с наливными элементами используется жидкий электролит, а в т. н. сухих ЭХГ - пастообразный. В ЭХГ обоих типов должно быть достаточно жидкости для протекания химической реакции.
ПЕРВИЧНЫЕ ЭХГ
Стаканчиковые элементы. Стаканчиковые элементы, название которых говорит об их конструкции, применяются главным образом в карманных фонарях и радиоприемниках.
Сухой элемент Лекланше. Большинство первичных ЭХГ, выпускаемых в настоящее время промышленностью, относятся к сухим батареям электропитания. Около 25% сухих батарей выполнены на основе марганцово-цинкового элемента Лекланше - одного из первых наливных элементов. В сухом элементе Лекланше имеется графитовый положительный электрод, окруженный электролитом в виде смеси диоксида марганца, графитового порошка, хлорида аммония, хлорида цинка и воды. Эта смесь служит также деполяризующим агентом, предотвращающим образование газообразного водорода внутри элемента. Если не предотвратить образование водорода, то под давлением газа батарейка раздувается, в результате чего нарушается ее герметичность и из нее вытекает электролит. Электролит и графитовый электрод находятся в тонкостенном цинковом стаканчике, который, выполняя функции защитного корпуса, служит также отрицательным электродом батарейки.
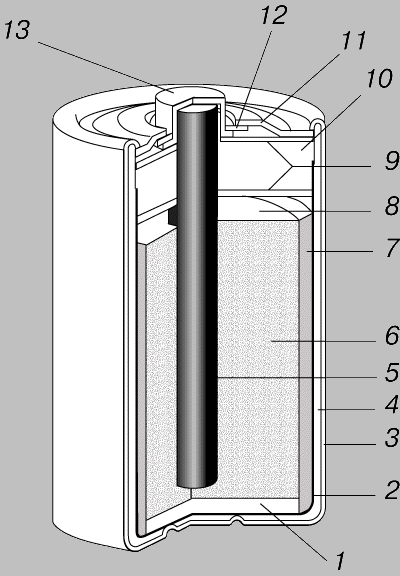
ГРАФИТОВО-ЦИНКОВЫЙ СУХОЙ ЭЛЕМЕНТ с графитовым положительным электродом, пастообразным электролитом и деполяризующей смесью в цинковом стаканчике, который служит отрицательным электродом. 1 - изолирующая прокладка; 2 - бесшовный цинковый стаканчик (отрицательный электрод); 3 - изолированная металлическая оболочка; 4 - пористый разделительный стаканчик; 5 - графитовый стержень (положительный электрод); 6 - деполяризующая смесь; 7 - пастообразный электролит; 8 - пространство для расширения; 9 - запрессованные прокладки; 10 - полимерный герметик; 11 - металлическая крышка; 12 - изолирующая прокладка; 13 - металлический колпачок.
В элементе Лекланше электричество вырабатывается за счет химического взаимодействия электролита с цинковым электродом. При подключении к зажимам батарейки внешней нагрузки, скажем лампочки карманного фонарика, через лампочку начинает проходить ток от цинкового электрода к графитовому. Ток не прекращается, пока не растворится почти весь цинк. После этого батарейка теряет работоспособность, и ее необходимо заменить.
Щелочной марганцово-цинковый сухой элемент. Щелочной марганцово-цинковый сухой элемент отличается от сухого элемента Лекланше главным образом тем, что в нем в качестве электролита используется высокоактивная щелочь КОН (гидроксид калия, едкое кали). В щелочном элементе примерно вдвое больше активных веществ, чем в элементе Лекланше, и он очень подходит для многих устройств со сравнительно большой потребляемой мощностью, таких, как лампы-вспышки фотоаппаратов, вращательные электроприводы и мощные стереофонические звуковые системы. Щелочные элементы применяются примерно в 50% бытовой электронной аппаратуры.
Цинкхлоридный сухой элемент. Цинкхлоридные батарейки в настоящее время примерно на 25% удовлетворяют потребность в источниках тока для жестких и сверхжестких условий эксплуатации. Они имеют такие же характеристики, как и у элементов Лекланше, но их емкость на БАТАРЕЯ ЭЛЕКТРОПИТАНИЯ40% больше. Кроме того, вероятность протечки в них намного меньше. По рабочим характеристикам и стоимости цинкхлоридные батарейки мало отличаются от щелочных и очень хорошо подходят для ламп-вспышек и радиоприемников.
Кнопочные батарейки. В связи с большим спросом на миниатюрные источники тока были разработаны кнопочные (таблеточные) ЭХГ. Диаметр такой батарейки составляет 6-25 мм, толщина - от 1,5 до 12 мм. Срок службы кнопочных батареек нередко больше, чем у обычных стаканчиковых.
Многоэлементные ЭХГ. И стаканчиковые, и кнопочные элементы используются в многоэлементных ЭХГ. Такие батареи электропитания обычно имеют квадратную или прямоугольную форму в плане. Из плоских "галетных" элементов легко составляются пакеты. В многоэлементных сухих ЭХГ чаще всего применяются первичные элементы Лекланше, цинкхлоридные и щелочные первичные элементы.
ВТОРИЧНЫЕ ЭХГ
Вторичные ЭХГ (электрические аккумуляторы) перезаряжаются пропусканием постоянного тока в направлении, противоположном направлению тока в режиме разрядки. При этом активные соединения в элементе восстанавливаются в результате обратной химической реакции.
Свинцовый аккумулятор. Свинцовый аккумулятор - самый распространенный в настоящее время. Его положительным электродом служит свинцовая решетка с ячейками, заполненными пастообразным пероксидом (перекисью) свинца PbO2. Отрицательный электрод, той же формы, несколько тоньше, а его ячейки заполнены пастой из губчатого свинца. Каждый элемент содержит много таких пластин обоих видов. Группы чередующихся электродных пластин разделены изолирующими перегородками из дерева, стекла, пластмассы или резины. Вся сборка, погруженная в электролит (разбавленный раствор серной кислоты), представляет собой один гальванический элемент. Из нескольких элементов, соединенных последовательно, составляется батарея. ЭДС одного элемента равна 2 В. Состояние свинцового аккумулятора оценивается путем измерения относительной плотности электролита. Непосредственно после зарядки она составляет примерно 1,26, а по мере разрядки понижается почти до 1,0 (это объясняется тем, что серная кислота образует химическое соединение с материалом пластин, давая в остатке воду).
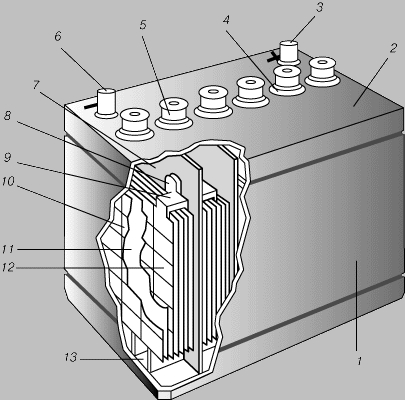
БАТАРЕЯ СВИНЦОВЫХ АККУМУЛЯТОРОВ автомобильного типа с положительным электродом из пероксида свинца, отрицательным - из металлического свинца и электролитом из разбавленной серной кислоты в эбонитовом корпусе. 1 - эбонитовый корпус; 2 - цельная крышка корпуса; 3 -положительный зажим; 4 - указатель уровня электролита; 5 - вентиляционно-заливная пробка; 6 - отрицательный зажим; 7 - перегородка; 8 - соединитель; 9 - скрепляющая скоба; 10 - отрицательная пластина; 11 - разделительная прокладка; 12 - положительная пластина; 13 - отстойная камера.
Свинцовая батарея недорога, имеет довольно большую ЭДС и хорошо сохраняет заряд. Она способна без повреждения давать кратковременно большой ток и очень хорошо подходит для пуска автомобильных двигателей. Ее можно сотни раз перезаряжать без ухудшения рабочих характеристик. Однако она приходит в негодность, если ее надолго оставляют разряженной.
Железо-никелевый аккумулятор. Положительным электродом такого аккумулятора, предложенного Т.Эдисоном, служит оксид никеля, отрицательным - железо, электролитом - гидроксид калия. В процессе разрядки оксид никеля превращается в никель, железо - в оксид железа, а электролит не меняется. Такой аккумулятор легче свинцового и не повреждается при хранении в разряженном состоянии. Его ЭДС меньше, чем у свинцового, и несколько понижается в ходе разрядки, в среднем составляя ок. 1,2 В. С учетом своего большого срока службы и сравнительно низких потерь он применяется главным образом в промышленном оборудовании. Никель-кадмиевый аккумулятор. Никель-кадмиевый аккумулятор допускает многократную перезарядку, сохраняет почти постоянной ЭДС в процессе разрядки и более неприхотлив, чем все другие аккумуляторы. Он хорошо работает при пониженных температурах и может быть герметизирован. Последнее означает, что его можно переворачивать вверх дном, не боясь пролить электролит; он не требует периодического добавления воды. Такие аккумуляторы обладают достоинством многократной перезарядки. В заряженном состоянии положительным электродом служит пероксид никеля, отрицательным - металлический кадмий. Электролит - гидроксид калия. Средняя ЭДС аккумулятора ок. 1,2 В. Никель-кадмиевые аккумуляторы широко применяются в малых переносных бытовых электроприборах в тех случаях, когда желательна возможность перезарядки. В качестве автомобильных они слишком дороги.
Другие перезаряжаемые ЭХГ. Здесь мы скажем несколько слов о высокотемпературных аккумуляторах, полимерных аккумуляторах и топливных элементах. Высокотемпературные аккумуляторы работают при 300-400° C; в качестве отрицательного электрода в них обычно используется металлический натрий или литий, в качестве положительного - сера, хлор или сульфид железа. Они отличаются высокой плотностью мощности и энергии (в 2-4 раза больше, чем в свинцовых аккумуляторах) и, в перспективе, низкой стоимостью. Их широкому применению препятствуют значительное тепловыделение и коррозия.
Полимерные аккумуляторы. В качестве возможного материала для электродов аккумуляторов исследуются такие недорогие и легкие электропроводящие полимеры, как полиацетилен и полианилин. Перезаряжаемые БЭ с проводящими пластмассовыми электродами в соответствующем электролите смогут, по-видимому, успешно конкурировать как со свинцовыми, так и с никель-кадмиевыми аккумуляторами.
Топливные элементы. Топливные элементы отличаются от других ЭХГ в двух важных отношениях. Во-первых, они могут работать в непрерывном режиме без простоев для перезарядки, так как их активный материал подводится из внешнего источника. Во-вторых, их электролит в процессе работы не изменяется. Топливные элементы в принципе более экономичны и дешевы, чем другие ЭХГ, так как их активный материал представляет собой обычное топливо, а не металл особой очистки. Их теоретический КПД близок к 100%. Топливные элементы ожидает ряд применений, в которых важны их малые размеры и высокая экономичность. Они могут использоваться как автономные источники тока для автомобилей и катеров, электрогенераторы для индивидуальных домашних хозяйств, переносные силовые блоки для инструментов и другого оборудования. В топливных элементах одного из наиболее перспективных типов в качестве топлива используется газообразный водород, в качестве окислителя - кислород, а электролитом служит гидроксид калия. Водород и кислород вводятся в элемент через пористые трубчатые электроды и вступают в реакцию окисления, образуя воду. С электродов снимается возникающее при этом напряжение. Исследуются возможности работы топливных элементов на еще более дешевых энергоносителях, таких, как бензин и природный газ.
См. также ТОПЛИВНЫЙ ЭЛЕМЕНТ.
СОЛНЕЧНЫЕ БАТАРЕИ
Солнечные (фотоэлектрические) батареи преобразуют солнечную энергию в электрическую. По своему принципу действия они, в общем, аналогичны транзистору. Обычно их изготавливают из полупроводникового кремния, легированного небольшими добавками таких примесей, как мышьяк и бор. Типичные размеры солнечных элементов 20ґ10ґ0,4 мм. Солнечный элементарный источник тока можно представить в виде двух сложенных тонких листков, соединенных между собой так, что образуется p-n-переход. В одном листке примесными являются атомы бора, в другом - мышьяка. При освещении элемента между двумя слоями кремния, как между электродами обычной батареи электропитания, возникает ЭДС. Но в кремниевой солнечной батарее ЭДС существует, пока на нее падает солнечный свет. Когда она вырабатывает электрический ток, в ней не происходит никаких химических превращений. Поэтому ее срок службы не ограничен. Некоторые солнечные батареи преобразуют в электроэнергию ок. 1/7 энергии солнечного света.
См. также ТРАНЗИСТОР.
ЯДЕРНЫЕ ИСТОЧНИКИ ТОКА
В ядерном реакторе атомной электростанции за счет энергии ядерного топлива выделяется тепло, которое используется для получения пара, приводящего в действие электрогенератор. Ядерный же источник тока преобразует ядерную энергию непосредственно в электрическую. Ядерная батарея электропитания состоит из радиоактивного источника, испускающего электроны с большой кинетической энергией, коллектора, собирающего эти электроны, и изолятора, сквозь который электроны проходят на пути к коллектору. Зажимы, предусмотренные на коллекторе и радиоактивном источнике, служат внешними выводами батареи. Накапливаясь на коллекторном электроде, отрицательно заряженные электроны заряжают и его. Поскольку электроны уходят с электрода радиоактивного источника, на нем остается положительный заряд. В результате между двумя электродами возникает ЭДС. Если к двум зажимам присоединить провод, то по нему пойдет ток от коллектора к радиоактивному источнику, так же, как и в случае ЭХГ. Ядерные батареи электропитания отличаются очень большими ЭДС, которые можно понижать при помощи электросхем деления напряжения. Такие генераторы тока применяются на искусственных спутниках Земли и межпланетных станциях, а также в труднодоступных точках на Земле для питания научной аппаратуры, длительное время работающей автоматически.
ЛИТЕРАТУРА
Коровин Н.В. Электрохимические генераторы. М., 1974 Лидоренко Н.С., Мучник Г.Ф. Электрохимические генераторы. М., 1982 Кромптон Г. Вторичные источники тока. М., 1985 Кромптон Г. Первичные источники тока. М., 1986