КСЕНО́Н -а; м. [от греч. xenos - чужой]. Химический элемент (Хе), один из инертных газов (применяется в электротехнике и медицине).
◁ Ксено́новый, -ая, -ое. К-ая лампа. К-ая трубка.
* * *
ксено́н (лат. Xenon), химический элемент VIII группы периодической системы, относится к благородным газам. Название от греческого xénos - чужой (открыт как примесь к криптону). Плотность 5,851 г/л, tкип -108,1ºC. Первый благородный газ, для которого получены химические соединения (например, XePtF6). Ксеноновая лампа применяется в прожекторах, кинопроекторах. Фториды XeF2, XeF4 - мощные окислители и фторирующие агенты.
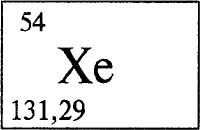
* * *
КСЕНОН - КСЕНО́Н (лат. Xenon, от греческого xenos - чужой), Хе (читается «ксенон»), химический элемент с атомным номером 54, атомная масса 131,29. Инертный, или благородный, газ. Расположен в группе VIIIA в 5 периоде периодической системы.
Природный атмосферный ксенон состоит из девяти изотопов: 124 Хе (0,096%), 126 Хе (0,090%), 128 Хе (1,92%), 129 Хе (26,44%), 130 Хе (4,08), 131 Хе (21,18%), 132 Хе (26,89%), 134 Хе (10,44%) и 136 Хе (8,87%).
Радиус атома 0,218 нм. Электронная конфигурация внешнего слоя 5s2p6 . Энергии последовательной ионизации - 12,130, 21,25, 32,1 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 2,6.
История открытия
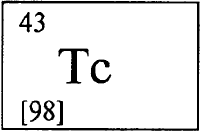
Открыт английскими учеными У. Рамзаем (см. РАМЗАЙ Уильям) и М. Траверсом (см. ТРАВЕРС Моррис Уильям) в 1898 методом спектрального анализа как примесь к криптону (см. КРИПТОН). В 1962 в Канаде Н. Бартлетт (см. БАРТЛЕТТ Нил) получил первое устойчивое при комнатной температуре химическое соединение ксенона XePtF 6.
Нахождение в природе
Ксенон - редчайший газ земной атмосферы, содержание в воздухе 8,6·10-5% по объему. Общие запасы ксенона в атмосфере 1,6·1011м3.
Получение
Ксенон выделяют как побочный продукт при переработке воздуха на азот и кислород.
Физические и химические свойства
Ксенон - одноатомный газ без цвета и запаха. Температура кипения -108,12 °C, плавления -11,85 °C. Критическая температура 16,52 °C, критическое давление 5,84 МПа. Плотность 5,85 кг/м3.
В 100 мл воды при 20 °C растворяется 9,7 мл Xe.
Ксенон образует клатраты (см. КЛАТРАТЫ) с водой и многими органическими веществами: Хе·5,75Н2О, 4Хе·3С6Н5ОН и другие. В клатратах атомы-гости Xe занимают полости в кристаллических решетках веществ-хозяев.
Непосредственно Xe взаимодействует только со фтором, образуя XeF2, XeF4 и XeF6. Дифторид ксенона XeF2 имеет тетрагональную решетку, температуру плавления 129 °C, плотность 4,32 г/см3. Решетка тетрафторида XeF4 моноклинная, температура плавления 117,1 °C, плотность 4,0 г/см3. Решетка гексафторида XeF6 моноклинная, температура плавления 49,5 °C, плотность 3,41 г/см3.
Гидролизом XeF4 и XeF6 получают неустойчивые оксифториды XeОF4, XeО2F2, XeОF2, XeО3F2 и XeО2F4 и оксиды ХеО3 и ХеО4, которые при комнатной температуре они разлагаются на простые вещества.
Фториды ксенона взаимодействуют с водными растворами щелочей, образуя ксенаты МНХеО4 (М = Na, K, Rb, Cs), устойчивые до 180 °C. При гидролизе растворов XeF6, диспропорционировании XeО3 в щелочных растворах и при озонировании водных растворов XeО3 получены перксенаты Na4XeO6 и (NH4)4XeO6.
Применение
Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света.
Радиоактивные изотопы применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках. Фториды ксенона используют для пассивации металлов.
Физиологическое действие
Газ ксенон безвреден. Фториды ксенона ядовиты, ПДК в воздухе 0,05 мг/м3.