Для ароматических соединений характерна ароматичность, т.е. совокупность структурных, энергетических свойств и особенностей реакционной способности циклических структур с системой сопряженных связей. В более узком смысле этот термин относится только к бензоидным соединениями (аренам), в основе структуры которых лежит бензольное кольцо, одно или несколько, в том числе конденсированных, т.е. имеющих два общих атома углерода.
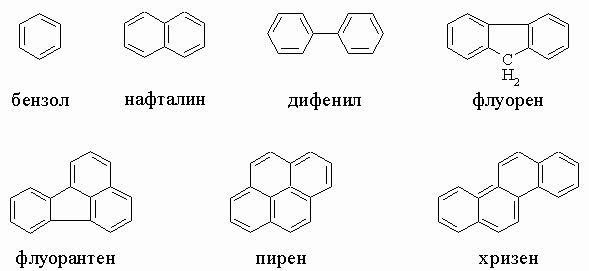
Главные ароматические углеводороды каменноугольной смолы. Ароматические углеводороды, содержащиеся в каменноугольной смоле, имеют одно или несколько шестичленных колец, которые обычно изображают в структурных формулах с тремя чередующимися двойными связями, - это бензол (т. кип. 80° С), нафталин (т. кип. 218° С, т. пл. 80° С), дифенил (т. кип. 259° С, т. пл. 69° С), флуорен (т. кип. 295° С, т. пл. 114° С), фенантрен (т. кип. 340° С, т. пл. 101° С), антрацен (т. кип. 354° С, т. пл. 216° С), флуорантен (т. пл. 110° С), пирен (т. пл. 151° С), хризен (т. пл. 255° С) (см. также формулы в табл. 4, разд. III).
Резонанс в ароматических системах. На первый взгляд может показаться, что это сильно ненасыщенные соединения, однако двойные связи в них всех, за исключением 9,10-двойной связи фенантрена, исключительно инертны. Это отсутствие реакционной способности или ненормально низкий характер двоесвязности приписывают "резонансу". Резонанс подразумевает, что гипотетические двойные связи не локализованы в специфических или формальных связях. Они делокализованы по всем кольцевым атомам углерода, и невозможно точно изобразить электронную структуру таких молекул единственной формулой обычного типа. Везде, где возможно написать для молекулы две (или больше) структуры, которые обладают равной или приблизительно равной энергией и которые отличаются только положениями, приписываемыми электронам, обнаруживается, что реальная молекула более стабильна, чем должна была бы быть любая из структур, и обладает свойствами, промежуточными между ними. Приобретенная таким образом дополнительная стабильность называется энергией резонанса. Этот принцип следует из квантовой механики и отражает невозможность точного описания многих из таких микроскопических систем, как атомы и молекулы, простыми схемами. На основании следующих доказательств можно утверждать, что бензол C6H6 является плоским шестичленным кольцом, содержащим три чередующиеся с простыми двойные связи: гидрирование в жестких условиях превращает его в циклогексан C6H12; озонолиз дает глиоксаль OHC-CHO; дипольные моменты дихлорпроизводных C6H4Cl2 могут быть точно рассчитаны из дипольного момента монохлорбензола, если предположить, что кольцо является плоским правильным шестиугольником. Такой молекуле можно приписать структуру
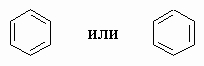
Обе эти кекулевские структуры (по имени предложившего их Ф.Кекуле) одинаковы по энергии и делают одинаковый вклад в истинную структуру. Ее можно изобразить как

,
приписывая полудвоесвязный характер каждой углерод-углеродной связи. Тщательный анализ, проведенный Л.Полингом, показал, что небольшой вклад вносят также дьюаровские структуры:
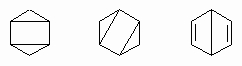
Было найдено, что энергия резонанса системы составляет 39 ккал/моль, и, следовательно, бензольная двойная связь стабильнее, чем олефиновая. Поэтому любая реакция, состоящая в присоединении к одной из двойных связей и ведущая к структуре
,
потребовала бы преодоления высокого энергетического барьера, поскольку две двойные связи в циклогексадиене
стабилизированы энергией резонанса всего лишь 5 ккал/моль. Для нафталина можно написать три структуры:
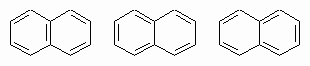
Поскольку все они имеют приблизительно одинаковую энергию, истинная структура является средним арифметическим всех трех и может быть написана как
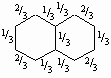
причем дроби указывают степень двоесвязности каждой углерод-углеродной связи. Энергия резонанса составляет 71 ккал/моль. В общем, для бензола пишется только одна кекулевская структура, а первая из написанных выше структур используется для изображения нафталина. Сходным образом изображается структура антрацена (см. табл. 4 в разд. III).
А. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ БЕНЗОЛЬНОГО РЯДА
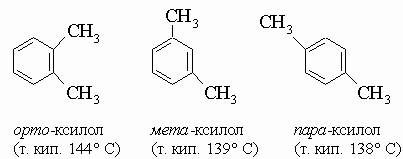
1. Углеводороды бензольного ряда. Бензол и его гомологи имеют общую формулу CnH2n - 6. Гомологи состоят из бензольного кольца и одной или нескольких алифатических боковых цепей, присоединенных к его углеродным атомам вместо водорода. Простейший из гомологов - толуол C6H5CH3 - содержится в каменноугольной смоле и имеет существенное значение как исходное соединение для получения взрывчатого вещества тринитротолуола (см. разд. IV-3.А.2 "Нитросоединения") и капролактама. Следующая формула в ряду, C8H10, отвечает четырем соединениям: этилбензолу C6H5C2H5 и ксилолам C6H4(CH3)2. (Высшие гомологи представляют меньший интерес.) Когда к кольцу присоединены два заместителя, возникает возможность изомерии положения; так, существуют три изомерных ксилола: Другие важные бензольные углеводороды включают ненасыщенный углеводород стирол C6H5CH=CH2, используемый в производстве полимеров; стильбен C6H5CH=CHC6H5; дифенилметан (C6H5)2CH2; трифенилметан (C6H5)3CH; дифенил C6H5-C6H5.
Получение. Бензольные углеводороды получают следующими методами: 1) дегидрогенизация и циклизация парафинов, например:
2) синтез Вюрца - Фиттига:
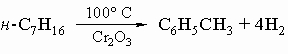
3) реакция Фриделя - Крафтса с алкилгалогенидами или олефинами:
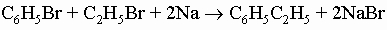
4) синтез кетонов по Фриделю - Крафтсу с последующим восстановлением по Клемменсену (обработка амальгамой цинка и кислотой), которое превращает карбонильную группу в метиленовое звено:
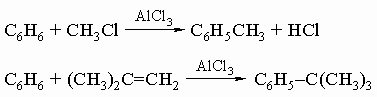
5) дегидрогенизация алициклических углеводородов:
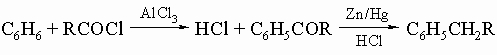
6) декарбоксилирование кислот, например:

7) перегонка фенолов с цинковой пылью (метод полезен для установления структуры, но редко применяется в синтезе) например:
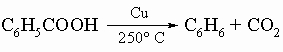
Применимы также и другие методы, приведенные выше для получения алифатических углеводородов (например, восстановление галогенидов, спиртов, олефинов). Реакции углеводородов бензольного ряда можно подразделить на реакции боковой цепи и реакции кольца. За исключением положения, соседнего с кольцом, боковая цепь ведет себя по существу как парафин, олефин или ацетилен в зависимости от своей структуры. Углерод-водородные связи на углероде, соседнем с кольцом, однако, заметно активированы, особенно по отношению к таким реакциям с участием свободных радикалов, как галогенирование и окисление. Так, толуол и высшие гомологи легко хлорируются и бромируются галогенами на солнечном свету:
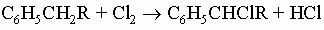
В случае толуола можно ввести второй и третий галогены. Эти a-хлорсоединения легко гидролизуются щелочами:
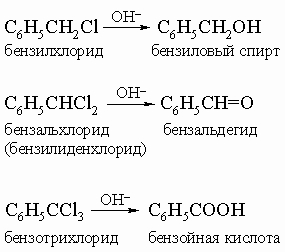
Толуол нетрудно окислить до бензойной кислоты C6H5COOH. Высшие гомологи при окислении претерпевают расщепление боковой цепи до карбоксильной группы, образуя бензойную кислоту. Главной реакцией кольца является ароматическое замещение, при котором протон замещается положительным атомом или группой, произведенной из кислотного или "электрофильного" реагента:
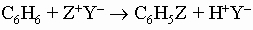
Типичные примеры такого замещения: а) нитрование, Ar-H + HNO3 -> Ar-NO2 + H2O; б) галогенирование, Ar-H + X2 -> Ar-X + HX; в) алкилирование олефинами и алкилгалогенидами по Фриделю - Крафтсу (как указано выше); г) ацилирование по Фриделю - Крафтсу,
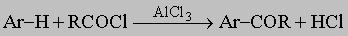
д) сульфирование, Ar-H + H2SO4 (дымящая) -> ArSO3H + H2O. Введение первого заместителя не встречает осложнений, поскольку все положения в бензоле эквивалентны. Введение второго заместителя происходит в различные положения по отношению к первому заместителю в первую очередь в зависимости от природы группы, уже имеющейся в кольце. Природа атакующего реагента играет второстепенную роль. Группы, которые увеличивают электронную плотность в ароматическом кольце -O-, -NH2, -N(CH3)2, -OH, -CH3, -OCH3, -NHCOCH3 активируют орто- и пара-положения и направляют следующую группу главным образом в эти позиции. Напротив, группы, которые оттягивают на себя электроны кольца
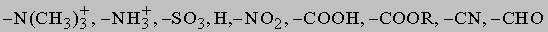
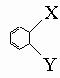
сильнее всего дезактивируют по отношению к электрофильной атаке орто- и пара-положения, поэтому замещение направляется главным образом в мета-положение. Промежуточными по своему поведению являются некоторые группы, которые благодаря противоположным электронным влияниям дезактивируют кольцо по отношению к дальнейшему замещению, но остаются орто-пара-ориентантами: -Cl, -Br, -I и -CH=CHCOOH. Эти принципы важны для синтеза в ароматическом ряду. Так, чтобы получить п-нитробромбензол
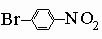
,
необходимо сначала бромировать кольцо и затем нитровать его. Обратный порядок операции дает мета-изомер. При жестких условиях кольцо можно "заставить" проявить свой скрытый ненасыщенный характер. С очень активными платиновыми катализаторами при давлении водорода в несколько атмосфер можно добиться гидрирования бензола в циклогексан (но никогда не удается получить продукты частичного гидрирования вроде циклогексадиена). Продолжительная обработка хлором и бромом на солнечном свету ведет к образованию гексагалогеноциклогексанов.
2. Замещенные бензола. Номенклатура.
1) Монозамещенные бензола можно рассматривать как производные бензола, например этилбензол C6H5-C2H5, или как фенилпроизводные алифатических углеводородов, например 2-фенилбутан C6H5-CH(CH3)C2H5, если у них нет тривиальных названий (например, толуол, ксилол). Галогено- и нитропроизводные называют как производные бензола, например нитробензол C6H5NO2, бромбензол C6H5Br. Другие монозамещенные бензола обозначают особыми названиями: фенол C6H5OH, анизол C6H5OCH3, анилин C6H5NH2, бензальдегид C6H5CH=O. 2) В дизамещенных соединениях указывают относительные положения заместителей орто (о), мета (м) и пара (п), как в ксилолах (см. разд. IV-3.А.1). Порядок старшинства в выборе первого заместителя является следующим: COOH, CHO, COR, SO3H, OH, R, NH2, галоген и NO2. Например
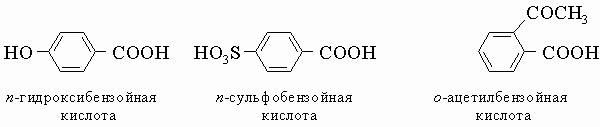
Широко используются некоторые тривиальные названия, например,
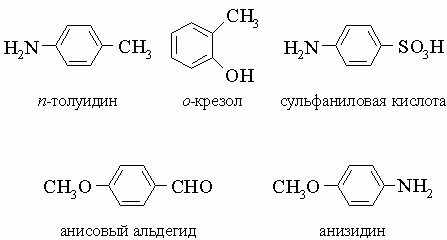
3) В случае трех и более заместителей для обозначения положений используются цифры (от 1 до 6). При выборе первого заместителя применяются те же правила старшинства, например:
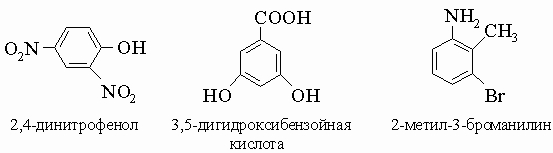
4) Заместители в боковой цепи: такие соединения обычно называют как арилпроизводные алифатических соединений. Примерами могут служить a-фенилэтиламин (C6H5)CH(NH2)CH3 и a-фенилмасляная кислота C2H5CH(C6H5)COOH. Существуют многочисленные тривиальные названия (например, миндальная кислота C6H5CH(OH)COOH), которые будут рассмотрены при обсуждении соответствующих соединений. Галогенопроизводные получают следующими методами: 1) прямое галогенирование кольца
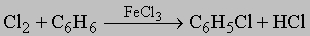
(Br2 реагирует сходным образом); 2) замещение диазониевой группы (см. ниже "Ароматические амины") галогенид-ионом:
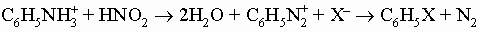
(при X = Cl- и Br- должны быть использованы в качестве катализаторов медь или CuX). Атомы галогенов в ароматических галогенидах очень инертны к действию оснований. Поэтому реакции замещения, аналогичные реакциям алифатических галогенидов, редко оказываются практически полезными в случае арилгалогенидов. В промышленности гидролиз и аммонолиз хлорбензола достигается в жестких условиях. Замещение нитрогруппой в п- или о-положении активирует галоген по отношению к основаниям. Из бром- и иодбензолов можно приготовить реактив Гриньяра. Хлорбензол не образует реактивов Гриньяра, но из него можно получить фениллитий. Эти ароматические металлоорганические соединения по свойствам похожи на алифатические аналоги. Нитросоединения обычно получают прямым нитрованием кольца (см. разд. IV-3.А.1, "Реакции") смесью концентрированных азотной и серной кислот. Реже их готовят окислением нитрозосоединений (C6H5NO). Введение одной нитрогруппы в бензол протекает относительно просто. Вторая входит более медленно. Третью удается ввести только при продолжительной обработке смесью дымящих азотной и серной кислот. Это общий эффект м-ориентирующих групп; они всегда снижают способность кольца к дальнейшему замещению. Тринитробензолы ценятся как взрывчатые вещества. Для осуществления их синтеза нитрование обычно проводят не на самом бензоле, а на таких его производных, как толуол или фенол, в которых о,п-ориентирующие заместители могут активировать кольцо. Общеизвестными примерами служат 2,4,6-тринитрофенол (пикриновая кислота) и 2,4,6-тринитротолуол (тротил). Единственные полезные реакции нитросоединений - это реакции их восстановления. Сильные восстанавливающие агенты (активированный катализаторами водород, олово и соляная кислота, бисульфид-ион) превращают их прямо в амины. Контролируемое электролитическое восстановление позволяет выделить следующие промежуточные стадии:
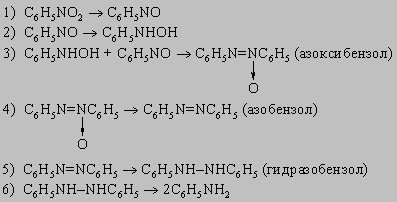
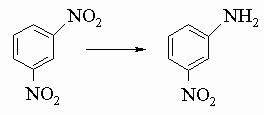
Бисульфид аммония является специфическим реагентом для превращения динитросоединений в нитроанилины, например:
Ароматические амины. Первичные амины получают восстановлением соответствующих нитросоединений. Они представляют собой очень слабые основания (K = 10-10). N-алкиланилины можно приготовить алкилированием первичных аминов. Они по большинству реакций напоминают алифатические амины, за исключением взаимодействия с азотистой кислотой и с окислителями. С азотистой кислотой в кислой среде (при 0-5° С) первичные амины дают устойчивые соли диазония (C6H5N=N+X-), имеющие много важных синтетических приложений. Замещение диазониевой группы галогеном уже обсуждалось. Эта группа может быть также заменена на цианид-ион (с CuCN в качестве катализатора) с получением ароматических нитрилов (C6H5CN). Кипящая вода превращает соли диазония в фенолы. В кипящем спирте эта группа замещается на водород:
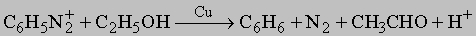
В почти нейтральном растворе диазониевые соли сочетаются с фенолами (и многими аминами), давая азокрасители:
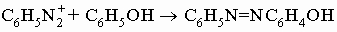
Эта реакция имеет огромное значение для промышленности синтетических красителей. Восстановление бисульфитом ведет к арилгидразинам C6H5NHNH2. Вторичные ариламины, подобно алифатическим вторичным аминам, дают N-нитрозосоединения. Третичные ариламины C6H5NRRў, однако, дают п-нитрозоариламины (например, п-ON-C6H4NRR'). Эти соединения имеют некоторое значение для приготовления чистых вторичных алифатических аминов, поскольку они легко гидролизуются до вторичного амина RRўNH и п-нитрозофенола. Окисление ароматических аминов может затрагивать не только аминогруппу, но и п-положение кольца. Так, анилин при окислении превращается во множество продуктов, включая азобензол, нитробензол, хинон (
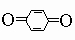
и анилиновый черный краситель). Арилалкиламины (например, бензиламин C6H5CH2NH2) обнаруживают те же свойства и реакции, что и алкиламины с той же молекулярной массой. Фенолы, ароматические гидроксисоединения, у которых гидроксильная группа присоединена прямо к кольцу. Они значительно более кислотны, чем спирты, располагаясь по силе между угольной кислотой и бикарбонат-ионом (для фенола Ka = 10-10). Наиболее общий метод их получения - разложение солей диазония. Их соли можно получить сплавлением солей арилсульфокислот со щелочью:
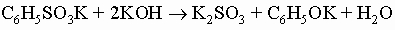
В дополнение к этим методам фенол получают в промышленности прямым окислением бензола и гидролизом хлорбензола в жестких условиях - раствором едкого натра при высокой температуре под давлением. Фенол и некоторые из его простейших гомологов - метилфенолы (крезолы) и диметилфенолы (ксиленолы) - найдены в каменноугольной смоле. Реакции фенолов примечательны лабильностью гидроксильного водорода и устойчивостью гидроксильной группы к замещению. Кроме того, пара-положение (и орто-положения, если пара-положение блокировано) очень чувствительны к атаке реагентов, вызывающих ароматическое замещение, и окислителей. Фенолы легко образуют натриевые соли при обработке едким натром и содой, но не бикарбонатом натрия. Эти соли легко реагируют с ангидридом и хлорангидридом кислот, давая сложные эфиры (например, C6H5OOCCH3), и с алкилгалогенидами и алкилсульфатами, образуя простые эфиры (например, анизол C6H5OCH3). Сложные эфиры фенолов можно также получить действием ацилирующих агентов в присутствии пиридина. Фенольные гидроксильные группы можно удалить перегонкой фенолов с цинковой пылью, но они не замещаются при нагревании с галогеноводородными кислотами, как спиртовые гидроксильные группы. Гидроксильная группа так сильно активирует орто- и пара-положения, что реакции нитрования, сульфирования, галогенирования и им подобные протекают бурно даже при низких температурах. Действие бромной воды на фенол ведет к 2,4,6-трибромфенолу, но п-бромфенол можно получить бромированием в таких растворителях, как сероуглерод, при низких температурах. Галогенирование без растворителя дает смесь о- и п-галогенофенолов. Разбавленная азотная кислота легко нитрует фенол, давая смесь о- и п-нитрофенолов, из которой о-нитрофенол можно отогнать с паром. Фенол и крезолы используют как дезинфицирующие средства. Среди других фенолов важное значение имеют: а) карвакрол (2-метил-5-изопропилфенол) и тимол (3-метил-6-изопропилфенол), которые встречаются во многих эфирных маслах как продукты химических превращений терпенов; б) анол (п-пропенилфенол), который встречается в виде соответствующего метилового эфира анетола в анисовом масле; близкий к нему хавикол (п-аллилфенол) находится в маслах из листьев бетеля и лавра и в виде метилового эфира, эстрагола, в анисовом масле; в) пирокатехин (2-гидроксифенол), который встречается во многих растениях; в промышленности его получают гидролизом (в жестких условиях) о-дихлорбензола или о-хлорфенола, а также деметилированием гваякола (монометилового эфира пирокатехина), содержащегося в продуктах сухой перегонки бука; пирокатехин легко окисляется в о-хинон
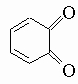
и находит широкое применение как восстановитель в фотографических проявителях; г) резорцин (м-гидроксифенол); его получают щелочным плавлением м-бензолдисульфокислоты и используют для приготовления красителей; он легко замещается в положении 4 и восстанавливается в дигидрорезорцин (циклогександион-1,3), который расщепляется разбавленной щелочью в d-кетокапроновую кислоту; его 4-н-гексилпроизводное является полезным антисептиком; д) гидрохинон (п-оксифенол), который встречается в некоторых растениях в виде гликозида арбутина; его получают восстановлением хинона (см. выше "Ароматические амины"), продукта окисления анилина; это легко обратимая реакция; при 50%-ном ее протекании образуется устойчивое эквимолекулярное соединение хинона и гидрохинона - хингидрон; хингидронный электрод часто применяется в потенциометрическом анализе; благодаря восстанавливающим свойствам гидрохинона он, подобно пирокатехину, используется в фотографических проявителях; е) пирогаллол (2,3-дигидроксифенол), который получают из галловой кислоты (см. ниже "Ароматические кислоты") перегонкой над пемзой в атмосфере углекислого газа; будучи мощным восстановителем, пирогаллол находит применение как поглотитель кислорода в газовом анализе и как фотографический проявитель. Ароматические спирты - это соединения, которые, подобно бензиловому спирту C6H5CH2OH, содержат гидроксильную группу в боковой цепи (а не в кольце, как фенолы). Если гидроксильная группа находится при углеродном атоме, соседнем с кольцом, она особенно легко замещается на галоген при действии галогеноводородов на водород (над платиной) и легко отщепляется при дегидратации (в C6H5CHOHR). Такие простые ароматические спирты, как бензиловый, фенетиловый (C6H5CH2CH2OH), фенилпропиловый (C6H5CH2CH2CH2OH) и коричный (C6H5CH=CHCH2OH), используются в парфюмерной промышленности и встречаются в природе во многих эфирных маслах. Их можно получить по любой из общих реакций, описанных выше для приготовления алифатических спиртов.
Ароматические альдегиды. Бензальдегид C6H5CHO, простейший ароматический альдегид, образуется в масле горького миндаля в результате ферментативного гидролиза гликозида амигдалина C6H5CH(CN)-O-C12H21O10. Он находит широкое применение как промежуточное вещество в синтезе красителей и других ароматических соединений, а также как отдушка и основа духов. В промышленности его получают гидролизом бензилиденхлорида C6H5CHCl2, продукта хлорирования толуола, или прямым окислением толуола в газовой (над V2O5) либо в жидкой фазе с MnO2 в 65%-ной серной кислоте при 40° С. Для приготовления ароматических альдегидов служат следующие общие методы: 1) синтез Гаттермана - Коха:
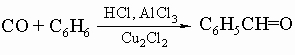
2) синтез Гаттермана:
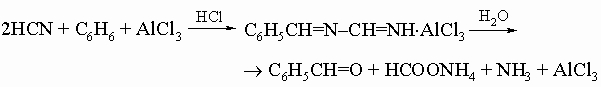
3) синтез Раймера - Тимана (для получения ароматических гидроксиальдегидов):
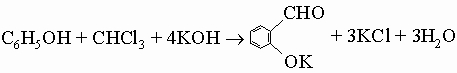
Бензальдегид окисляется кислородом воздуха в бензойную кислоту; этого можно достичь также применением других окислителей, например перманганата или дихромата. Вообще бензальдегид и другие ароматические альдегиды вступают в карбонильные реакции конденсации (см. разд. IV-1.А.4) несколько менее активно, чем алифатические альдегиды. Отсутствие a-водородного атома препятствует вступлению ароматических альдегидов в альдольную самоконденсацию. Тем не менее смешанная альдольная конденсация используется в синтезе:
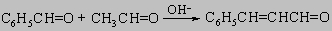
Следующие реакции типичны для ароматических альдегидов: 1) реакция Канниццаро:
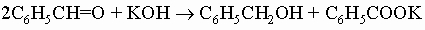
2) бензоиновая конденсация:
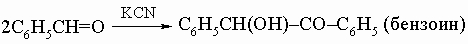
3) реакция Перкина:
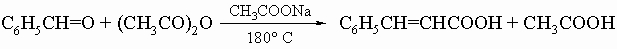
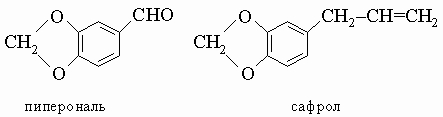
Некоторое значение имеют следующие ароматические альдегиды: 1) Салициловый альдегид (о-гидроксибензальдегид) встречается в природе в душистом масле таволги. Его получают из фенола синтезом Раймера - Тимана. Он находит применение в синтезе кумарина (см. разд. IV-4.Г) и некоторых красителей. 2) Коричный альдегид C6H5CH=CHCHO содержится в масле корицы и кассии. Его получают кротоновой конденсацией (см. разд. IV-1.А.4) бензальдегида с уксусным альдегидом. 3) Анисовый альдегид (п-метоксибензальдегид) содержится в масле кассии и используется в духах и ароматизирующих добавках. Его получают синтезом Гаттермана из анизола. 4) Ванилин (3-метокси-4-гидроксибензальдегид) является главным ароматическим компонентом экстрактов ванили. Его можно получить по реакции Раймера - Тимана из гваякола или обработкой эвгенола (2-метокси-4-аллилфенола) щелочью с последующим окислением. 5) Пиперональ обладает запахом гелиотропа. Его получают из сафрола (масло американского лавра) аналогично тому, как получают ванилин из эвгенола.
Ароматические кетоны. Эти вещества обычно получают из ароматических соединений и хлорангидридов кислот по реакции Фриделя - Крафтса. Применяются также общие методы получения алифатических кетонов. Специфическим методом получения гидроксикетонов является перегруппировка Фриса в сложных эфирах фенолов:
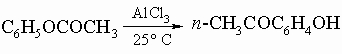
(при повышенных температурах порядка 165-170° С преобладает о-изомер). Вообще ароматические кетоны вступают в те же реакции, что и алифатические кетоны, но гораздо более медленно. a-Дикетонбензил C6H5CO-COC6H5, получаемый окислением бензоина (см. предыдущий разд. "Ароматические альдегиды"), претерпевает характерную перегруппировку при обработке щелочью, образуя бензиловую кислоту (C6H5)2C(OH)COOH.
Ароматические кислоты. Простейшей ароматической карбоновой кислотой является бензойная C6H5COOH, которая вместе с ее эфирами встречается в природе в составе многих смол и бальзамов. Она широко применяется как пищевой консервант, особенно в форме натриевой соли. Как и алифатические кислоты, бензойную кислоту и другие ароматические кислоты можно получить действием углекислого газа на реактив Гриньяра (например, C6H5MgBr). Их можно также приготовить гидролизом соответствующих нитрилов, которые в ароматическом ряду получают из диазониевых солей или сплавлением натриевых солей ароматических сульфокислот с цианидом натрия:
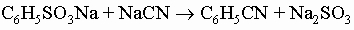
Другие методы их получения включают: 1) окислительное расщепление алифатических боковых цепей
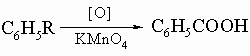
2) гидролиз трихлорметиларенов
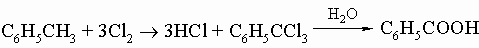
3) синтез гидроксикислот по Кольбе
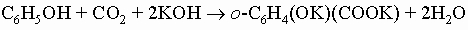
4) окисление ацетофенонов гипогалогенитами
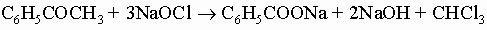
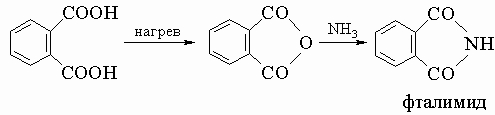
Ниже перечислены некоторые из наиболее важных ароматических карбоновых кислот: 1) Салициловую (о-гидроксибензойную) кислоту о-C6H4(COOH)OH получают из фенола синтезом Кольбе. Ее метиловый эфир является душистым компонентом масла зимолюбки (гаультерии), а натриевая соль ацетилпроизводного представляет собой аспирин (о-ацетоксибензоат натрия). 2) Фталевую (о-карбоксибензойную) кислоту получают окислением нафталина. Она легко образует ангидрид, а последний при действии аммиака дает фталимид - важное промежуточное вещество в синтезе многих соединений, включая краситель индиго
3) Антраниловая (о-аминобензойная) кислота о-C6H4(NH2)COOH получается при действии гипохлорита натрия на фталимид (реакция Гофмана). Ее метиловый эфир является компонентом духов и встречается в природе в маслах жасмина и апельсиновых листьев. 4) Галловая (3,4,5-тригидроксибензойная) кислота образуется вместе с глюкозой при гидролизе некоторых сложных веществ растительного происхождения, известных под названием таннинов. Сульфокислоты. Бензолсульфокислота C6H5SO3H получается при действии дымящей серной кислоты на бензол. Она и другие сульфокислоты являются сильными кислотами (K > 0,1). Сульфокислоты легко растворимы в воде, гигроскопичны; их трудно получить в свободном состоянии. Чаще всего их используют в виде натриевых солей. Наиболее важные реакции солей, а именно сплавление со щелочами (с образованием фенолов) и с цианидом натрия (с получением нитрилов), уже обсуждались. При действии пентахлорида фосфора они дают арилсульфохлориды (например, C6H5SO2Cl), которые находят применение в алифатических и алициклических синтезах. Наиболее часто используемым таким способом арилсульфохлоридом является п-толуолсульфохлорид (п-CH3C6H4SO2Cl), в литературе часто называемый тозилхлоридом (TsCl). Нагревание сульфокислот в 50-60% серной кислоте при 150° С вызывает их гидролиз до серной кислоты и исходных углеводородов:
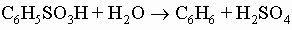
Важной сульфокислотой является сульфаниловая кислота п-H2NC6H4SO3H (или п-H3N+C6H4SO3-), амид (сульфаниламид) и другие производные которой представляют собой важные химиотерапевтические средства. Сульфаниловую кислоту получают действием дымящей серной кислоты на анилин. Многие моющие средства являются солями длинноцепочечных сульфокислот, например NaO3S-C6H4-C12H25.
Б. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ НАФТАЛИНОВОГО РЯДА
1. Синтез a- и b-замещенных производных нафталина. Нафталин является главным компонентом каменноугольной смолы. Он имеет исключительное значение в синтезе многих промышленных продуктов, включая индиго и азокрасители. Однако его использование как репеллента, отпугивающего моль, сократилось с введением таких новых средств, как п-дихлорбензол. Его монозамещенные производные обозначаются как a- или b- в соответствии с положением заместителя (см. табл. 4 в разд. III). Положения в полизамещенных производных обозначаются цифрами. Вообще говоря, a-положение проявляет более высокую реакционную способность. Нитрование, галогенирование и низкотемпературное сульфирование ведут к a-производным. Доступ к b-положению достигается главным образом посредством высокотемпературного сульфирования. В этих условиях a-сульфокислота перегруппировывается в более устойчивую b-форму. Введение других заместителей в b-положение становится после этого возможным при помощи реакции Бухерера: сначала из b-нафталинсульфокислоты щелочным плавлением получают b-нафтол b-C10H7OH, который затем при обработке бисульфитом аммония при 150° С и 6 атм дает b-нафтиламин b-C10H7NH2; через соединения диазония, получаемые из этого амина обычным путем, теперь можно ввести в b-положение галоген или цианогруппу. Реакция Фриделя - Крафтса между нафталином и хлорангидридом также дает b-ацилпроизводные b-C10H7COR.
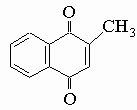
2. Реакции замещения производных нафталина. Реакции производных нафталина те же, что и реакции производных бензола. Так, нафталинсульфокислоты служат источником нафтолов; нафтиламины через соли диазония превращаются в галогено- и цианнафталины. Поэтому особое обсуждение реакций соединений нафталина будет опущено. Однако реакции замещения в производных нафталина представляют определенный интерес. 1) При наличии о,п-ориентанта (-CH3, -OH) в 1(a)-положении атака направляется преимущественно в положение 4 и затем в положение 2. 2) В присутствии м-ориентанта (-NO2) в положении 1 атака направляется в положение 8 (пери) и затем в положение 5. 3) При наличии о,п-ориентанта в положении 2 (b) атаке подвергается преимущественно положение 1, хотя сульфирование может происходить в положении 6. Особенно важно, что никогда не подвергается атаке положение 3. Это объясняют низкой степенью двоесвязности углерод-углеродной связи 2-3. В нафталине замещение протекает в более мягких условиях, чем в бензоле. Нафталин также легче восстанавливается. Так, амальгама натрия восстанавливает его в тетралин (тетрагидронафталин; формулу см. в табл. 4 в разд. III). Он также более чувствителен к окислению. Горячая концентрированная серная кислота в присутствии ионов ртути превращает его во фталевую кислоту (см. разд. IV-3.А.2 "Ароматические кислоты"). Хотя в толуоле метильная группа окисляется раньше кольца, в b-метилнафталине положения 1,4 более подвержены окислению, так что первым продуктом является 2-метил-1,4-нафтохинон:
В. ПРОИЗВОДНЫЕ МНОГОЯДЕРНЫХ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
1. Антрацен и его производные. Антрацен (формулу см. в табл. 4, разд. III) содержится в значительных количествах в каменноугольной смоле и находит широкое применение в промышленности как промежуточное вещество в синтезе красителей. Положения 9,10 высокореакционноспособны в реакциях присоединения. Так, водород и бром легко присоединяются, давая соответственно 9,10-дигидро- и 9,10-дибромантрацен. Окисление хромовой кислотой превращает антрацен в антрахинон.
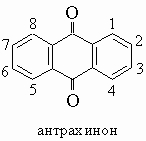
Антрахинон (т. пл. 285° С) представляет собой желтое кристаллическое вещество. Наиболее общий способ получения антрахинона и его производных состоит в циклизации о-бензоилбензойных кислот при действии серной кислоты
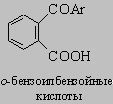
о-Бензоилбензойные кислоты получают действием фталевого ангидрида на бензол (или соответствующее его производное) в присутствии хлорида алюминия. Антрахинон чрезвычайно устойчив к окислению. Такие восстановители, как цинковая пыль и щелочь или бисульфит натрия, превращают его в антрагидрохинон (9,10-дигидроксиантрацен), белое вещество, растворяющееся в щелочи с образованием кроваво-красных растворов. Олово и соляная кислота восстанавливают одну кетогруппу в метиленовую, образуя антрон. Нитрование в жестких условиях дает главным образом a(1)-производное вместе с заметным количеством 1,5- и 1,8-динитроантрахинонов. Сульфирование серной кислотой приводит к образованию главным образом b(2)-сульфокислоты, но в присутствии небольших количеств сульфата ртути основным продуктом является a-сульфокислота. Дисульфирование в присутствии сульфата ртути дает в основном 1,5- и 1,8-дисульфокислоты. В отсутствие ртути образуются 2,6- и 2,7-дисульфокислоты. Сульфокислоты антрахинона имеют большое значение, так как из них щелочным плавлением получают гидроксиантрахиноны, многие из которых являются ценными красителями. Так, окислительное щелочное плавление b-сульфокислоты дает краситель ализарин (1,2-дигидроксиантрахинон), который в природе содержится в корнях марены. Сульфокислотные группы в антрахиноне можно также непосредственно заменить аминогруппами с образованием аминоантрахинонов, представляющих собой ценные красители. В этой реакции натриевую соль сульфокислоты обрабатывают аммиаком при 175-200° С в присутствии мягкого окислителя (например, мышьяковокислого натрия), добавляемого, чтобы разрушить образующийся сульфит.
2. Фенантрен и его производные. В природе фенантрен находится в каменноугольной смоле. Он сам и его производные могут быть получены из о-нитростильбенкарбоновой кислоты, образующейся конденсацией о-нитробензальдегида и фенилуксусной кислоты по методу Пшорра:
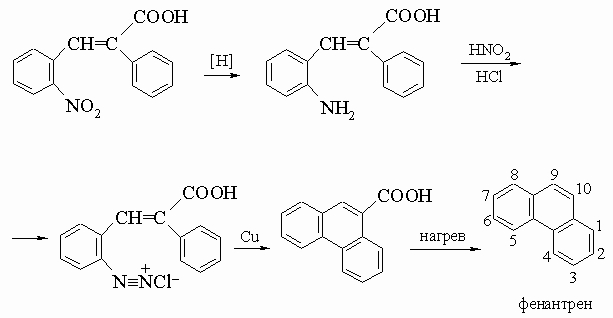
Двой