БРОМ -а (-у); м. [от греч. brōmos - дурной запах]
1. Химический элемент (Br), тяжёлая красно-бурая ядовитая жидкость, дымящая на воздухе (используется в химическом производстве, в виде солей - в медицине и фотографии). Соли брома. Микстура с бромом.
2. Лекарственный препарат, содержащий это вещество или его соединения (применяется как успокоительное или снотворное средство). Выписать, принимать б. Накапать брома (брому).
◁ Бро́мный, -ая, -ое. Б-ые препараты. Б-ая вода (водный раствор брома). Бро́мовый, -ая, -ое. Б-ые препараты. Бро́мистый, -ая, -ое. Б-ые соли, металлы. Раствор бромистого калия (успокоительные капли).
* * *
бром (лат. Bromum), химический элемент VII группы периодической системы, относится к галогенам. Название от греч. brōmos - зловоние. Тяжёлая красно-бурая дымящая на воздухе жидкость с резким неприятным запахом; плотность 3,1 г/см3, tпл -7,25°C, tкип 59,2°C. Применяют как бромирующий агент, для получения бромидов, органических и других соединений брома, в аналитической химии. Бром ядовит.
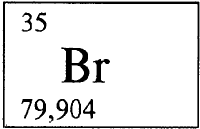
* * *
БРОМ - БРОМ (лат. Brоmum), Br (читается «бром»), химический элемент с атомным номером 35, атомная масса 79,904. Название связано с тем, что у брома тяжелый, неприятный запах паров (от греческого bromos - зловоние).
Природный бром представляет смесь двух нуклидов (см. НУКЛИД) с массовыми числами 79 (в смеси 50,56% по массе) и 81. Конфигурация внешнего электронного слоя 4s2p5. В соединениях проявляет степени окисления -1, +1, +3, +5 и +7 (валентности I, III, V и VII), причем наиболее характерны степени окисления -1 и +5.
Расположен в четвертом периоде в группе VIIА периодической системы элементов Менделеева, относится к галогенам (см. ГАЛОГЕНЫ).
Радиус нейтрального атома брома 0,119 нм, ионные радиусы Вr-, Вr3+, Вr5+и Вr7+ равны, соответственно, 0,182, 0,073, 0,045 и 0,039 нм. Энергии последовательной ионизации нейтрального атома брома равны, соответственно, 11,84, 21,80, 35,9, 47,3 и 59,7 эВ. Сродство к электрону 3,37 эВ. По шкале Полинга электроотрицательность брома 2,8.
История открытия
К открытию брома привели исследования французского химика А. Балара (см. БАЛАР Антуан Жером), который в 1825, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость. Эту жидкость, полученную также из морской воды, он назвал муридом (от лат. muria - соляной раствор, рассол) и послал сообщение о своем открытии в Парижскую академию наук. Комиссия, созданная для проверки этого сообщения, не приняла название Балара и назвала новый элемент бромом. Открытие брома сделало молодого и мало кому известного ученого знаменитым. После появления статьи Балара оказалось, что склянки с аналогичным веществом ждали исследования у немецких химиков К. Левига и Ю. Либиха (см. ЛИБИХ Юстус). Упустивший возможность открыть новый элемент, Либих воскликнул: «Это не Балар открыл бром, а бром открыл Балара».
Нахождение в природе
Бром - довольно редкий в земной коре элемент. Его содержание в ней оценивается в 0,37·10-4% (примерно 50-е место).
Химически бром высоко активен и поэтому в свободном виде в природе не встречается. Входит в состав большого числа различных соединений (бромиды натрия, калия, магния и др.), сопутствующих хлоридам натрия, калия и магния. Собственные минералы брома - бромаргирит (бромид серебра AgBr) и эмболит (смешанный хлорид и бромид серебра) - чрезвычайно редки (см. Бромиды природные (см. БРОМИДЫ ПРИРОДНЫЕ)). Источником брома служат воды горьких озер, соляные рассолы, сопутствующие нефти и различным соляным месторождениям, и морская вода (65·10-4%), более богато бромом Мертвое море. В настоящее время бром обычно извлекают из вод некоторых горьких озер, одно из которых расположено, в частности, в нашей стране в Кулундинской степи (на Алтае).
Физические и химические свойства
При обычных условиях бром - тяжелая (плотность 3,1055 г/см3) красно-бурая густая жидкость с резким запахом. Бром относится к числу простых веществ, жидких при обычных условиях (кроме брома, таким веществом является еще ртуть). Температура плавления брома -7,25 °C, температура кипения +59,2 °C. Стандартный электродный потенциал Вr2/Вr- в водном растворе равен +1,065 В.
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 0,323 нм, межъядерное расстояние в этой молекуле 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
Br2 + H2O = HBr + HBrO.
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
Br2+ 2KI = I2+ 2KBr.
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
Cl2 + 2NaBr = Br2 + 2NaCl.
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором - PBr3 и PBr5. Бром реагирует также с неметаллами селеном (см. СЕЛЕН) и теллуром (см. ТЕЛЛУР) .
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде - это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты - бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе - образование с ионами Ag+ светло-желтого осадка AgBr, практически нерастворимого как в воде, так и в азотнокислом растворе.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF5, с иодом - IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени - серебро, титан и свинец.
Бром - сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион - до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
C2H4 + Br2 = C2H4Br2.
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
Br2 + 3Na2CO3 = 5NaBr + NaBrO3+ 3CO2.
Применение
Бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения, а также в фотографии. Широко известны содержащие бром лекарственные препараты. Следует отметить, что расхожее выражение: «врач прописал бром по столовой ложке после еды» означает, разумеется, лишь то, что прописан водный раствор бромида натрия (или калия), а не чистый бром. Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения (см. ТОРМОЖЕНИЕ) в центральной нервной системе.
Особенности работы с бромом
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, перчатками. ПДК паров брома 0,5 мг/м3. Уже при содержании брома в воздухе в концентрации около 0,001% (по объему) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях - спазмы дыхательных путей, удушье. При попадании в организм токсическая доза составляет 3 г, летальная - от 35 г. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух; для восстановления дыхания можно пользоваться тампоном, смоченным нашатырным спиртом, периодически поднося его к носу пострадавшего на короткое время. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
Из-за высокой химической активности и ядовитости как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в емкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда ядовитая жидкость окажется на полу).
Для нейтрализации пролитого брома поверхность с ним надо немедленно покрыть кашицей из влажной соды Na2CO3.