К неорганическим относятся соединения всех химических элементов, за исключением большинства соединений углерода.
Кислоты, основания и соли. Кислотами называются соединения, которые в воде диссоциируют с высвобождением ионов водорода (Н+). Эти ионы определяют характерные свойства сильных кислот: кислый вкус и способность взаимодействия с основаниями. Основания - это вещества, которые в воде диссоциируют с высвобождением гидроксид-ионов (ОН-). Солями называют ионные соединения, образующиеся при взаимодействии кислот и оснований:
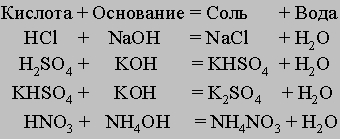
Номенклатура неорганических соединений. Номенклатура большинства распространенных неорганических соединений основана на следующих правилах.
Элементы. Названия металлов обычно кончаются на -ий (например, натрий, калий, алюминий, магний). Исключение составляют металлы, известные с древности и тогда же получившие свои названия. Это, например, железо, медь, золото. Названия неметаллов, как правило, кончаются на -ор (хлор, бор, фосфор), -од (водород, кислород, иод) или -он (аргон, неон). Зная названия элементов и наиболее распространенных ионов и используя приведенные ниже правила, можно дать название практически любому неорганическому соединению.
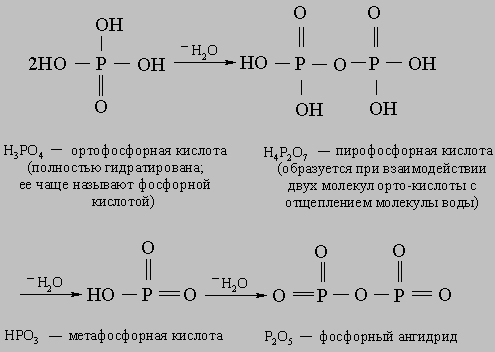
Кислоты. Названия кислот, молекулы которых не содержат кислорода, оканчиваются на водородная, например хлороводородная (HCl), бромоводородная (HBr), иодоводородная (HI). Названия кислородсодержащих кислот зависят от степени окисления центрального элемента. Название той кислоты, в которой этот элемент имеет меньшую степень окисления, оканчивается на -истая, например азотистая (HNO2), сернистая (H2SO3), а большую - на -ная, например азотная (HNO3), серная (H2SO4). На примере хлора рассмотрим случай, когда элемент образует более двух кислородсодержащих кислот. Их названия формируются следующим образом: хлорноватистая кислота, HClO; хлористая, HClO2; хлорноватая, HClO3; хлорная, HClO4. Степень окисления хлора здесь составляет +1, +3, +5 и +7 соответственно. Названия кислот, молекулы которых содержат разное количество воды, отличаются друг от друга приставками орто-, гипо-, пиро- и мета- (в порядке уменьшения содержания воды):
Положительно заряженные ионы. Названия этих ионов образуются следующим образом: после слова ион указывают название элемента и римскими цифрами - степень его окисления. Например, Cu2+ - ион меди(II), Cu+ - ион меди(I). Названия некоторых положительных ионов оканчиваются на -оний: аммоний, NH4+; гидроксоний, H3O+.
Отрицательно заряженные ионы. Названия одноатомных отрицательно заряженных ионов (и соответственно солей), полученных из не содержащих кислорода кислот, оканчиваются на -ид: хлорид-ион, Cl-; бромид-ион, Br-. Названия ионов (и соответственно солей), полученных из кислородсодержащих кислот, в которых центральный элемент имеет меньшую степень окисления, оканчиваются на -ит: сульфит, SO32-; нитрит, NO2-; фосфит, PO33-; а большую - на -ат: сульфат, SO42-; нитрат, NO3-; фосфат, РО43-. Названия ионов, полученных из частично нейтрализованных кислот, образуются прибавлением к названию иона слова кислый либо приставок гидро- или би-: гидрокарбонат (бикарбонат), HCO3-; кислый сульфат, HSO4-.
Соли и ковалентные соединения. Для солей и ковалентных соединений используют названия ионов, которые в них входят: хлорид натрия, NaCl; гидроксид натрия, NaOH. Если элемент может иметь несколько степеней окисления, то после его названия римскими цифрами указывают степень окисления в данном соединении: сульфат железа(II), FeSO4; сульфат железа(III), Fe2(SO4)3. Если соединение образуют два неметалла, то для указания числа их атомов используют приставки ди-, три-, тетра-, пента- и т.д. Например, дисульфид углерода, CS2; пентахлорид фосфора, PCl5, и т.д.