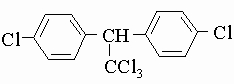
Для наименования органических соединений используется несколько систем, но ни одна из них не подходит для всех соединений. Сохранились многие тривиальные названия, которые либо применялись еще в начальный период органической химии и отражают источник получения или характерные качества, либо являются более новыми несистематическими названиями, которые используются по причине удобства. Так, спирт CH3OH иногда называют "древесным спиртом", потому что его когда-то получали сухой перегонкой дерева; систематическое название для этого спирта - метанол. Алкалоид морфин назван по его наркотическому действию, но в этом случае тривиальное название является единственным обычно используемым, поскольку систематическое название сложно и громоздко. Тривиальные названия часто дают промышленным продуктам, особенно в фармацевтической промышленности, где продукты продаются под патентованными названиями, причем одно и то же соединение различные фирмы могут выпустить под различными названиями. Часто используются квазисистематические названия, которые не могут адекватно описать структуру соединения без дополнительной информации. Например, инсектицид ДДТ иногда называют дихлордифенилтрихлорэтаном, чего недостаточно, чтобы написать единственную структуру этого соединения, поскольку название ничего не говорит о положении атомов хлора. Полное название для главного активного компонента - 2,2-ди(4-хлорфенил)-1,1,1-трихлорэтан.
Система ИЮПАК. Процесс создания международной номенклатуры был начат в 1892 (Женевская номенклатура), продолжен в 1930 (Льежская номенклатура), с 1947 дальнейшее развитие связано с деятельностью комиссии ИЮПАК (Международный союз теоретической и прикладной химии) по номенклатуре органических соединений. Публиковавшиеся в разные годы правила ИЮПАК собраны в 1979 в "голубой книге" [[Nomenclature of Organic Chemistry, Section A, B, C, D, E, F and H, Oxford Pergamon Press, 1979]]. Своей задачей комиссия ИЮПАК считает не создание новой, единой системы номенклатуры, а упорядочение, "кодификацию", имеющейся практики. Результатом этого является сосуществование в правилах ИЮПАК нескольких номенклатурных систем, а следовательно, и нескольких допустимых названий для одного и того же вещества. Правила ИЮПАК опираются на следующие системы: заместительную, радикало-функциональную, аддитивную (соединительную), заменительную номенклатуру и т.д. В заместительной номенклатуре основой названия служит один углеводородный фрагмент, а другие рассматриваются как заместители водорода (например, (C6H5)3CH - трифенилметан). В радикало-функциональной номенклатуре в основе названия лежит название характеристической функциональной группы, определяющей химический класс соединения, к которому присоединяют наименование органического радикала (например, метиловый спирт, метилэтилкетон, метилхлорид, бутилцианид, диэтиловый эфир). В соединительной номенклатуре название составляют из нескольких равноправных частей (например, C6H5-C6H5 бифенил) или добавляя обозначения присоединенных атомов к названию основной структуры (например, 1,2,3,4-тетрагидронафталин, гидрокоричная кислота, этиленоксид, стиролдихлорид). Заменительную номенклатуру применяют при наличии неуглеродных атомов (гетероатомов) в молекулярной цепи: корни латинских названий этих атомов с окончанием "а" (а-номенклатура) присоединяют к названиям всей структуры, которая получилась бы, если бы вместо гетероатомов был углерод (например, CH3-O-CH2-CH2-NH-CH2-CH2-S-CH3 2-окса-8-тиа-5-азанонан). Система ИЮПАК является общепризнанной в мире, и лишь адаптируется соответственно грамматике языка страны (например, однотипные заместители перечисляются в алфавитном порядке). Полный набор правил применения системы ИЮПАК ко многим менее обычным типам молекул длинен и сложен. Здесь представлено лишь основное содержание системы, но это позволяет осуществлять наименование соединений, для которых применяется система. Названия по системе ИЮПАК образуются путем видоизменения названий насыщенных углеводородов (табл. 1). Отметим, что все эти названия оканчиваются на "ан"; это окончание характерно для всех насыщенных углеводородов - алканов. Такой ряд соединений, в котором соседние члены отличаются на одну метиленовую группу (CH2), называется гомологическим рядом. Необходимо знать также названия замещающих групп, которые могут находиться в разветвлениях главной углеводородной цепи. Если из углеводорода удалить один атом водорода, полученная таким путем группа называется углеводородным радикалом; его название получают, заменяя в названии алкана окончание "ан" на "ил" (табл. 2).
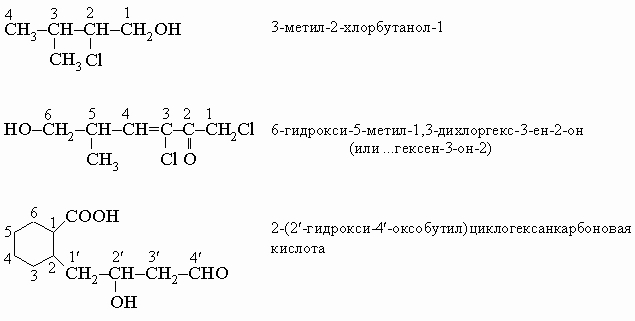
Основные правила наименования соединений по системе ИЮПАК даны ниже: 1. Находят самую длинную непрерывную цепь углеродных атомов в молекуле. Название соответствующего углеводорода используют как основу названия соединения. 2. Атомам (иным, чем водород) и группам вдоль этой цепи даются наименования, и эти наименования пишут перед названием основного углеводорода. 3. Атомы углерода основной углеводородной цепи нумеруют последовательно, начиная с конца, выбранного так, чтобы атомы углерода, несущие заместители, получили наиболее низкие номера. 4. Положения заместителей указывают локантами - числами перед названиями заместителей, обозначающими порядковые номера атомов углерода, к которым они присоединены. 5. Если имеется несколько одинаковых групп, перед их названием ставится приставка "ди", "три", "тетра", "пента", "гекса" и т.д., обозначающая число присутствующих групп. 6. Двойные углерод-углеродные связи указывают суффиксом "ен" ("диен", если их две, и т.п.), а тройные - суффиксом "ин" ("диин" для двух и т.д.); при использовании этих суффиксов окончание "ан" опускают. Положение кратных связей обозначают порядковыми номерами углеродных атомов, подобно тому, как это делается для заместителей. 7. Все название пишется одним словом. Несколько примеров иллюстрируют эти правила:

Наименование таких сложных радикалов, как CH3CHCH2Cl в последнем примере, осуществляется по следующим правилам: 1. Углеродный атом со "свободной" связью получает номер 1'. Самая длинная углеродная цепь, начиная с этого места, последовательно нумеруется и используется для основного названия (в приведенном примере - этан). 2. С заместителями вдоль этой цепи поступают, как описано выше при наименовании соединений. 3. Полное название сложного радикала заключают в скобки, чтобы избежать путаницы с номерами для остальной части молекулы. Названия по системе ИЮПАК и обычные названия для нескольких часто встречающихся сложных радикалов даны в табл. 2. Циклические углеводороды называют, прибавляя к названию углеводорода с прямой цепью приставку "цикло". Для указания положения заместителей атомы кольца нумеруют последовательно, начиная с главного заместителя (табл. 3).
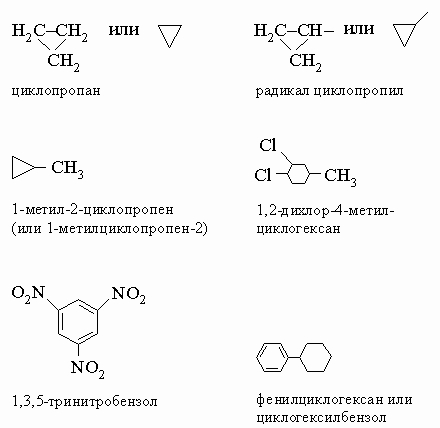
Отметим, что в последнем примере углеводород просто называют бензолом (а не 1,3,5-циклогексатриеном), а соответствующий радикал - фенилом.
Более сложным циклическим соединениям обычно дают тривиальные названия и системы нумерации. К соединениям этого типа относятся полициклические ароматические углеводороды (в которых бензольные кольца соединены двумя общими атомами) и гетероциклические соединения (у которых в состав колец входят гетероатомы). Важнейшие циклические системы и их нумерация приведены в табл. 4. Отметим, что в гетероциклах нумерация начинается с гетероатома и производится так, чтобы другие гетероатомы получили наименьшие номера. Наименование заместителей в этих кольцах следует основным правилам ИЮПАК, приведенным выше.
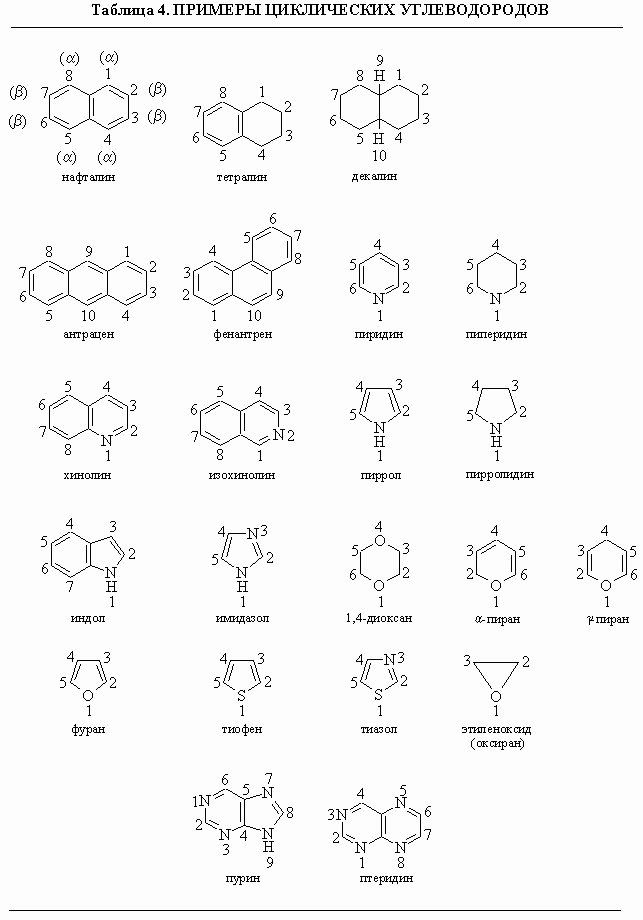
Таблица 4. ПРИМЕРЫ ЦИКЛИЧЕСКИХ УГЛЕВОДОРОДОВ
Наиболее широко для построения названий органических соединений правила ИЮПАК рекомендуют использовать заместительную номенклатуру. Общая схема таких названий: 1) префиксы - боковые цепи, затем младшие функции (см. табл. 3) в алфавитном порядке; 2) корень - главная цепь или цикл; 3) суффиксы - кратные связи, главная функция. Например
Геометрическую изомерию обозначают приставками цис- и транс- (см. выше). Оптическую изомерию обозначают символами D-, L- или мезо - перед названием соединения, чтобы указать ряд, к которому оно принадлежит. Другие системы используются реже. Направление вращения плоскополяризованного света часто указывают знаком (+) для правовращающих и знаком (-) для левовращающих изомеров. Для кислот, кроме их систематических наименований, в научной литературе широко используются тривиальные названия. Некоторые важные органические кислоты перечислены ниже (табл. 5 и 6).
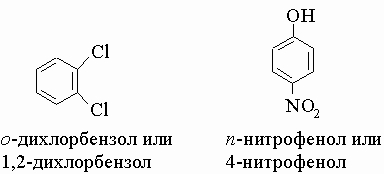
Производные бензола часто имеют тривиальные названия, которые широко распространены. Так, аминобензол называется анилином, а гидроксибензол - фенолом. Дизамещенные бензольные кольца можно называть, номеруя атомы углерода кольца, как это обсуждалось выше, или используя приставки орто (о-), мета (м-) и пара (п-) для групп, стоящих рядом, через один или два незамещенных углерода соответственно. Так,
(Подробнее см. ниже "Реакции органических соединений", разд. IV-3.A)
Промежуточные частицы. Во многих реакциях принимают участие промежуточные частицы, обладающие чрезвычайно высокой реакционной способностью. В карбанионах углерод заряжен отрицательно; карбанионы -сильные основания, они имеют тенденцию захватывать протон или атаковать положительные атомные центры. В карбений-ионах (карбкатионах) углерод заряжен положительно; карбкатионы стремятся атаковать центры с высокой электронной плотностью (атомы, олефиновые связи, ароматические системы). Карбены являются незаряженными частицами, имеющими всего лишь шесть электронов при углероде; они вступают в химические реакции, стремясь дополнить свой секстет до октета. Свободные радикалы также не заряжены, но имеют неподеленный и неспаренный электрон и также весьма реакционноспособны. Эти четыре типа реакционноспособных частиц представлены ниже простейшими их представителями, производными метана:
