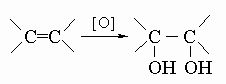
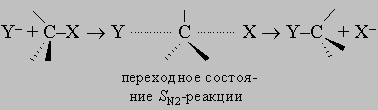
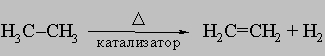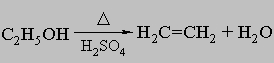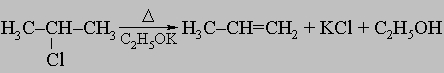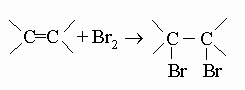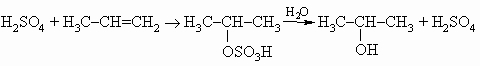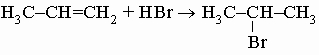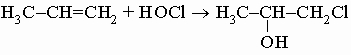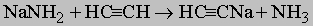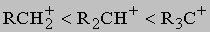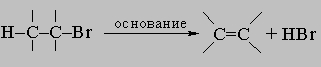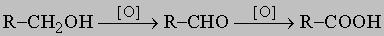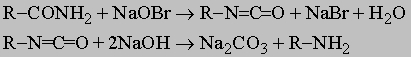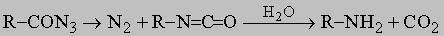ПРОМЫШЛЕННЫХ ОТХОДОВ ПЕРЕРАБОТКА - удаление бесполезных либо вредных материалов, образующихся в ходе промышленного производства. Отходы вырабатываются практически на каждой стадии промышленного технологического процесса. Степень опасности промышленных отходов изменяется от таких безвредных материалов, как песок, и до диоксинов, являющихся одними из самых токсичных веществ. Удаление вредных отходов, угрожающих как здоровью человека, так и состоянию окружающей среды, - неотложная задача мирового масштаба. Хотя вредные отходы составляют только примерно 15% всех промышленных отходов, крайняя степень наносимого некоторыми из них вреда требует, чтобы они удалялись правильно и тщательно. Вредные отходы получаются в результате таких видов деятельности, как горные работы, металлургическое производство, добыча и переработка нефти, обычная и ядерная энергетика, а также изготовление бесчисленных материалов и изделий, включая пестициды и гербициды, химические защитные средства и растворители, краски и красители, взрывчатые вещества, резина и пластмассы, целлюлоза и бумага, аккумуляторы, лекарства, ткани и кожа. Отходы образуются в виде твердых материалов, жидкостей, газов и полужидкой массы. Они включают вещества, которые могут быть токсичными, воспламеняемыми, вызывающими коррозию, химически активными, инфекционными или радиоактивными. Они могут воспламеняться или взрываться при нормальных температурах и давлениях или при контакте с воздухом или водой. Некоторые из таких отходов могут зажигаться или детонировать от статического электричества, другие - при падении или сотрясении. Некоторые отходы высокочувствительны к теплу или трению. Существуют токсичные отходы (свинец, мышьяк, кадмий, ртуть и другие тяжелые металлы), которые не поддаются переработке. При неправильном или небрежном захоронении вредные отходы могут отравить почву и водные источники.
См. также ОКРУЖАЮЩЕЙ СРЕДЫ ДЕГРАДАЦИЯ.
ПЕРЕРАБОТКА НЕРАДИОАКТИВНЫХ ОТХОДОВ
Проблема переработки вредных отходов считается самой крупной экологической проблемой века. Удаление вредных отходов - серьезная проблема в развитых, равно как и во многих развивающихся странах. В масштабе всей Земли ежегодно производится более 600 млн. т вредных промышленных отходов. Захоронение на свалках все еще считается наиболее экономичным методом удаления вредных промышленных отходов. Однако в некоторых случаях используются более эффективные методы, например термообработка и утилизация.
Свалка. Влияние свалок на окружающую среду должно быть сведено к минимуму путем правильных расположения, устройства, функционирования, обращения с фильтратами и постоянного замера параметров таких объектов. Правила устройства свалок требуют наличия подкладки, системы сбора фильтрата, системы регулирования стоков, винилового покрытия и организации постоянного замера параметров. Каждая заполненная свалка должна иметь специальное верхнее покрытие, засыпанное слоем земли.
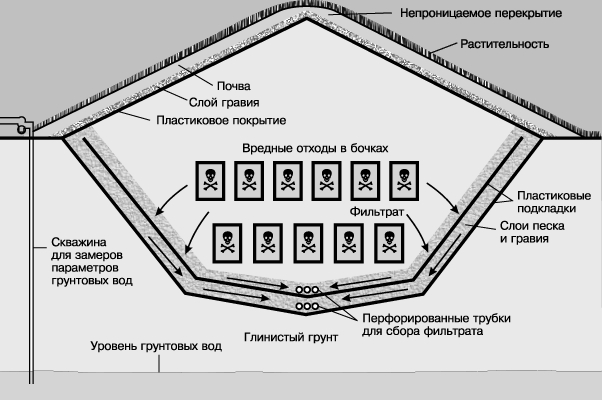
БЕЗОПАСНАЯ СВАЛКА ВРЕДНЫХ ОТХОДОВ должна включать пластиковые подкладки, систему сбора фильтрата, несколько слоев песка и гравия, систему регулирования стоков, виниловое покрытие и оборудование для постоянного замера параметров грунтовых вод.
Термообработка. Сжигание органических отходов может резко уменьшить вероятность загрязнения грунтовых вод; кроме того, вырабатываемая при этом энергия может быть ценным побочным продуктом. Среди недостатков сжигания - возможность загрязнения воздуха, эксплуатационные трудности и стоимость процесса. Главная экологическая проблема при термическом уничтожении опасных отходов - возможные выбросы веществ-загрязнителей воздуха. Для уменьшения выброса загрязнителей используются устройства для улавливания и нейтрализации вредных продуктов сгорания, а также других вредных веществ. Сжигание некоторых отходов, особенно тех, которые содержат хлорорганические соединения, в частности полихлорированные дифенилы (PCB), сопровождается выбросом в атмосферу высокотоксичных тетрахлордибензо-n-диоксина (TCDD) и полихлорированных дибензофуранов (PCDF). Однако высокоэффективное оборудование для термообработки и его правильная эксплуатация позволяют резко уменьшить образование соединений TCDD и PCDF; сжигание при высоких температурах с интенсивным перемешиванием существенно уменьшает выбросы диоксина и дибензофуранов.
См. также ЗАГРЯЗНЕНИЕ ВОЗДУХА.
Технологии термообработки. Основные виды термообработки отходов - сжигание и пиролиз. В обоих процессах используются высокие температуры как главное средство изменения химического, физического или биологического характера либо состава вредных отходов. Процесс сжигания осуществляется в присутствии достаточного количества кислорода. Побочными продуктами сжигания являются в основном вода, углекислый газ и зола; негорючие материалы, в том числе кислоты, оксиды металлов и другие неорганические соединения, собираются в золе или уносятся дымовым газом. Пиролиз - это горение в обедненной кислородом среде. Из молекул органических отходов в результате пиролиза образуются менее сложные частицы, молекулы простых органических соединений и зола; продукты пиролиза могут использоваться как сырье для химических производств и топливо. Существует несколько технологий термообработки, способных обезвреживать ядовитые отходы. Высокотемпературные процессы проводятся во вращающихся мусоросжигательных печах, печах для обжига клинкера, печах с подачей жидких отходов, судовых и мобильных печах. Низкотемпературные процессы осуществляются в топках с псевдоожиженным слоем, многотопочных печах, реакторах с расплавом солей и установках с окислением влажным воздухом. В табл. 1 приводятся рабочие параметры различных технологий термообработки.
Таблица 1.
РАБОЧИЕ ПАРАМЕТРЫ ТЕХНОЛОГИЙ ТЕРМООБРАБОТКИ
Удаление PCB. В большинстве испытаний, по которым оценивались различные конструкции отходосжигательных печей, сжигались материалы, загрязненные полихлорированными дифенилами (PCB). В случае жидкостей, содержащих более 0,05% PCB, сжигание в настоящее время является единственным приемлемым методом их удаления.
Утилизация отходов. Под утилизацией подразумевается переработка промышленных отходов в полезные сырьевые материалы и энергию. Например, теплота, выделяющаяся при сжигании опасных отходов, может быть использована для создания пара, приводящего в движение генератор электроэнергии, а свинец, извлеченный из отслуживших автомобильных аккумуляторов, - в производстве новых аккумуляторов. Значительное снижение издержек производства и расхода энергии может быть достигнуто путем утилизационной переработки таких материалов, как лом металлов (в частности, железа, стали, алюминия, меди, свинца и магния), макулатура, древесные отходы, стеклобой и пластмассовые отходы. На свалках, существующих в течение ряда лет, образуются большие количества метана по мере того, как сброшенные в них органические материалы разлагаются; на многих свалках теперь проводится отбор метана, который используется как топливо для отопления и приготовления пищи. Теоретически путем утилизационной переработки можно было бы удалять все вредные промышленные отходы. На самом деле, однако, понадобятся десятилетия для того, чтобы только приблизиться к реализации этой цели, поскольку в проектах большинства заводов не предусматривается утилизация отходов и нет отлаженных процессов переработки. Тем не менее некоторые химические предприятия уже перерабатывают часть своих вредных отходов. Комплексные системы переработки отходов. Комплексные системы переработки промышленных отходов объединяют в себе несколько упомянутых выше технологий. Горючие органические жидкие отходы сжигаются в печи, топочная камера которой имеет вместимость около 28 м3 и обеспечивает время сгорания примерно 2 с при 1370° С. После двухступенчатой скрубберной системы очистки вода из скрубберов подается на очиститель сточных вод для нейтрализации. Очень мелкие частицы твердых неорганических веществ удаляются из газообразных продуктов сгорания электростатическим осаждением. Вода из отстойника также подается на очиститель сточных вод. Твердые химически активные материалы, которые не сгорают и не растворяются в воде, упаковываются в стальные бочки и отправляются на свалку. На свалке они покрываются большой массой полужидких отходов, образующихся в очистителе сточных вод. Свалка обычно состоит из трех примыкающих друг к другу двухгектарных котлованов (выемок) с плоским дном, имеющим наклон 1%. На дно укладывают слой песка, а на откосы - специально отобранную непроницаемую глину. Дно и откосы полученной таким образом выемки застилаются армированным изолирующим покрытием на основе синтетического каучука (типа гипалона). Поверх этого покрытия насыпается слой гравия и песка, а затем настилается аналогичное изолирующее покрытие. Слой гравия и песка между двумя покрытиями служит в качестве системы обнаружения протечек, а также помогает предотвратить накопление жидкостей на нижнем покрытии. Верхнее покрытие засыпается 30-см слоем гравия, накрываемым полипропиленовой пленкой тайпар. Засыпка фильтрует полужидкие отходы, сбрасываемые позднее, обеспечивая тем самым свободный сток фильтрата в отстойник. Позже фильтрат перекачивается в установку химической нейтрализации сточных вод для обработки. Заполненная отходами свалочная выемка закрывается непроницаемым уплотненным 60-см слоем глины. Верхний 30-см слой почвы, засеянный травой для предотвращения эрозии, завершает укрытие свалки. Во время заполнения выемки, а также после ее укрытия с помощью контрольных скважин ведется наблюдение за грунтовыми водами на предмет попадания в них загрязняющих веществ.

КОМПЛЕКСНАЯ СИСТЕМА ПЕРЕРАБОТКИ ОТХОДОВ включает установку трехступенчатой очистки сточных вод с суточной производительностью 150 млн. л. (о.Дир, шт. Массачусетс).
Очиститель сточных вод обрабатывает отходы и одновременно превращает их в полужидкую массу для сброса. Предусматриваются как биологическая, так и механическая обработка жидких отходов. Поступающие в очиститель сточные воды нейтрализуются известью; кроме того, в них добавляется электролит, чтобы ускорить осаждение взвешенных твердых частиц. Очищенная от твердых частиц жидкость подается в аэротенки, где микроорганизмы и порошкообразный активированный уголь удаляют органические материалы, не подвергшиеся осаждению на предыдущей стадии очистки. Микроорганизмы разрушают вредные органические вещества, превращая их в углекислый газ, воду и разнообразные органические соединения. Эта смесь очищается посредством оседания взвешенных в ней частиц. Часть образующихся полужидких отходов повторно направляется в аэротенки, а остаток освобождается от воды пропусканием через сгуститель и фильтр. Фильтровальный осадок подается на вершину отходосжигательной печи, содержащей пять топок. Поднимающиеся горячие газы испаряют влагу из поступающей в верхнюю топку полужидкой массы. В средних, более горячих топках подвергаются пиролизу биомасса и органические материалы, адсорбированные на активированном угле; в нижних, самых горячих топках загрязненный порошкообразный уголь регенерируется в присутствии водяного пара для повторного использования в аэротенках. Описанная выше система может работать как с вредными промышленными отходами, требующими обработки и очистки, так и с отходами, которые не нуждаются в таких операциях. Первичная полужидкая масса после освобождения от воды путем фильтрации сбрасывается на свалку. Фильтрат со свалки подается в очиститель сточных вод для обработки. В конечном итоге очищенные сточные воды, содержащие некоторое количество загрязняющих веществ, сбрасываются в открытый водный бассейн.
УДАЛЕНИЕ РАДИОАКТИВНЫХ ОТХОДОВ
Ежегодное производство продуктов деления одними только атомными электростанциями по уровню радиоактивности примерно вдвое больше суммарного количества делящихся веществ во всех океанах Земли. Если все радиоактивные отходы с атомных электростанций удалять растворением в воде, то потребовалось бы 7,8*10 в 20 л воды в год, чтобы растворить продукты деления только из атомных реакторов.
См. также АТОМНАЯ ЭНЕРГЕТИКА.
Источники радиоактивных отходов. В целях правильной обработки радиоактивные отходы обычно подразделяются на отходы низкого, высокого и промежуточного уровней радиоактивности.
Отходы низкого уровня радиоактивности. Создается много низкорадиоактивных отходов, подлежащих удалению, на заводах по переработке урановой руды, в исследовательских лабораториях, в системах охлаждения и промывки атомных реакторов, в больницах, отходосжигательных печах и системах вентиляции зданий. Загрязнение этого типа обычно является легким, однако объем загрязненных отходов весьма велик.
Отходы высокого уровня радиоактивности. Высокорадиоактивные отходы представляют собой использованное ("отработавшее") топливо из ядерных реакторов, а также агрессивные жидкости, остающиеся после переработки такого топлива с целью извлечения плутония и урана. Объем высокорадиоактивных отходов относительно мал, но большая их часть остается радиоактивной в течение долгого времени.
Отходы промежуточного уровня радиоактивности. К этой категории относятся разнообразные типы отходов, не попадающие ни в одну из двух категорий, отмеченных выше. Она включает конструктивные узлы реакторов, материалы, сильно загрязненное оборудование и стоки.
Характеристики радиоактивных отходов. Физическое состояние. Выбрасываемые отходы могут быть газами или частицами, взвешенными в воздухе в форме аэрозолей. Твердые частицы выбрасываются в виде пыли или дыма; жидкие частицы обычно образуют туман. Воздушные потоки, переносящие эти аэрозоли или газы, подлежат очистке перед выбросом в атмосферу. Твердые радиоактивные отходы могут возникать в результате добычи и переработки радиоактивных руд, производства ядерных топлив, деятельности лабораторий и механической обработки материалов на заводах по производству топлив. Физические и химические процессы очистки воздуха и обработки жидкостей дают полужидкие отходы и концентраты. Радиоактивное загрязнение оборудования и рабочих тел происходит при всех указанных типах работ, и загрязненные материалы должны быть переработаны или удалены.
Радиация и распад. Радиация, существующая на свалках радиоактивных отходов, вызывается распадом атомов радиоактивных веществ, присутствующих в отходах. Столкновение продукта распада с атомом в воздухе, теле человека или материале приводит к выбиванию электрона, так что образуется положительно заряженный атом. Выбитый электрон может присоединиться к другому атому, зарядив его отрицательно. Заряженные таким образом атомы, называемые ионами, могут нарушить равновесие в тканях тела и вызвать разрушение клеток. Радиоактивные изотопы некоторых элементов имеют период полураспада, измеряющийся лишь секундами. С другой стороны, изотоп углерода 14C, широко используемый в биологических исследованиях, имеет период полураспада 5568 лет.
Таблица 2.
ХАРАКТЕРИСТИКИ РАДИОИЗОТОПОВ
Безусловно, инженеры, занимающиеся переработкой радиоактивных отходов, должны обеспечить защиту для сотен будущих поколений и составить подробное описание мест и методов переработки долгоживущих отходов.
Продукты деления реакторных топлив. В любом реакторном топливе образуются сотни продуктов деления, и их периоды полураспада имеют значения от секунд до тысяч лет. При удалении таких отходов особое внимание надо уделять долгоживущим продуктам деления, в частности изотопу стронция 90Sr и изотопу цезия 137Cs, которые опасны для живых тканей.
Методы удаления и переработки. Газообразные отходы. Поскольку радиоактивные материалы в воздухе и газах крайне опасны, для очистки несущего их воздушного потока нужно использовать высокоэффективную систему. Предельную осторожность следует проявлять при удалении загрязненного очистителя и извлекаемых из него материалов. Загрязняющие атмосферу газы могут представлять собой, например, изотоп аргона 41Ar в выходящем из атомных реакторов воздушном потоке или коррозионно-активные газы, содержащие пары кислот, которые образуются в процессах извлечения металлов, используемых в производстве ядерных топлив. Инертные газы, в частности аргон, обычно выбрасываются через дымовые трубы большой высоты и рассеиваются в атмосфере. Для обработки растворимых или химически активных газов, содержащих радиоактивные элементы или соединения, можно применять газоабсорбционные методы, в том числе насадочные колонны, твердые абсорбенты и реакции типа "твердое вещество - газ". Радиоактивные частицы или аэрозоли можно удалять с помощью обычного оборудования для воздухо- и газоочистки. Очищенный газ может выпускаться в атмосферу, однако извлеченные из него материалы становятся жидкими или твердыми отходами, которые подлежат удалению другими методами.
Жидкие отходы. Радиоактивные вещества, растворенные в воде или других жидкостях, можно удалить методами химического осаждения. Так, радиоактивный стронций быстро удаляется путем добавления нерадиоактивного стронция в качестве носителя либо путем добавления бария и свинца. Низкорадиоактивные отходы, содержащие коллоидные и взвешенные частицы твердых материалов, можно очистить обычными методами водоочистки, используя коагулянты, глину и полиэлектролиты. Фильтрование потока жидкости повышает степень очистки.
Растворимые радиоактивные отходы можно обрабатывать ионообменными смолами, анионными либо катионными, или посредством полной деминерализации. Необходима предварительная очистка жидких отходов перед вводом их в ионообменник с целью удаления всех частиц, которые могли бы покрыть слой смолы. Можно также использовать абсорбционные свойства глины для извлечения радиоактивных катионов из жидких отходов, сливаемых в почву. Удаление отработавших смол и глин - проблема удаления твердых отходов (см. ниже). Обычно отработавшие смолы сжигаются для концентрирования радиоактивных материалов в золе или же подвергаются захоронению. Загрязненные глины можно отвердить путем обжига. Выпаривание - наиболее эффективный способ разделения радиоактивных отходов на две фракции: высокорадиоактивную густую массу и незагрязненную жидкость. С этой целью использовались перегонные кубы, паровое сжатие и испарители взрывного вскипания. Сообщалось о достижении коэффициентов очистки выше 106. Процессы биохимической обработки имеют ограниченное применение, поскольку большинство радиоактивных материалов - неорганические вещества. Микроорганизмы могут концентрировать только те радиоактивные вещества, которыми они питаются. Оседание радиоактивных материалов на металлических деталях канализационной сети зданий может представлять опасность для рабочего персонала лабораторий и больниц. Для очистки таких сетей, загрязненных низкоактивными радиоизотопами, обычно используются кислотные или щелочные растворы. Сбрасывание низкорадиоактивных жидких отходов в окружающую среду вошло в практику радиоизотопных лабораторий. Высокорадиоактивные жидкие отходы надо хранить в течение многих лет, а возможно, и веков. Контейнеры с отходами хранятся под землей, чтобы предотвратить вскипание жидкости в результате выделения тепла при распаде содержащихся в них радиоактивных веществ. Захоронение жидких отходов низкого и промежуточного уровней радиоактивности в землю возможно при определенных климатических и геологических условиях. Жидкие отходы до сих пор сливались в землю через специальные колодцы, канавы и земляные отстойники. Много продуктов деления адсорбируется на почвах. В настоящее время исследуется возможность захоронения высокорадиоактивных жидких отходов в естественных и искусственных подземных пустотах, в подземных либо подводных полостях гранита, мерзлой глине или соляных шахтах и куполах.
Твердые отходы. Такие отходы могут удаляться путем захоронения, сжигания или переплавки (в случае металлических отходов). Места захоронения для удаления загрязненных твердых отходов и лома имеются в различных регионах США и России, а также во Франции, Германии, Бельгии, Швеции и других странах. Захоронение производится в котлованах или пустотах с покрытием землей либо бетоном. На выбор места захоронения влияют рельеф местности, геологическое строение пластов, почвенные, гидрологические и метеорологические характеристики и возможности доставки. Лабораторные работы могут породить большие количества сжигаемых загрязненных отходов, среди которых фильтровальная бумага, абсорбирующие материалы, одежда, перчатки, тряпки, деревянные предметы. Объем таких твердых отходов может быть уменьшен путем сжигания, причем зола и летучие радиоактивные вещества удаляются по отдельности. Сжигание горючих отходов будет использоваться и впредь как важный метод удаления. Переработка урановой руды и другие процессы в атомной промышленности ведут к появлению больших количеств загрязненного чугунного и стального оборудования. Такие материалы могут быть вновь использованы: при переплавке уран уносится со шлаком и уже не представляет опасности для здоровья.