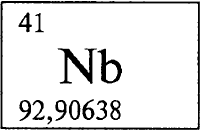ТАНТАЛ (химический элемент) - ТАНТА́Л (лат. Tantalum, по имени мифического Тантала (см. ТАНТАЛ (в мифологии))), Та (читается «тантал»), химический элемент с атомным номером 73, атомная масса 180,9479. Природный тантал состоит из стабильного изотопа 181Ta (99,988 % по массе) и радиоактивного 180Ta (0,0123%, Т1/2 1013 лет). Конфигурация двух внешних электронных слоев 5s2p6d36s2. Степень окисления +5, реже +4, +3, +2 (валентность V, IV, III и II). Расположен в группе VВ, в 6 периоде периодической системы элементов.
Радиус атома 0,146 нм, радиус ионов (координационное число 6) Та5+ - 0,078 нм, Та4+ - 0,082 нм, иона Та3+- 0,086 нм. Энергии последовательной ионизации 7,89, 16,2 эВ. Работа выхода электронов 4,12 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,5.
История открытия
Открыт в 1802 шведским химиком А. Экебергом (см. ЭКЕБЕРГ Андерс Густав). До 1844 тантал считали разновидностью колумбия, когда немецкий химик Г. Розе (см. РОЗЕ (немецкие ученые, братья)) установил, что речь идет о двух разных, близких по свойствам элементах.
Металлический тантал впервые получил в 1903-1905 В. фон Болтону.
Нахождение в природе
Содержание в земной коре 2,5·10-4% по массе. В свободном виде не встречается, обычно сопутствует ниобию. Входит в состав минералов: танталит-колумбит и пирохлор. Как примесь содержится в касситерите (см. КАССИТЕРИТ).
Получение
Промышленное получение тантала начинается с обогащения сырья. Приготовленные танталитовые (колумбитовые) или пирохлоровые концентраты с суммарным содержанием Та2О5 и Nb2O5 до 50% далее растворяют в плавиковой кислоте и затем получают фтортанталат K2TaF7 и фторниобат K2NbF7 Эти соли затем разделяют многократной дробной кристаллизацией. В последнее время для разделения ниобия и тантала все более широко используют экстракцию.
Для получения металла из K2TaF7 применяют натрийтермию:
K2TaF7+5Na=Та+2КF+5NaF.
Полученный порошкообразный тантал далее спекают в вакууме в электродуговых или электроннолучевых печах.
Физические и химические свойства
Блестящий серебристо-серый металл, с кубической объемно-центрированной решеткой типа a-Fe (а=0,3296 нм). Температура плавления 3014°C, кипения 5500°C, плотность 16,60 кг/дм3 . Характеризуется высокой химической инертностью, тяжелый металл. При комнатной температуре не реагирует с кислородом (см. КИСЛОРОД), галогенами (см. ГАЛОГЕНЫ), кислотами (см. КИСЛОТЫ) и щелочами (см. ЩЕЛОЧИ). Окисляется кислородом только при температуре выше 300°C, образуя оксид Та2О5.
При сплавлении Та2О5 с различными оксидами получают танталаты - соли гипотетических мета-НТаО3, орто-Н3ТаО4 и политанталовых кислот Н2О·хТа2О5.
Кроме оксида Та2О5, тантал образует также диоксид ТаО2.
С галогенами тантал при нагревании образует пентагалогениды ТаHal5. Восстановлением ТаHal5 (Hal=Cl, Br или I) получают тетрагалогениды ТаHal4. Пентагалогениды тантала (кроме пентафторида) легко гидролизуются водой. Уже при температурах выше 200-250°C эти пентагалогениды сублимируют.
В присутствии паров воды и кислорода ТаCl5 образует оксихлорид ТаOCl3.
Вcаимодействуя с графитом, образует карбиды Та2C и ТаC - твердые, химически стойкие и очень жаропрочные соединения. В системе Тl - С установлены три фазы переменного состава. Сходным образом ведет себя тантал в системах с фосфором,азотом и мышьяком. При взаимодействии тантала с серой синтезированы сульфиды: ТаS2 и ТаS3.
Применение
Из тантала изготовляют теплообменники, нагреватели, тигли для вакуумной плавки металлов. Применяют при изготовлении электролитических конденсаторов и ответственных деталей электронных приборов.
Благодаря хорошей биосовместимости с живыми тканями человека, используют для костного протезирования. Из нитрида тантала TaN возможно создание устойчивых к истиранию покрытий. Служит легирующей добавкой к некоторым сталям (см. СТАЛЬ). Танталат лития - хороший сегнетоэлектрик (см. СЕГНЕТОЭЛЕКТРИКИ).