ПОДГРУППА VIA. ХАЛЬКОГЕНЫ
КИСЛОРОД
Элемент кислород O восьмой элемент периодической системы элементов и первый элемент подгруппы VIA (табл. 7а). Этот элемент наиболее распространен в земной коре, составляя около 50% (масс.). В воздухе, которым мы дышим, находится ХАЛЬКОГЕНЫ20% кислорода в свободном (несвязанном) состоянии, и 88% кислорода находится в гидросфере в связанном состоянии в виде воды H2O.
Наиболее распространен изотоп 168O. Ядро такого изотопа содержит 8 протонов и 8 нейтронов. Существенно менее распространен (0,2%) изотоп c 10 нейтронами, 188O. Еще менее распространен (0,04%) изотоп с 9 нейтронами, 178O. Средневзвешенная масса всех изотопов равна 16,044. Так как атомная масса изотопа углерода с массовым числом 12 равно точно 12,000 и все другие атомные массы основаны на этом стандарте, то атомная масса кислорода по этому стандарту должна быть равна 15,9994.
Кислород двухатомный газ, как водород, азот и галогены фтор, хлор (бром и иод тоже образуют двухатомные молекулы, но они не газы). Большую часть кислорода, используемого в промышленности, получают из атмосферы. Для этого разработаны относительно недорогие методы сжижения химически очищенного воздуха с помощью циклов сжатия и охлаждения. Сжиженный воздух медленно нагревают, при этом более летучие и легко испаряемые соединения выделяются, а жидкий кислород накапливается. Такой метод называется фракционной перегонкой или ректификацией жидкого воздуха. При этом неизбежно загрязнение кислорода примесью азота, и для получения высокочистого кислорода процесс ректификации повторяют до полного удаления азота.
См. также ВОЗДУХ.
При температуре 182,96° С и давлении 1 атм кислород из бесцветного газа превращается в жидкость бледноголубого цвета. Наличие окраски свидетельствует о том, что вещество содержит молекулы с неспаренными электронами. При 218,7° C кислород твердеет. Газообразный О2 в 1,105 раз тяжелее воздуха, и при 0° C и 1 атм 1 л кислорода имеет массу 1,429 г. Газ слабо растворим в воде (ХАЛЬКОГЕНЫ0,30 см 3/л при 20° C), но это важно для существования жизни в воде. Большие массы кислорода используют в сталелитейной промышленности для быстрого удаления нежелательных примесей, прежде всего углерода, серы и фосфора, в виде оксидов в процессе обдувки или непосредственно продувкой кислорода через расплав. Одно из важных применений жидкого кислорода в качестве окислителя ракетного топлива. Кислород, хранящийся в баллонах, применяют в медицине для обогащения воздуха кислородом, а также в технике при сварке и резке металлов.
Образование оксидов. Металлы и неметаллы реагируют с кислородом с образованием оксидов. Реакции могут происходить с выделением большого количества энергии и сопровождаться сильным свечением, вспышкой, горением. Свет фотовспышки образуется при окислении алюминиевой или магниевой фольги или проволоки. Если при окислении образуются газы, то в результате выделения тепла реакции они расширяются и могут стать причиной взрыва. Не все элементы реагируют с кислородом с выделением тепла. Оксиды азота, например, образуются с поглощением тепла. Кислород реагирует с элементами, образуя оксиды соответствующих элементов а) в обычной либо б) в высокой степени окисления. Дерево, бумага и многие природные вещества или органические продукты, содержащие углерод и водород, сгорают по типу (а), образуя, например, CO, или по типу (б), образуя CO2.
Озон. Кроме атомарного (одноатомного) кислорода O и молекулярного (двухатомного) кислорода O2 существует озон вещество, молекулы которого состоят из трех атомов кислорода O3. Эти формы являются аллотропными модификациями. Пропуская тихий электрический разряд через сухой кислород, получают озон:
3O2 <=> 2O3 Озон обладает резким раздражающим запахом и часто обнаруживается вблизи электрических двигателей или генераторов тока. Озон при тех же температурах химически более активен, чем кислород. Он обычно реагирует с образованием оксидов и выделением свободного кислорода, например: Hg + O3 -> HgO + O2 Озон эффективен для очистки (дезинфекции) воды, для отбеливания тканей, крахмала, очистки масел, при сушке и выдержке древесины и чая, в производстве ванилина и камфоры. См. КИСЛОРОД.
СЕРА, СЕЛЕН, ТЕЛЛУР, ПОЛОНИЙ
При переходе от кислорода к полонию в подгруппе VIA изменение свойств от неметаллических к металлическим выражено слабее, чем у элементов подгруппы VA. Электронное строение ns2np4 халькогенов предполагает скорее прием электронов, чем их отдачу. Частичное оттягивание электронов от активного металла к халькогену возможно с образованием соединения с частично ионным характером связи, однако не такой степени ионности, как аналогичное соединение с кислородом. Тяжелые металлы образуют халькогениды с ковалентной связью, соединения окрашены и совершенно нерастворимы.
Молекулярные формы. Образование октета электронов вокруг каждого атома выполняется в элементном состоянии за счет электронов соседних атомов. В результате, например, в случае серы получается циклическая молекула S8, построенная по типу короны. Между молекулами прочной связи нет, поэтому сера при невысоких температурах плавится, кипит и испаряется. Аналогичные строение и набор свойств имеет селен, образующий молекулу Se8; теллур, возможно, образует цепочки Te8, но эта структура точно не установлена. Не ясна также и молекулярная структура полония. Сложность строения молекул определяет различные формы их существования в твердом, жидком и газообразном состоянии (аллотропия) это свойство, очевидно, является отличительной особенностью халькогенов среди других групп элементов. Наиболее устойчивой формой серы является a-форма, или ромбическая сера; вторая метастабильная форма b, или моноклинная сера, которая может превращаться в a-серу при хранении. Другие модификации серы приведены на схеме:
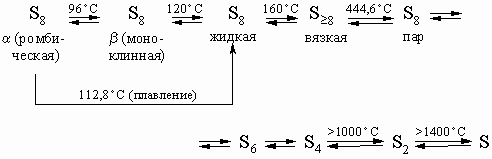
a-Cера и b-сера растворимы в CS2. Известны и другие формы серы. m-Форма вязкая жидкость, вероятно, образуется из структуры "корона", чем и объясняется ее резиноподобное состояние. При резком охлаждении или конденсации паров серы образуется порошковая сера, которую называют "серный цвет". Пары, а также пурпуровый порошок, получаемый резким охлаждением паров, по результатам исследований в магнитном поле, содержит неспаренные электроны. Для Se и Te аллотропия менее характерна, но имеет общее сходство с серой, причем модификации селена аналогичны модификациям серы.
Реакционная способность. Все элементы VIA подгруппы реагируют с одноэлектронными донорами (щелочные металлы, водород, метильный радикал ЧCH3), образуя соединения состава RMR, т.е. проявляя координационное число 2, например, HSH, CH3SCH3, NaSNa и ClSCl. Шесть валентных электронов координируются вокруг атома халькогена, два на валентной s-оболочке и четыре на валентной p-оболочке. Эти электроны могут участвовать в образовании связи с более сильным акцептором электронов (например, кислородом), который оттягивает их с образованием молекул и ионов. Таким образом, эти халькогены проявляют степени окисления II, IV, VI, образуя преимущественно ковалентные связи. В семействе халькогенов проявление степени окисления VI ослабевает с увеличением атомного номера, так как электронная пара ns2 все слабее участвует в образовании связей у более тяжелых элементов (эффект инертной пары). К соединениям с такими степенями окисления относятся SO и H2SO2 для серы(II); SO2 и H2SO3 для серы(IV); SO3 и H2SO4 для серы(IV). Аналогичные составы имеют соединения и других халькогенов, хотя есть некоторые различия. Сравнительно немного существует и нечетных степеней окисления. Методы извлечения свободных элементов из природного сырья различны для разных халькогенов. Известны большие месторождения свободной серы в горных породах, в отличие от незначительных количеств других халькогенов в свободном состоянии. Осадочную серу можно добывать геотехнологическим методом (фраш-процесс): перегретую воду или пар закачивают по внутренней трубе для плавления серы, затем расплавленную серу сжатым воздухом выдавливают на поверхность через внешнюю концентрическую трубу. Таким способом получают чистую дешевую серу на месторождениях в Луизиане и под Мексиканским заливом у побережья Техаса. Селен и теллур извлекают из газовых выбросов металлургии меди, цинка и свинца, а также из шламов электрометаллургии серебра и свинца. Некоторые заводы, на которых концентрируется селен, становятся источниками отравления животного мира. Свободная сера находит большое применение в сельском хозяйстве как порошковый фунгицид. Только в США около 5,1 млн т. серы используется ежегодно для различных процессов и химических технологий. Много серы расходуется в производстве серной кислоты.
Отдельные классы соединений халькогенов, особенно галогениды, сильно различаются по свойствам.
Водородные соединения.Водород медленно реагирует с халькогенами, образуя гидриды H2M. Существует большая разница между водой (гидрид кислорода) и гидридами других халькогенов, которые обладают отвратительным запахом и ядовиты, а их водные растворы представляют собой слабые кислоты (самая сильная из них H2Te). Металлы непосредственно реагируют с халькогенами с образованием халькогенидов (например, сульфид натрия Na2S, сульфид калия K2S). Сера в водных растворах этих сульфидов образует полисульфиды (например, Na2Sx). Гидриды халькогенов могут быть вытеснены из подкисленных растворов сульфидов металлов. Так, из подкисленных растворов Na2Sx выделяются сульфаны H2Sx (где x может быть больше 50; однако изучены только сульфаны с x Ј 6).
Галогениды. Халькогены непосредственно реагируют с галогенами, образуя галогениды различного состава. Ассортимент реагирующих галогенов и устойчивость образующихся соединений зависит от соотношения радиусов халькогена и галогена. Возможность образования галогенида с высокой степенью окисления халькогена убывает с увеличением атомной массы галогена, так как галогенид-ион будет окисляться до галогена, а халькоген восстанавливаться до свободного халькогена или галогенида халькогена в низкой степени окисления, например: TeI6 -> TeI4 + I2 Степень окисления I для серы, возможно, реализуется в соединении (SCl)2 или S2Cl2 (этот состав установлен недостаточно надежно). Наиболее необычным из галогенидов серы является SF6, отличающийся высокой инертностью. Сера в этом соединении настолько прочно экранирована атомами фтора, что даже наиболее агрессивные вещества практически не действуют на SF6. Из табл. 7б следует, что сера и селен не образуют иодидов.
Известны комплексные галогениды халькогенов, которые образуются при взаимодействии галогенида халькогена с галогенид-ионами, например,
TeCl4 + 2Cl= TeCl62.
Оксиды и оксокислоты. Оксиды халькогенов образуются при прямом взаимодействии с кислородом. Сера сгорает на воздухе или в кислороде с образованием SO2 и примеси SO3. Для получения SO3 используют другие методы. При взаимодействии SO2 с серой возможно образование SO. Селен и теллур образуют аналогичные оксиды, но они имеют существенно меньшее значение на практике. Электрические свойства оксидов селена и, особенно, чистого селена определяют рост их практического применения в электронике и электротехнической промышленности. Сплавы железа с селеном являются полупроводниками и применяются для изготовления выпрямителей. Поскольку проводимость селена зависит от освещенности и температуры, это свойство используется при изготовлении фотоэлементов и температурных датчиков. Триоксиды известны для всех элементов этой подгруппы, кроме полония. Каталитическое окисление SO2 до SO3 лежит в основе промышленного получения серной кислоты. Твердый SO3 имеет аллотропические модификации: перьевидные кристаллы, асбестоподобную структуру, льдоподобную структуру и полимерную циклическую (SO3)3. Селен и теллур растворяются в жидком SO3, образуя межхалькогенные соединения типа SeSO3 и TeSO3. Получение SeO3 и TeO3 сопряжено с определенными трудностями. SeO3 получают из газовой смеси Se и O2 в разрядной трубке, а TeO3 образуется при интенсивной дегидратации H6TeO6. Упомянутые оксиды гидролизуются или энергично реагируют с водой, образуя кислоты. Наибольшее практическое значение имеет серная кислота. Для ее получения применяют два процесса постоянно развивающийся контактный метод и устаревший башенный нитрозный метод (см. также СЕРА).
Серная кислота является сильной кислотой; она активно взаимодействует с водой с выделением тепла по реакции H2SO4 + H2O <=> H3O+ + HSO4 Поэтому следует соблюдать осторожность при разбавлении концентрированной серной кислоты, так как перегрев может вызвать выброс паров из емкости с кислотой (ожоги от серной кислоты часто связаны с добавлением в нее малого количества воды). Благодаря высокому сродству к воде H2SO4 (конц.) интенсивно взаимодействует с хлопковой одеждой, сахаром и живыми тканями человека, отнимая воду. Огромные количества кислоты используют для поверхностной обработки металлов, в сельском хозяйстве для получения суперфосфата (см. также ФОСФОР), при переработке сырой нефти до стадии ректификации, в технологии полимеров, красителей, в фармацевтической промышленности и многих других отраслях. Серная кислота наиболее важное неорганическое соединение с промышленной точки зрения. Оксокислоты халькогенов приведены в табл. 7в. Следует отметить, что некоторые кислоты существуют только в растворе, другие только в виде солей.
Среди остальных оксокислот серы важное место в промышленности занимает сернистая кислота H2SO3, образующаяся при растворении SO2 в воде слабая кислота, существующая только в водных растворах. Ее соли достаточно стабильны. Кислота и ее соли являются восстановителями и используются как "антихлораторы" для удаления избыточного хлора из отбеливателя. Тиосерная кислота и ее соли применяются в фотографии для удаления избытка непрореагировавшего AgBr из фотопленки: AgBr + S2O32 <=> [[Ag(S2O3)]]+ Br
Название "гипосульфит натрия" для натриевой соли тиосерной кислоты является неудачным, правильное название "тиосульфат" отражает структурную связь этой кислоты с серной кислотой, в которой один атом негидратированного кислорода замещен на атом серы ("тио"). Политионовые кислоты представляют интересный класс соединений, в котoром образуется цепочка атомов серы, расположенная между двумя группами SO3. Имеется много данных о производных H2S2O6, но политионовые кислоты могут содержать и большое число атомов серы. Пероксокислоты важны не только как окислители, но и как промежуточные соединения для получения пероксида водорода. Пероксодисерная кислота получается при электролитическом окислении иона HSO4на холоду. Пероксосерная кислота образуется при гидролизе пероксодисерной кислоты: 2HSO4 -> H2S2O8 + 2e
H2S2O8 + H2O -> H2SO5 + H2SO4 Ассортимент кислот селена и теллура существенно меньше. Селенистая кислота H2SeO3 получается при испарении воды из раствора SeO2. Она является окислителем в отличие от сернистой кислоты H2SO3 (восстановитель) и легко окисляет галогениды до галогенов. Электронная пара 4s2 селена неактивно участвует в образовании связи (эффект инертной пары; см. выше в разделе о реакционной способности серы), и поэтому селен легко переходит в элементное состояние. Селеновая кислота по той же причине легко разлагается с образованием H2SeO3 и Se. Атом Te имеет больший радиус и поэтому малоэффективен при образовании двойных связей. Поэтому теллуровая кислота не существует в обычной форме
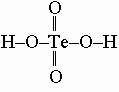
а 6 гидроксогрупп координируются теллуром с образованием H6TeO6, или Te(OH)6.
Оксогалогениды. Оксокислоты и оксиды халькогенов реагируют с галогенами и PX5, образуя оксогалогениды состава MOX2 и MO2X2. Например, SO2 реагирует с PCl5, образуя SOCl2 (тионилхлорид):
PCl5 + SO2 -> POCl3 + SOCl2
Cоответствующий фторид SOF2 образуется при взаимодействии SOCl2 и SbF3, а тионилбромид SOBr2 из SOCl2 и HBr. Сульфурилхлорид SO2Cl2 получается при хлорировании хлором SO2 (в присутствии камфоры), аналогично получают сульфурилфторид SO2F2. Хлорофторид SO2ClF образуется из SO2Cl2, SbF3 и SbCl3. Хлорсульфоновая кислота HOSO2Cl получается при пропускании хлора через дымящую серную кислоту. Аналогично образуется и фторсульфоновая кислота. Известны также оксогалогениды селена SeOCl2, SeOF2, SeOBr2.
Азот- и серусодержащие соединения. Сера образует разные соединения с азотом, многие из которых мало изучены. При обработке S2Cl2 аммиаком образуется N4S4 (тетранитрид тетрасеры), S7HN (имид гептасеры) и другие соединения. Молекулы S7HN построены как циклическая молекула S8, в которой один атом серы замещен на азот. N4S4 образуется также из серы и аммиака. Он превращается в тетраимид тетрасеры S4N4H4 при действии олова и хлороводородной кислоты. Промышленное значение имеет другое азотпроизводное сульфаминовая кислота NH2SO3H белое, негигроскопичное кристаллическое вещество. Она получается при взаимодействии мочевины или аммиака с дымящей серной кислотой. Эта кислота по силе близка к серной кислоте. Ее аммониевая соль NH4SO3NH2 используется как ингибитор горения, а соли щелочных металлов как гербициды.
Полоний. Несмотря на ограниченное количество полония, химия этого последнего элемента подгруппы VIA изучена относительно неплохо благодаря использованию его свойства радиоактивности (обычно в химических реакциях он смешивается с теллуром как носителем или сопутствующим реагентом). Период полураспада наиболее устойчивого изотопа 210Po составляет всего 138,7 сут, поэтому понятны трудности его изучения. Для получения 1 г Po требуется переработать более 11,3 т урановой смолки. 210Po можно получить нейтронной бомбардировкой 209Bi, который сначала переходит в 210Bi, а затем выбрасывает b-частицу, образуя 210Po. По-видимому, полоний проявляет такие же степени окисления, как и другие халькогены. Синтезированы гидрид полония H2Po, оксид PoO2, известны соли со степенями окисления II и IV. Очевидно, PoO3 не существует.