м.
1. Химический элемент, черновато-серые кристаллы с металлическим блеском; йод [йод 1.].
2. Лекарственный препарат, представляющий собою раствор такого вещества в спирте; йод [йод 2.].
м.
1. Химический элемент, черновато-серые кристаллы с металлическим блеском; йод [йод 1.].
2. Лекарственный препарат, представляющий собою раствор такого вещества в спирте; йод [йод 2.].
ИО́Д [ёд], иода, муж. (от греч. ioeides - фиолетовый). Химический элемент из группы металлоидов, вещество, имеющее кристалы темносерого цвета с металлическим блеском и добываемое из золы некоторых морских водорослей (хим.). При соединении с крахмалом иод дает синее окрашивание.
|| Спиртовая настойка на этом веществе - тинктура иода, применяемая в медицине как средство, дезинфицирующее или способствующее рассасыванию при воспалительных процессах.
ИО́Д см. Йод.
* * *
ио́д - йод (лат. Iodum), химический элемент VII группы периодической системы, относится к галогенам. Чёрно-серые кристаллы с металлическим блеском; плотность 4,94 г/см3, tпл 113,5ºC, tкип 184,35ºC. Уже при обычной температуре испаряется, при слабом нагревании возгоняется. В воде растворяется плохо, лучше - в органических растворителях. Промышленное сырьё - соединения иода, содержащиеся в буровых водах, морской воде. Главный потребитель - медицина: многие фармацевтические препараты, бытовой «иод» (раствор иода в спирте), радиоактивный изотоп (диагностика и лечение щитовидной железы и др.). Название от греч. iōdēs - фиолетовый (по цвету паров).
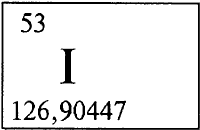
* * *
ИОД - ИО́Д (йод) (лат. Iodum), I (читается «йод»), химический элемент с атомным номером 53, атомная масса 126,9045.
Природный иод состоит только из одного нуклида - иода-127. Конфигурация внешнего электронного слоя 5s2p5. В соединениях проявляет степени окисления -1, +1, +3, +5 и +7 (валентности I, III, V и VII).
Иод расположен в пятом периоде в группе VIIА периодической системы элементов Менделеева, относится к галогенам (см. ГАЛОГЕНЫ).
Радиус нейтрального атома иода 0,136 нм, ионные радиусы I-, I5+ и I7+ равны, соответственно, 0,206, 0, 058-0,109, 0,056-0,067 нм. Энергии последовательной ионизации нейтрального атома иода равны, соответственно, 10,45, 19,10, 33 эВ. Сродство к электрону -3,08 эВ. По шкале Полинга электроотрицательность иода 2,66, иод принадлежит к числу неметаллов.
Иод при обычных условиях - твердое черно-серое вещество с металлическим блеском и специфическим запахом.
История открытия
Иод был открыт в 1811 французским химиком Б. Куртуа (см. КУРТУА Бернар), который извлекал соду (Na2CO3) и поташ (К2СО3) из золы морских водорослей. Однажды он прилил концентрированную серную кислоту к остатку маточного раствора. К его удивлению, при этом наблюдалось выделение фиолетовых паров какого-то нового вещества (назван по цвету паров: греч. iodes - фиолетовый). В 1813-14 годах Ж.-Л. Гей-Люссак (см. ГЕЙ-ЛЮССАК Жозеф Луи) и Г. Дэви (см. ДЭВИ Гемфри) доказали, что это - новое простое вещество, которому соответствует неизвестный ранее химический элемент.
Нужно отметить, что длительное время символом иода была латинская буква J. В те годы название элемента в химии записывали как «йод». И хотя после изменения знака элемента с J на I и утверждения нормы написания в химии элемента как «иод» прошло уже более 20 лет, написание «йод» сохранилось в современных словарях русского языка.
Нахождение в природе
Иод - очень редкий элемент земной коры. Его содержание в ней оценивается всего в 1,4·10-5 % (60-е место среди всех элементов). Так как иод химически достаточно активен, в свободном виде в природе он не встречается. Вместе с тем, соединения иода отличает высокая рассеяность - их микропримеси находят повсеместно. В круговороте иода в природе важную роль играет биогенная миграция. В небольших количествах иод содержится в буровых водах нефтяных и газовых скважин (откуда его и извлекают в промышленности), присутствует в морской воде (0,4·10-5 - 0,5·10-5 %). Собственные минералы иода - иодаргирит AgI, лаурит Са(IO3)2 и дитцеит 7Са(IO3)2·8CaCrO4 - крайне редки и практического значения не имеют (см. Иодиды природные (см. ИОДИДЫ ПРИРОДНЫЕ) ).
Получение иода
При получении иода разбавленные водные иодсодержащие растворы сначала обрабатывают для перевода иода в форму I2 нитритом натрия NaNO2, а выделившийся свободный иод отделяют экстракцией. Для очистки иода используют его способность легко сублимировать (см. ниже).
Физические и химические свойства
Кристаллическая решетка иода ромбическая, параметры элементарной ячейки а = 0,4792 нм, b = 0,7271 нм, с = 0,9803 нм. Температура плавления 113,5 °C, температура кипения 184,35 °C. Важная особенность иода - способность сублимироваться (переходить из твердого в парообразное состояние) уже при комнатной температуре. Плотность иода 4,930 кг/м3. Стандартный электродный потенциал I2/I- в водном растворе равен +0,535 В.
В парах, в расплаве и в кристаллах существует в виде двухатомных молекул I2. Длина связи 0,266 нм, энергия связи 148,8 кДж/моль. Степень диссоциации молекул на атомы при 727 °C - 2,8%, при 1727 °C - 89,5%.
Иод плохо растворим в воде, причем протекает обратимая реакция
I2 + H2O = HI + HIO
Хорошо растворим иод в большинстве органических растворителей (сероуглерод, углеводороды, ССl4, СНСl3, бензол, спирты, диэтиловый эфир и другие). Растворимость иода в воде увеличивается, если в воде имеются иодид-ионы I-, так как молекулы I2 образуют с иодид-ионами комплексные ионы I3-.
По реакционной способности иод - наименее активный галоген. Из неметаллов реагирует напрямую без нагревания только с фосфором (образуется РI3) и мышьяком (образуется AsI3), а также с другими галогенами. Так, с бромом иод реагирует практически без нагревания, причем образуется соединение состава IBr. При нагревании реагирует с водородом Н2 с образованием газообразного HI.
Металлы реагируют с иодом обычно при нагревании. Протеканию реакции способствует наличие паров воды или добавление жидкой воды. Так, порошок алюминия вступает в реакцию с иодом, если к порошку добавить каплю воды:
2Al + 3I2 = 2AlI3.
Интересно, что со многими металлами иод образует соединения не в высшей степени окисления атома металла, а в низшей. Так, с медью иод образует только соединение состава CuI, с железом - состава FeI2. Все иодиды металлов, кроме иодидов AgI, CuI и Hg2I2, хорошо растворимы в воде.
Иод реагирует с водным раствором щелочи, например:
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O,
а также с раствором соды:
3I2 + 3Na2CO3 = 5NaI + NaIO3 + 3CO2
Раствор иодистого водорода (см. ИОДИСТЫЙ ВОДОРОД) НI в воде - сильная (иодистоводородная (см. ИОДИСТОВОДОРОДНАЯ КИСЛОТА)) кислота, по свойствам похожая на соляную кислоту (см. СОЛЯНАЯ КИСЛОТА) . Иодноватистая кислота HIO - кислота очень слабая, существует только в разбавленных водных растворах. Также неустойчивы и ее соли - гипоиодиты.
Иодноватая кислота HIO3 представляет собой твердое вещество, в растворах ведет себя как сильная кислота. Соли этой кислоты - иодаты. Наиболее известен иодат калия KIO3, используемый в аналитической химии.
Степени окисления +7 иода отвечает иодная кислота НIO4, которая из растворов выделяется в виде дигидрата НIO4·2Н2О. Интересно, что все 5 атомов водорода в этом соединении могут быть замещены катионами металла. Например, известен периодат серебра состава Ag5IO6.
Для обнаружения иода в водных растворах используют чрезвычайно чувствительную иодкрахмальную реакцию. Синяя окраска крахмала в растворе различна и появляется, если к раствору добавить ничтожное количество иода - 1 мкг и даже менее.
Применение
Иод применяют для получения высокочистого титана, циркония, гафния, ниобия и других металлов (так называемое иодидное рафинирование металлов). При иодидном рафинировании исходный металл с примесями переводят в форму летучих иодидов, а затем полученные иодиды разлагают на раскаленной тонкой нити. Нить изготовлена из заранее очищенного металла, который подвергают рафинированию. Ее температуру подбирают такой, чтобы на нити могло происходить разложение только иодида очищаемого металла, а остальные иодиды оставались в паровой фазе.
Используют иод и в иодных лампах накаливания, имеющих вольфрамовую спираль и характеризующихся большим сроком службы. Как правило, в таких лампах пары иода находятся в среде тяжелого инертного газа ксенона (лампы часто называют ксеноновыми) и реагируют с атомами вольфрама, испаряющимися с нагретой спирали. Образуется летучий в этих условиях иодид, который рано или поздно оказывается вновь вблизи спирали. Происходит немедленное разложение иодида, и освободившийся вольфрам вновь оказывается на спирали. Иод применяют также в пищевых добавках, красителях, катализаторах, в фотографиии, в аналитической химии.
Биологическая роль
Иод относится к микроэлементам (см. МИКРОЭЛЕМЕНТЫ) и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1% иода. Иод входит в скелетный белок губок сончин и скелетопротеины морских многощетинковых червей. У животных и человека иод входит в состав гормонов щитовидной железы - тироксина (см. ТИРОКСИН) и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма (особенно - на интенсивность основного обмена, окислительные процессы, теплопродукцию). В организме среднего человека (масса тела 70 кг) содержится 12-20 мг иода, суточная потребность составляет около 0,2 мг.
Иод в медицине
В медицине используют «иодную настойку», обладающую дезинфицирующим действием. Следует иметь в виду, что обрабатывать иодной настойкой можно только небольшие раны, так как иод может вызвать омертвение ткани, что при больших ранах увеличит сроки их заживления. Микроколичества иода жизненно необходимы человеку, дефицит иода в организме приводит к заболеванию щитовидной железы - эндемическому зобу, встречающемуся в местностях с низким содержанием иода в воздухе, почве, водах. Обычно это высокогорья и области, удаленные от моря. Для того, чтобы обеспечить поступление в организм необходимых количеств иода, используют иодированную поваренную соль.
Искусственные радионуклиды иода - иод-125, иод-131, иод-132 и другие - применяются для диагностики и лечения заболеваний щитовидной железы. Однако избыточное накопление радионуклида иода-131 в щитовидной железе (что, в частности, стало возможным после аварии на Чернобыльской АЭС) может привести к онкологическому заболеванию. Для предотвращения накопления иода-131 в щитовидной железе в организм вводят немного обычного (стабильного) иода. Щитовидная железа, поглотив этот иод, им насыщается и захватывать радионуклид иод-131 более уже не в состоянии. Так что даже если затем иод-131 и попадет в организм, он будет из него быстро выведен (период полураспада иода-131 сравнительно невелик и составляет около 8 суток, так что убыль радиоактивности происходит и за счет его распада). Для того, чтобы полностью «заблокировать» щитовидную железу от накопления в ней иода-131, врачи рекомендуют раз в неделю выпивать стакан молока, в который добавлена одна капля иодной настойки. Сделует помнить, что иод токсичен и в виде I2 , и в виде иодидов.
ИОД (йод) (лат. Iodum) - I, химический элемент VII группы периодической системы, атомный номер 53, атомная масса 126,9045, относится к галогенам. Черно-серые кристаллы с металлическим блеском; плотность 4,94 г/см³, tпл 113,5 .С, tкип 184,35 .С. Уже при обычной температуре испаряется, при слабом нагревании возгоняется. В воде растворяется плохо, лучше - в органических растворителях. Промышленное сырье - соединения иода, содержащиеся в буровых водах, морской воде. Главный потребитель - медицина: многие фармацевтические препараты, бытовой "иод" (раствор иода в спирте), радиоактивный изотоп (диагностика и лечение щитовидной железы и др.). Название от греч. iodes - фиолетовый (по цвету паров).
I (iodum),
неметаллический химический элемент VIIА подгруппы периодической системы элементов, член семейства галогенов: F, Cl, Br, I, At. В 1811 Б.Куртуа, обрабатывая горячей серной кислотой сильнощелочной раствор, полученный из золы морских водорослей и используемый в производстве селитры, получил фиолетовые пары, которые при конденсации превратились в серые кристаллы. Независимо от него в 1813Х.Дэви и Ж.Гей-Люссак получили такие же кристаллы и установили элементную природу их, предложив название иод (от греческого слова, означающего "фиалкоподобный"). Иод наиболее известен в форме спиртовой настойки, используемой как антисептик. В свободном виде иод в природе не встречается, но его соединения широко распространены. Иодиды присутствуют в малых количествах в морской воде и морских водорослях, а иод входит в состав тироксина - гормона щитовидной железы. Главным промышленным источником иода являются природные газы из скважин с рассолами в Японии, отложения натриевой селитры в Чили, в которых иод присутствует в виде примеси иодата кальция, и в США в буровых водах Оклахомы и богатых минеральных источниках Мичигана.
Иодометрия. Важнейшим применением иода является метод количественного химического анализа, называемый иодометрией. Иодометрия основана на том, что иод окисляет многие вещества. Для определения количества вещества в растворе к нему добавляют заданное количество раствора иода, иод восстанавливается до иодида и окраска раствора исчезает. По количеству иода, необходимого для окисления вещества, определяют количество вещества в растворе. В другом способе к иодиду добавляют окислитель и определяют количество выделившегося иода. СВОЙСТВА ИОДА
Атомный номер 53 Атомная масса 126,9045 Изотопы
стабильные 127
нестабильные 117-126, 128-139
Температура плавления, ° С 113,5 Температура кипения, ° С 184,35 Плотность, г/см3 4,93 Твердость (по Моосу) 2,0-2,5 Содержание в земной коре, % (масс.) 0,00003 Степени окисления -1, +1, +3, +5, +7
Свойства. Иод - блестящее серое кристаллическое вещество ромбической структуры. Возгоняется при нагревании, образуя фиолетовые пары, состоящие из двухатомных молекул I2. Хотя иод плохо растворим в воде, он растворим в растворах иодидов благодаря образованию трииодид-иона I3-. Иод образует интенсивный коричневый раствор в спирте и фиолетовый в хлороформе и дисульфиде углерода. Крахмал в присутствии иода окрашивается в глубокий синий цвет, что используется как тест на иод. В ряду активности иод стоит после фтора, хлора и брома, и эти элементы вытесняют его из растворов иодидов. Фтор, хлор и бром соединяются непосредственно с иодом, образуя межгалогенные соединения, например IF7, ICl, IBr. Иод соединяется со всеми металлами, кроме благородных (например, Pt и Au), и образует иодиды типа NaI. Он соединяется с неметаллами, но не реагирует с кислородом, хотя известны оксиды иода, IO2 и I2O4 (диоксид), I2O5 (пентаоксид) и I2O3 (триоксид), который чрезвычайно неустойчив. I2O5 образуется при нагревании иодноватой кислоты.
Соединения. Иодоводород HI получают гидролизом PI3 (иодид фосфора). Реакцию проводят, добавляя воду к смеси красного фосфора и иода. Иодоводород - бесцветный газ с резким запахом, образует пары во влажной среде и легко растворяется в воде. Водный раствор называется иодоводородной кислотой; это сильная коррозионно-активная кислота, являющаяся мощным восстановителем. Иодиды некоторых металлов имеют характерную окраску, например, иодид свинца PbI2 светложелтый, а иодид ртути HgI2 алый.
Оксокислоты. Известны некоторые оксокислоты иода; они являются сильными окислителями. Иодноватистая кислота HIO очень неустойчива и разлагается на свободный иод и иодат-ион IO3-. Иодистая кислота HIO2 существует только в момент образования и разлагается; иодноватая кислота HIO3 - белое твердое вещество, хорошо растворимое в воде, ее получают при взаимодействии иода с HClO, HClO2 или с пероксидом водорода в кислой среде. Соли этой кислоты называются иодатами. Иодная кислота HIO4 - наиболее сильный окислитель из всех оксокислот галогенов. Она существует в форме гидрата HIO4*2H2O, т.е. H5IO6. Соли этой кислоты называются периодатами, они также являются сильными окислителями в кислой среде. См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
Применение. Применяемая в медицине настойка иода, т.е. раствор 2% элементного иода и 2,5% иодида натрия в спирте, широко используется как антисептик для порезов и царапин. Иод важен для нормального функционирования щитовидной железы, поэтому поваренная соль с добавками иодида натрия или иодида калия является важным диетическим компонентом. Иногда иодид калия принимают для лечения зоба, который вызывается дефицитом иода в щитовидной железе. Иодоформ CHI3 применяют для дезинфекции одежды, так как он медленно выделяет свободный иод. В промышленности иод применяют для изготовления анилиновых красителей. Иодид серебра иногда используют в фотографии.
ЛИТЕРАТУРА
Ксензенко В.И., Стасиневич Д.С. Химия и технология брома, иода и их соединений. М., 1979 Скуг Д., Уэст Д. Основы аналитической химии. М., 1979
ИОД (Iodum), I, химический элемент VII группы периодической системы, атомный номер 53, атомная масса 126,9045; относится к галогенам; фиолетовые кристаллы, легко летуч, tпл 113,5°C. Используют для получения иодсодержащих соединений, как катализатор, антисептик, для рафинирования металлов, в аналитической химии. Радиоактивные изотопы иода применяют для диагностики и лечения заболеваний щитовидной железы. Иод открыт французским химиком Б. Куртуа в 1811.
через нем. Jоd или прямо из франц. iode "иод". Иод был открыт Куртуа в 1811 г. в золе морских водорослей и назван от греч. ἰώδης "цвета фиалки", потому что при нагревании он испускает фиолетовые пары; см. Клюге-Гётце 269.
I.
ИОД а,м. iode. См.Йод.
II.
ЙОД, ИОД а, м. iode m. <гр. iodes фиолетовый.
1. Химический элемент; кристаллы черновато-серго цвета с металлическим блеском. БАС-1. Иод открыт в 1811 г. Куртуа, изучен Деви и Гей-Люссаком. ТЭ 1929 9 257. Это Бунин мог писать о том, как прочел в детстве в старой подшивке "Нивы" подпись под картинкой: "Встреча в горах с кретином" (медицинский кретинизм - результат дефицита йода в организме). Т. Толстая Не спи. // ИЛ 1995 9 207.
2. Раствор этого вещества в спирте, употребляемый в медицине. БАС-1.Теперь я мажу иодом хвостик.. и так как это горяит, то по ночам я вижу ни с чем несообразные сны. 1884. Салт. // 20-20 63. Дайте йоду, дайте йоду, Йоду капельного! Дайте парня-комсомольца Завлекательного! Астафьева 1998 119. См. также Иодин. - Лекс. САН 1847: иод; Уш. 1934: ио/д; Ож. 1949: йод.
ИОД (греч. iodes - фиолетовый). Простое тело, в виде сероватых блестящих пластинок, добывается из золы морских водорослей.
Иодаргири́т - см. Иодиды природные.
* * *
ИОДАРГИРИТ - ИОДАРГИРИ́Т, см. Иодиды природные (см. ИОДИДЫ ПРИРОДНЫЕ).
ИОДАРГИРИТ - см. Иодиды природные.
Иоди́ды - химические соединения иода с другими элементами. Иодиды металлов - соли иодоводородной кислоты HI; применяют в фотографии и медицине (см. Серебра галогениды, Калия иодид, Натрия иодид), для получения сверхчистых Ti, Hf, Zr и др. металлов термическим разложением соответственно иодидов. (см. Титана тетраиодид).
* * *
ИОДИДЫ - ИОДИ́ДЫ, химические соединения иода с другими элементами. Иодиды металлов - соли иодистоводородной кислоты HI; применяют в фотографии и медицине (см. Серебра галогениды (см. СЕРЕБРА ГАЛОГЕНИДЫ), Калия иодид (см. КАЛИЯ ИОДИД), Натрия иодид (см. НАТРИЯ ИОДИД)), для получения сверхчистых Ti, Hf, Zr и других металлов термическим разложением соответствующих иодидов (см. Титана тетраиодид (см. ТИТАНА ТЕТРАИОДИД)).
ИОДИДЫ - химические соединения иода с другими элементами. Иодиды металлов - соли иодистоводородной кислоты HI; применяют в фотографии и медицине (см. Серебра галогениды, Калия иодид, Натрия иодид), для получения сверхчистых Ti, Hf, Zr и других металлов термическим разложением соответствующих иодидов (см. Титана тетраиодид).
Иоди́ды приро́дные - группа редких минералов, солей иодоводородной кислоты: майерсит Ag3CuI4, купроиодаргирит (Cu, Ag)I; маршит CuI; иодаргирит AgI. Жёлтые с оттенками. Встречаются в окисленных медных и серебряных рудах.
* * *
ИОДИДЫ ПРИРОДНЫЕ - ИОДИ́ДЫ ПРИРО́ДНЫЕ, группа редких минералов, солей иодистоводородной кислоты (см. ИОДИСТОВОДОРОДНАЯ КИСЛОТА) : майерсит Ag3CuI4, купроиодаргирит (Cu,Ag)I; маршит CuI; иодаргирит AgI. Желтые с оттенками. Встречаются в окисленных медных (см. МЕДНЫЕ РУДЫ) и серебряных (см. СЕРЕБРЯНЫЕ РУДЫ) рудах.
ИОДИДЫ ПРИРОДНЫЕ - группа редких минералов, солей иодистоводородной кислоты: майерсит Ag3CuI4, купроиодаргирит (Cu,Ag)I; маршит CuI; иодаргирит AgI. Желтые с оттенками. Встречаются в окисленных медных и серебряных рудах.
ИОДИЗМ [ёд], иодизма, мн. нет, муж. (мед.). Отравление иодом, выражающееся в раздражении слизистой оболочки носа, горла, глаз и др.
Иоди́зм - возникающие при длительном (у чувствительных лиц - при однократном) применении препарата иода насморк и другие «простудные» заболевания, крапивница, иододерма. Обычно быстро проходит после отмены препарата.
* * *
ИОДИЗМ - ИОДИ́ЗМ, возникающие при длительном (у чувствительных лиц - при однократном) применении препарата иода насморк и другие «простудные» заболевания, крапивница (см. КРАПИВНИЦА), иододерма (см. ИОДОДЕРМА). Обычно быстро проходит после отмены препарата.
ИОДИЗМ - возникающие при длительном (у чувствительных лиц - при однократном) применении препарата иода насморк и другие "простудные" заболевания, крапивница, иододерма. Обычно быстро проходит после отмены препарата.
Отравление иодом, вследствие продолжительного приема иодистых препаратов, выражающееся некот. изменениями в коже и на слизистых оболочках.
ИОДИН а, м. iodine f. устар. То же, что иод. Выключая некоторые Аптекарские составы, на пример: хинин, иодин и т. п., все нужные химические препараты делаются в Москве и могут делаться нимало не уступая иностранным. ЖМТ 1830 3 82.
Иоди́рование - способ массовой профилактики эндемического зоба искусственным обогащением питьевой воды, поваренной соли и других пищевых продуктов соединениями иода.
* * *
ИОДИРОВАНИЕ - ИОДИ́РОВАНИЕ, способ массовой профилактики эндемического зоба (см. ЗОБ (увеличение железы)) искусственным обогащением питьевой воды, поваренной соли и других пищевых продуктов соединениями иода.
ИОДИРОВАНИЕ - способ массовой профилактики эндемического зоба искусственным обогащением питьевой воды, поваренной соли и других пищевых продуктов соединениями иода.
- Способ массовой профилактики эндемического зоба искусственным обогащением питьевой воды, поваренной соли и других пищевых продуктов.
Ио́дистоводоро́дная кислота́ - то же, что иодоводородная кислота.
* * *
ИОДИСТОВОДОРОДНАЯ КИСЛОТА - ИОДИСТОВОДОРО́ДНАЯ КИСЛОТА́, раствор иодистого водорода в воде, очень сильная кислота (сильнее, чем HCl и HBr). Чистая - бесцветная, на свету желтеет или буреет (окисляется с выделением иода). Соли иодистоводородной кислоты - иодиды.
ИОДИСТОВОДОРОДНАЯ КИСЛОТА - раствор иодистого водорода в воде, очень сильная кислота (сильнее, чем HCl и HBr). Чистая - бесцветная, на свету желтеет или буреет (окисляется с выделением иода). Соли иодистоводородной кислоты - иодиды.
Ио́дистый водоро́д - то же, что иодоводород.
* * *
ИОДИСТЫЙ ВОДОРОД - ИО́ДИСТЫЙ ВОДОРО́Д, HI, бесцветный газ, с резким неприятным запахом, дымящий на воздухе; tпл 50,8 °С, tкип 35,36 °С. Хорошо растворим в воде. Восстановитель.
ИОДИСТЫЙ ВОДОРОД - HI, бесцветный газ, с резким неприятным запахом, дымящий на воздухе; tпл 50,8 .С, tкип 35,36 .С. Хорошо растворим в воде. Восстановитель.
Иодометри́я - титриметрический метод количественного анализа восстановителей (прямым титрованием раствором I2 в присутствии KI, называется часто иодиметрией) и окислителей (косвенным титрованием - по количеству I2, образовавшегося при их взаимодействии с раствором KI).
* * *
ИОДОМЕТРИЯ - ИОДОМЕ́ТРИЯ, титриметрический метод анализа, основанный на окислении исследуемого вещества иодом. Включает методы прямого (раствором I2 в водном растворе KI) и обратного (избыток I2 оттитровывают раствором Na2S2O3) титрования.
ИОДОМЕТРИЯ - титриметрический метод анализа, основанный на окислении исследуемого вещества иодом. Включает методы прямого (раствором I2 в водном растворе KI) и обратного (избыток I2 оттитровывают раствором Na2S2O3) титрования.
ИОДОФОРМ [ёд], иодоформа, мн. нет, муж. (хим. апт.) Приготовленный из препаратов иода ядовитый кристалический порошок желтого цвета с резким неприятным запахом, применяемый в медицине как дезинфицирующее средство.
Иодофо́рм - CHI3, жёлтые кристаллы, tпл 123ºC. Антисептик (применяется ограниченно из-за неприятного запаха).
* * *
ИОДОФОРМ - ИОДОФО́РМ, CHI3, желтые кристаллы, tпл 123 °С. Антисептик (применяется ограниченно из-за неприятного запаха).
ИОДОФОРМ - CHI3, желтые кристаллы, tпл 123 .С. Антисептик (применяется ограниченно из-за неприятного запаха).
ИОДОФОРМ (греч.-лат.). Одно из соединений иода, употребляемое, как антисептическое средство, при лечении ран и язв. Имеет вид желтого порошка.