ПОДГРУППА VB. СЕМЕЙСТВО ВАНАДИЯ
ВАНАДИЙ, НИОБИЙ, ТАНТАЛ
Различие в химических и физических свойствах среди членов этого семейства переходных металлов ванадия V, ниобия Nb и тантала Ta несколько больше, чем отмеченное у элементов подгруппы IVB. Например, более тяжелые элементы Nb и Ta имеют одинаковый радиус, но последний элемент вдвое тяжелее (табл. 12), что приводит к резкому увеличению плотности Ta по сравнению с Nb. Все элементы подгрупп IVB и VB имеют высокие температуры плавления, что свойственно элементам, расположенным в середине периодов. Ниобий отличается необычностью электронного строения, так как имеет единственный электрон на внешней s-орбитали (4d45s1). Это можно объяснить сильным взаимодействием положительного заряда ядра с 5s-электронами, из-за чего один из них втягивается на 4d-орбиталь. Однако химическое поведение ниобия в норме соответствует электронной конфигурации 4d35s2, так что различие свойств Nb и Ta невелико. Между Nb и Ta больше сходства, чем между V и Nb, что понятно при идентичности радиусов. При обычной температуре все эти металлы инертны, благодаря чему применяются в сплавах для производства специального обрабатывающего инструмента и коррозионностойких емкостей. Все элементы подгруппы проявляют максимальную степень окисления V. Соединения с низшими степенями окисления (II и III) стабильнее у более легкого элемента ванадия, чем у более тяжелых Nb и Ta. Соединения ванадия(II) хорошие восстановители, они даже выделяют водород из воды. Различие в окислительной способности этих металлов проявляется в том, что сильные восстановители типа Zn и HCl восстанавливают VV до VII, NbV до NbIV, но не действуют на TaV. (Для элементов любого семейства, в котором существует поливалентность, легкие члены семейства всегда имеют стабильные высокие степени окисления, а тяжелые, как правило, легко переходят из состояния с высокой степенью окисления в более стабильное состояние с низкой степенью окисления.)
В степени окисления V элементы обычно образуют бесцветные соединения, а в низших степенях окисления ионы и соединения сильно окрашены. Окраска определяется подвижностью электронов нижних электронных слоев под действием света. Ионы в одинаковом состоянии часто имеют одинаковую окраску.
Структура соединений, образованных V, Nb и Ta, сильно зависит от степени окисления металла и типа электронных оболочек, участвующих в образовании связи. При образовании комплексных соединений металлы проявляют высокие координационные числа (число ассоциированных у металла групп). Так, Ta образует необычные фторокомплексные ионы [[TaF8]]3 и [[TaF7]]2.
Выделение из руд. Элементы V, Nb и Ta очень трудно получить в чистом виде из их руд и непросто восстановить из ионных состояний до свободного металла. Руду ванадинит Pb5(VO4)3Cl обрабатывают HCl до образования нерастворимого PbCl2 и растворимого ванадил(V)-иона VO2+. При добавлении к раствору NH4Cl выпадает осадок NH4VO3, который при прокаливании образует V2O5 исходное вещество для получения металла и многих соединений ванадия. Металлический ванадий получают восстановлением его оксида алюминием. Свободный металл может быть получен также из подкисленных хлороводородной кислотой растворов Na3VO4 или NaVO3 методом электролиза. Для использования в сплавах применяют неочищенный феррованадий FeV, получающийся прокаливанием V2O5 с железным ломом. Феррованадий имеет более низкую температуру плавления, чем чистый ванадий, и поэтому он предпочтительнее для легирования расплавов стали.
См. также
Ниобий и тантал выделяют из их руд сплавлением с содой или KHSO4 с последующей экстракцией водой с образованием водорастворимой фазы. Разделение двух химически сходных металлов может быть достигнуто обработкой раствора KF, который эффективно осаждает K2(TaF7), при этом большая часть ниобия остается в растворе в виде K2(NbOF5). Для разделения этих комплексов также применяется жидкостная экстракция.
Применение.Металлический тантал в отличие от ниобия находит разнообразное применение. Электролизом фторокомплекса K2TaF7 получают свободный тантал. Благодаря химической инертности, высокой коррозионной стойкости, а также хорошей теплопроводности его используют в производстве хирургических шин, винтов, пластин, тонких сеток и др., предназначенных для имплантации в живой организм. Трубы, приемники и другое химико-технологическое оборудование часто изготовляют из тантала для работы с коррозионно-активными парами и жидкостями. С помощью тантало-свинцово-сернокислотного выпрямителя получают пульсирующий ток. Кроме того, тантал применяют как добавку к стали и для получения сплава с вольфрамом, используемого в электровакуумной технике. Карбид TaC очень твердое вещество, используемое для изготовления специальных сверл и других режущих инструментов. Ванадий применятся как легирующий элемент в сталях.
Химические свойства. При низких температурах все эти металлы устойчивы к кислороду и большинству реагентов. Это отчасти удивительно, так как все они имеют положительные окислительные потенциалы. Однако на поверхности рассматриваемых металлов легко образуется пассивирующая пленка, что повышает инертность и затрудняет измерение потенциалов. Ванадий активнее ниобия и тантала. При нагревании все эти металлы взаимодействуют с кислородом HNO3 и NaOH. При действии NaOH на ванадий образуется NaVO3 и выделяется водород.
Реакции. Все члены этого семейства образуют пентаоксиды, слаборастворимые в воде и дающие слабокислую реакцию. Пентаоксид ванадия V2O5 наиболее важен как промышленный катализатор окисления SO2 в SO3 (контактный метод производства серной кислоты), окисления спиртов и гидрогенизации масел в жиры:
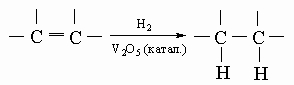
Красно-оранжевый оксид ванадия наиболее удобно получать термическим разложением ванадата аммония NH4VO3:
2NH4VO3 -> V2O5 + 2NH3 + H2O.
Амфотерный характер ванадия проявляется при растворении V2O5 в NaOH с образованием ортованадата Na3VO4. При добавлении NH4+ в раствор образуется метаванадат аммония NH4VO3, что необычно, так как ион аммония, как правило, не является восстановителем. При изменении кислотности ванадатных растворов протекают процессы конденсации или полимеризации оксоанионов с образованием соединений, называемых изополисолями и изополикислотами, например, [[V3O8]] триполиванадат(V), [[V4O9]]2 тетраполиванадат(V), [[V6O17]]4 гексаполиванадат(V). Пентаоксиды Nb и Ta образуются при прямом окислении. Они достаточно устойчивы к действию восстановителей (см. выше). Пентаоксид ванадия восстанавливается до VO2 при нагревании со щавелевой кислотой H2C2O4. Монооксид углерода и водород восстанавливают V2O5 до V2O3 и даже до VO. Все эти оксиды окрашены.
Галогениды. Все металлы подгруппы VB образуют пентагалогениды, но между ними существуют различия в свойствах. Пентафторид ванадия VF5 (белого цвета) единственный пентагалогенид ванадия, другие галогениды ванадия(V) неустойчивы из-за окислительной способности Vv. В табл. 12а указано, из чего могут быть синтезированы некоторые галогениды ванадия и ниобия.
Галогениды с низшей и высшей степенью окисления элемента образуются по реакциям диспропорционирования из галогенидов с промежуточной степенью окисления металла. Способы получения и свойства галогенидов тантала и ниобия аналогичны. Все галогениды подвергаются гидролизу с образованием оксогалогенидов по схеме VF5 + H2O = VOF3 + 2HF
При взаимодействии оксидов, например V2O5, с галогенами (Cl2 или Br2) также образуются оксогалогениды (VOCl3 или VOBr3).
Cульфиды. При взаимодействии V2O5 с CS2, очевидно, получается только V2S3, а не V2S5; трисульфид образуется также при действии сухого H2S на V2O3. Дисульфид тантала TaS2 образуется из Ta2O5 и CS2. VS образуется при гидрировании V2S3.
Нестехиометрические гидриды. При нагревании кусочков металла с водородом образуются гидриды нестехиометрического состава; хотя при этом и выделяется тепло, но сомнительно, что образуются истинные соединения. По результатам анализов отношение металл: водород составляет примерно 1:0,8.