м.
Химический элемент, металл серебристо-белого цвета, входящий в состав известняка, мрамора и т.п., применяющийся в металлургии, строительстве, медицине.
м.
Химический элемент, металл серебристо-белого цвета, входящий в состав известняка, мрамора и т.п., применяющийся в металлургии, строительстве, медицине.
КА́ЛЬЦИЙ, кальция, мн. нет, муж. (от лат. calx - известь) (хим.). Химический элемент - металл серебристо-белого цвета, содержащийся в извести.
КА́ЛЬЦИЙ, -я, муж. Химический элемент, мягкий серебристо-белый металл.
| прил. кальциевый, -ая, -ое. Кальциевые соли.
КАЛЬЦИЙ - муж. металл, составляющий химическую основу извести. Кальцинировать что, пережигать металл, соль или камень. Кальцинация жен. действие это, пережиг, перекалка.
КА́ЛЬЦИЙ, -я, м
Химический элемент, щелочной металл, серебристо-белого цвета; при обычной температуре легко окисляется воздухом и влагой, поэтому его хранят в минеральном масле или в герметически закрытых сосудах.
Металлический кальций применяется в металлургии; соединения кальция: известь, гипс, алебастр, мел, известняк, мрамор и другие, а также содержащие кальций искусственные силикаты - цемент, стекло - широко употребляются как строительные материалы.
КА́ЛЬЦИЙ -я; м. [от лат. calx (calcis) - известь] Химический элемент (Ca), металл серебристо-белого цвета, входящий в состав известняков, мрамора и др.
◁ Ка́льциевый, -ая, -ое. К-ые соли.
* * *
ка́льций (лат. Calcium), химическая элемент II группы периодической системы, относится к щёлочноземельным металлам. Название от лат. calx, родительный падеж calcis - известь. Серебристо-белый металл, плотность 1,54 г/см3, tпл 842ºC. При обычной температуре легко окисляется на воздухе. По распространённости в земной коре занимает 5-е место (минералы кальцит, гипс, флюорит и др.). Как активный восстановитель служит для получения U, Th, V, Cr, Zn, Be и других металлов из их соединений, для раскисления сталей, бронз и т. д. Входит в состав антифрикционных материалов. Соединения калькия применяют в строительстве (известь, цемент), препараты кальция - в медицине.
* * *
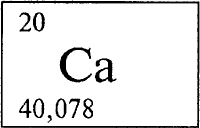
КАЛЬЦИЙ - КА́ЛЬЦИЙ (лат. Calcium), Ca (читается «кальций»), химический элемент с атомным номером 20, расположен в четвертом периоде в группе IIА периодической системы элементов Менделеева; атомная масса 40,08. Относится к числу щелочноземельных элементов (см. ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ).
Природный кальций состоит из смеси нуклидов (см. НУКЛИД) с массовыми числами 40 (в смеси по массе 96,94 %), 44 (2,09%), 42 (0,667%), 48 (0,187%), 43 (0,135%) и 46 (0,003%). Конфигурация внешнего электронного слоя 4s2. Практически во всех соединениях степень окисления кальция +2 (валентность II).
Радиус нейтрального атома кальция 0,1974 нм, радиус иона Cа2+ от 0,114 нм (для координационного числа 6) до 0,148 нм (для координационного числа 12). Энергии последовательной ионизации нейтрального атома кальция равны, соответственно, 6,133, 11,872, 50,91, 67,27 и 84,5 эВ. По шкале Полинга электроотрицательность кальция около 1,0. В свободном виде кальций - серебристо-белый металл.
История открытия
Соединения кальция встречаются в природе повсеместно, поэтому человечество знакомо с ними с древнейших времен. Издавна в строительном деле находила применение известь (см. ИЗВЕСТЬ) (негашеная и гашеная), которую долгое время считали простым веществом, «землей». Однако в 1808 английский ученый Г. Дэви (см. ДЭВИ Гемфри) сумел получить из извести новый металл. Для этого Дэви подверг электролизу смесь слегка увлажненной гашеной извести с окисью ртути и выделил из образующейся на ртутном катоде амальгамы новый металл, который он назвал кальцием (от лат. calx, род. падеж calcis - известь). В России некоторое время этот металл называли «известковием».
Нахождение в природе
Кальций - один из наиболее распространенных на Земле элементов. На его долю приходится 3,38% массы земной коры (5-е место по распространенности после кислорода, кремния, алюминия и железа). Из-за высокой химической активности кальций в свободном виде в природе не встречается. Большая часть кальция содержится в составе силикатов (см. СИЛИКАТЫ) и алюмосиликатов (см. АЛЮМОСИЛИКАТЫ) различных горных пород (граниты (см. ГРАНИТ), гнейсы (см. ГНЕЙС) и т. п.). В виде осадочных пород соединения кальция представлены мелом и известняками, состоящими в основном из минерала кальцита (см. КАЛЬЦИТ) (CaCO3). Кристаллическая форма кальцита - мрамор - встречается в природе гораздо реже.
Довольно широко распространены такие минералы кальция, как известняк (см. ИЗВЕСТНЯК) СaCO3, ангидрит (см. АНГИДРИТ) CaSO4 и гипс (см. ГИПС) CaSO4·2H2O, флюорит (см. ФЛЮОРИТ) CaF2, апатиты (см. АПАТИТЫ) Ca5(PO4)3(F,Cl,OH), доломит (см. ДОЛОМИТ) MgCO3·СaCO3. Присутствием солей кальция и магния в природной воде определяется ее жесткость (см. ЖЕСТКОСТЬ ВОДЫ). Значительное количество кальция входит в состав живых организмов. Так, гидроксилапатит Ca5(PO4)3(OH), или, в другой записи, 3Ca3(PO4)2 ·Са(OH)2 - основа костной ткани позвоночных, в том числе и человека; из карбоната кальция CaCO3 состоят раковины и панцири многих беспозвоночных, яичная скорлупа и др.
Получение
Металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80%) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170-1200 °C:
4CaO + 2Al = CaAl2O4 + 3Ca.
Физические и химические свойства
Металл кальций существует в двух аллотропных модификациях (см. Аллотропия (см. АЛЛОТРОПИЯ)). До 443 °C устойчив a-Ca с кубической гранецентрированной решеткой (параметр а = 0,558 нм), выше устойчив b-Ca с кубической объемно центрированной решеткой типа a-Fe (параметр a = 0,448 нм). Температура плавления кальция 839 °C, температура кипения 1484 °C, плотность 1,55 г/см3.
Химическая активность кальция высока, но ниже, чем всех других щелочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло серая, поэтому в лаборатории кальций обычно хранят, как и другие щелочноземельные металлы, в плотно закрытой банке под слоем керосина.
В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca2+/Ca0 -2,84 В, так что кальций активно реагирует с водой:
Ca + 2Н2О = Ca(ОН)2 + Н2.
С активными неметаллами (кислородом, хлором, бромом) кальций реагирует при обычных условиях:
2Са + О2= 2СаО; Са + Br2= CaBr2.
При нагревании на воздухе или в кислороде кальций воспламеняется. С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
Са + Н2= СаН2 (гидрид кальция),
Ca + 6B = CaB6 (борид кальция),
3Ca + N2= Ca3N2 (нитрид кальция)
Са + 2С = СаС2 (карбид кальция)
3Са + 2Р = Са3Р2 (фосфид кальция), известны также фосфиды кальция составов СаР и СаР5;
2Ca + Si = Ca2Si (силицид кальция), известны также силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты (т. е. эти реакции - экзотермические). Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:
СаН2 + 2Н2О = Са(ОН)2 + 2Н2,
Ca3N2 + 3Н2О = 3Са(ОН)2 + 2NН3.
Оксид кальция - типично основной. В лаборатории и технике его получают термическим разложением карбонатов:
CaCO3 = CaO + CO2.
Технический оксид кальция СаО называется негашеной известью.
Он реагирует с водой с образованием Ca(ОН)2 и выделением большого количества теплоты:
CaО + Н2О = Ca(ОН)2.
Полученный таким способом Ca(ОН)2 обычно называют гашеной известью или известковым молоком (см. ИЗВЕСТКОВОЕ МОЛОКО) из-за того, что растворимость гидроксида кальция в воде невелика (0,02 моль/л при 20°C), и при внесении его в воду образуется белая суспензия.
При взаимодействии с кислотными оксидами CaO образует соли, например:
CaО +СО2 = СаСО3; СаО + SO3 = CaSO4.
Ион Ca2+ бесцветен. При внесении в пламя солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, средний ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Важное значение имеет то обстоятельство, что в отличие от среднего карбоната кальция СаСО3 кислый карбонат кальция (гидрокарбонат) Са(НСО3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение:
СаСО3 + СО2+ Н2О = Са(НСО3)2.
В тех же местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция:
Са(НСО3)2 = СаСО3 + СО2+ Н2О.
Так в природе происходит перенос больших масс веществ. В результате под землей могут образоваться огромные провалы (см. Карст (см. КАРСТ (явление природы))), а в пещерах образуются красивые каменные «сосульки» - сталактиты (см. СТАЛАКТИТЫ (минеральные образования)) и сталагмиты (см. СТАЛАГМИТЫ).
Наличие в воде растворенного гидрокарбоната кальция во многом определяет временную жесткость воды (см. ЖЕСТКОСТЬ ВОДЫ). Временной ее называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает СаСО3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь.
Применение кальция и его соединений
Металлический кальций применяют для металлотермического получения урана (см. УРАН (химический элемент)), тория (см. ТОРИЙ), титана (см. ТИТАН (химический элемент)), циркония (см. ЦИРКОНИЙ), цезия (см. ЦЕЗИЙ) и рубидия (см. РУБИДИЙ).
Природные соединения кальция широко используют в производстве вяжущих материалов (цемент (см. ЦЕМЕНТ), гипс (см. ГИПС), известь и др.). Связывающее действие гашеной извести основано на том, что с течением времени гидроксид кальция реагирует с углекислым газом воздуха. В результате протекающей реакции образуются игольчатые кристаллы кальцита СаСОз, которые прорастают в расположенные рядом камни, кирпичи, другие строительные материалы и как бы сваривают их в единое целое. Кристаллический карбонат кальция - мрамор - прекрасный отделочный материал. Мел используют для побелки. Большие количества известняка расходуются при производстве чугуна, так как позволяют перевести тугоплавкие примеси железной руды (например, кварц SiO2) в сравнительно легкоплавкие шлаки.
В качестве дезинфицирующего средства очень эффективна хлорная известь (см. ХЛОРНАЯ ИЗВЕСТЬ) - «хлорка» Ca(OCl)Cl - смешанный хлорид и гипохлорид кальция (см. КАЛЬЦИЯ ГИПОХЛОРИТ), обладающий высокой окислительной способностью.
Широко применяется и сульфат кальция, существующий как в виде безводного соединения, так и в виде кристаллогидратов - так называемого «полуводного» сульфата - алебастра (см. АЛЕВИЗ ФРЯЗИН (Миланец)) CaSO4·0,5H2O и двухводного сульфата - гипса CaSO4·2H2O. Гипс широко используют в строительстве, в скульптуре, для изготовления лепнины и различных художественных изделий. Применяют гипс и в медицине для фиксации костей при переломах.
Хлорид кальция CaCl2 используют наряду с поваренной солью для борьбы с оледенением дорожных покрытий. Фторид кальция СаF2 - прекрасный оптический материал.
Кальций в организме
Кальций - биогенный элемент (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ), постоянно присутствующий в тканях растений и животных. Важный компонент минерального обмена животных и человека и минерального питания растений, кальций выполняет в организме разнообразные функции. В составе апатита (см. АПАТИТ), а также сульфата и карбоната кальций образует минеральный компонент костной ткани. В организме человека массой 70 кг содержится около 1 кг кальция. Кальций участвует в работе ионных каналов (см. ИОННЫЕ КАНАЛЫ), осуществляющих транспорт веществ через биологические мембраны, в передаче нервного импульса (см. НЕРВНЫЙ ИМПУЛЬС), в процессах свертывания крови (см. СВЕРТЫВАНИЕ КРОВИ) и оплодотворения. Регулируют обмен кальция в организме кальциферолы (см. КАЛЬЦИФЕРОЛЫ) (витамин D). Недостаток или избыток кальция приводит к различным заболеваниям - рахиту (см. РАХИТ), кальцинозу (см. КАЛЬЦИНОЗ) и др. Поэтому пища человека должна в нужных количествах содержать соединения кальция (800-1500 мг кальция в сутки). Содержание кальция высоко в молочных продуктах (таких, как творог, сыр, молоко), в некоторых овощах и других продуктах питания. Препараты кальция широко используются в медицине.
КАЛЬЦИЙ (лат. Calcium) - Ca, химический элемент II группы периодической системы, атомный номер 20, атомная масса 40,078, относится к щелочноземельным металлам. Название от латинского calx, родительный падеж calcis - известь. Серебристо-белый металл, плотность 1,54 г/см³, tпл 842 .С. При обычной температуре легко окисляется на воздухе. По распространенности в земной коре занимает 5-е место (минералы кальцит, гипс, флюорит и др.). Как активный восстановитель служит для получения U, Th, V, Cr, Zn, Be и других металлов из их соединений, для раскисления сталей, бронз и т. д. Входит в состав антифрикционных материалов. Соединения кальция применяют в строительстве (известь, цемент), препараты кальция - в медицине.
-я, м.
Химический элемент, металл серебристо-белого цвета, входящий в состав известняков, мрамора и др.
[От лат. calx, calcis - известь]
Ca (calcium),
химический элемент, относится к семейству щелочноземельных металлов Be, Mg, Ca, Sr, Ba, Ra, составляющих IIA подгруппу периодической системы элементов. Открыт Х.Дэви в 1808. Кальций - третий после алюминия и железа из наиболее распространенных металлов в земной коре, его получают преимущественно из известняка (карбонат кальция). Ведущими производителями кальция являются Австрия, Бразилия, Канада, Финляндия, Израиль и Норвегия. СВОЙСТВА КАЛЬЦИЯ
Атомный номер 20 Атомная масса 40,08 Изотопы
стабильные 40, 42, 43, 44, 46, 48
нестабильные 38, 39, 41, 45, 49
Температура плавления, ° С 842 Температура кипения, ° С 1495 Плотность, г/см3 1,55 Твердость (по Моосу) 1,5 Содержание в земной коре, % (масс.) 3,63 Степени окисления +2
Свойства. Кальций имеет в разрезе серебристо-белый цвет, но на воздухе тускнеет из-за образования оксида на его поверхности. Это пластичный металл тверже свинца. Кальций при нагревании в вакууме подвергается сублимации при температурах ниже точки плавления. Он умеренно растворим в воде, но плохо растворяется в этиловом спирте. При горении на воздухе образует оксид CaO и нитрид Ca3N2; нагретый металл непосредственно реагирует с галогенами. В соединениях кальций всегда двухвалентен.
Применение. Главное применение кальция - это использование его как восстановителя при получении металлов, особенно никеля, меди и нержавеющей стали. Кальций и его гидрид используются также для получения трудновосстанавливаемых металлов, таких, как хром, торий и уран. Сплавы кальция со свинцом находят применение в аккумуляторных батареях и подшипниковых сплавах. Кальциевые гранулы используются также для удаления следов воздуха из электровакуумных приборов.
Соединения. Кальций образует множество соединений. В отличие от ограниченного применения металлического кальция, его соединения широко применяются с тех пор, как первобытный человек использовал в качестве убежища известняковые пещеры. Оксид кальция CaO - наиболее важный промышленный продукт, служащий исходным сырьем для производства других полезных соединений кальция. CaO имеет несколько коммерческих названий: известь, жженая известь, негашеная известь. Чистый оксид кальция - белое кристаллическое вещество, термостойкий (т.пл. 2630° С). Оксид получают обжигом известняка и мела, при котором удаляют выделяющийся углекислый газ; процесс ведут в шахтных печах с использованием в качестве топлива древесины, угля, нефти или газа; в результате получаются пористые куски жженой извести. При хранении на влажном воздухе жженая известь поглощает углекислый газ и влагу, превращаясь в рыхлую гашеную известь (пушонку). При добавлении воды к CaO выделяется много тепла и образуется гашеная известь (гидроксид кальция). При нагревании оксида кальция с диоксидом кремния или силикатами образуется силикат кальция (см. ниже). Жженую известь широко используют в строительстве для приготовления кладочных и штукатурных растворов, для получения хлорной извести, при выделке кожи, медицинских препаратов и кормов. Гидроксид кальция Ca(OH)2 в виде белого порошка образуется при гашении извести. Он слабо растворим в воде, насыщенный раствор известен под названием "известковая вода", а при избытке гидроксида кальция образуется белая взвесь - "известковое молоко". Ca(OH)2 является основанием и поглощает углекислый газ из воздуха. Гидроксид кальция используется в медицине (в основном для понижения кислотности), в производстве штукатурки, кладочных строительных растворов, цемента, клеевых красок и удаления волоса со шкур при выделке кожи. Известковый кладочный раствор готовят смешением гашеной извести с песком при добавлении воды до получения пластичной массы. Раствор служит вяжущим веществом при возведении стен, так как на воздухе происходит реакция гашеной извести с углекислым газом воздуха с образованием карбоната кальция и выделением воды, поэтому раствор твердеет. Штукатурный раствор ведет себя аналогично. Карбонат кальция CaCO3 в природе распространен в форме минералов известняка или мрамора. Он является основой кальцита, мела, кораллов, яичной скорлупы, раковин морских животных. Доломит - смешанный карбонат кальция и магния. Карбонат кальция используют для приготовления цемента и бетона. Цемент готовят прокаливанием тонкой смеси карбоната кальция (известняк, мел или мергель) с силикатом (глина, сланец) или доменным шлаком. Если цемент смешать с песком и гравием или щебнем и добавить воды до получения пластичной массы, то образуется бетон. Этот материал твердеет и в отсутствие углекислого газа. Карбонат кальция нерастворим в чистой воде, но растворяется в воде, насыщенной углекислым газом, так как при этом образуется растворимая кислая соль Ca(HCO3)2. При кипячении раствора происходит выделение углекислого газа и нерастворимый карбонат кальция выпадает в осадок. Этими реакциями объясняется образование накипи при использовании жесткой воды в чайниках, отопительных системах или бойлерах. Аналогичные реакции происходят в природе, приводя к образованию карстовых промоин в известняке и росту сталактитов и сталагмитов. Жесткая вода содержит бикарбонат или сульфат кальция и (или) магния. При стирке и кипячении в жесткой воде на мыле образуется осадок, блокируя способность мыла к удалению грязи.
Сульфат кальция CaSO4 существует в природе в виде минерала ангидрита. Дигидрат CaSO4*2H2O является важным промышленным минералом, известным под названиями гипс, алебастр, селенит и шелковистый шпат. Гипс добавляют в цемент для уменьшения скорости схватывания, его используют для изготовления пишущих мелков, сельскохозяйственной побелки, в качестве наполнителя красок, полировального порошка и для глянцевания бумаги. При 165-200° C гипс теряет 75% гидратной воды и образует штукатурный гипс. При увлажнении происходит поглощение воды и схватывание массы. Поскольку при затвердевании гипс слегка расширяется, он воспроизводит все тонкие детали любого объекта, на который нанесен, образуя слепок, и поэтому широко используется в изготовлении скульптур, хирургических и зубных слепков, производстве штукатурки и стеновых покрытий. Гипс, прокаленный до полного удаления гидратной воды, используется как высокотвердый поделочный материал. Специально приготовленный безводный сульфат кальция применяется для осушки газов и органических жидкостей, причем он легко регенерируется при нагревании.
Другие серусодержащие соединения. Сульфит кальция CaSO3 и бисульфит кальция Ca(HSO3)2 используются для отбеливания древесной массы в целлюлозно-бумажной промышленности, для предотвращения закисления при ферментации и вместо тиосульфата натрия для отбеливания тканей. Сульфид кальция CaS получают прокаливанием смесей сульфата кальция с углеродом или карбоната кальция с серой. Сульфид применяется для приготовления люминофоров и для удаления волосяного покрова со шкур в кожевенной промышленности.
Галогениды. Хлорид кальция CaCl2 получают из природных насыщенных соляных вод (рапы) или как побочный продукт производства соды по методу Сольве. Его можно получить также по реакции оксида или карбоната кальция с соляной кислотой. При комнатной температуре из раствора кристаллизуется бесцветный расплывающийся на воздухе гексагидрат CaCl2Ч6H2O. При прокаливании гексагидрат теряет воду и переходит последовательно в дигидрат, моногидрат и безводную соль. Эти соединения легко поглощают влагу и поэтому используются как осушители, а также в качестве соляной добавки для плавления снега и льда или для рассеяния тумана. Раствор хлорида кальция используют как антифриз для опрыскивания дорог и в шахтах, как хладагент в холодильных установках, при изготовлении цемента, огнестойких тканей и в огнетушителях. Фармакопейный хлорид кальция широко применяется в медицине, например для остановки кровотечения и увеличения свертываемости крови. Бромид CaBr2 и иодид CaI2 по химическим свойствам похожи на хлорид и применяются в фотографии и медицине. Фторид кальция, встречающийся в природе в виде минерала флюорита, или плавикового шпата, является основным сырьем для получения фтора. Фторид практически нерастворим в воде в отличие от других галогенидов.
Хлорная (белильная) известь. Состав этого вещества в основном соответствует формуле CaOCl2 (сложная смесь хлорида и гипохлорита кальция). Это вещество получают, подавая газообразный хлор снизу через раствор гашеной извести, непрерывно впрыскиваемый во вращающийся аппарат сверху. Хлорная известь - беловатый порошок с сильным запахом хлора. При выдерживании на воздухе он поглощает влагу и углекислый газ и выделяет хлор. Обычный коммерческий продукт содержит около 35% активного хлора (количество хлора, выделяющееся при взаимодействии с соляной кислотой). Хлорная известь используется для отбеливания тканей и древесной массы, для дезинфекции питьевой воды и обезвреживания сточных вод. Еще недавно ее применяли вместо хлора и гипохлорита кальция для отбеливания тканей. Гипохлорит кальция Ca(ClO)2, часто называемый просто гипохлоритом, - белый негигроскопичный порошок с запахом хлора, содержит около 99% активного хлора и поэтому вдвое эффективнее хлорной извести. Он прост в употреблении и хорошо сохраняется. Применяется так же, как и хлорная известь.
Фосфаты. Средний фосфат кальция Ca3(PO4)2 существует в природе в виде минерала фосфорита и является важным компонентом костей животных. Фосфат кальция служит сырьем для получения других фосфатов, фосфора, его соединений, используется в производстве фарфора, эмалей, молочного стекла. Гидрофосфат кальция CaHPO4 применяется как кормовая добавка скоту, в качестве цемента и пасты в стоматологии, как удобрение. Дигидрофосфат кальция Ca(H2PO4)2, или суперфосфат, лучше растворим в воде, чем другие, трех- или двухосновные соли, и поэтому пригоден для быстрой подкормки растений. Карбид кальция CaC2 получают восстановлением CaO коксом, древесным углем или антрацитом в электрической печи. При добавлении воды карбид разлагается с выделением ацетилена. При нагревании карбида кальция в среде азота можно получить цианамид кальция.
См. также УГЛЕРОД. Цианамид кальция CaCN2 - прежде одно из важнейших соединений для фиксации атмосферного азота, теперь в основном используется как удобрение и для цементации стали. При парофазном гидролизе в автоклаве цианамид выделяет аммиак; если его прокаливать в смеси с хлоридом натрия и углеродом, то образуется цианид натрия NaCN, широко используемый для извлечения золота из руд. Арсенат кальция Ca3(AsO4)2 - белый порошок, образующийся по реакции между хлоридом кальция, гидроксидом кальция и арсенатом аммония. Это вещество - распространенный инсектицид, широко применяемый при опылении хлопковых полей для уничтожения вредных насекомых. Силикат кальция CaSiO3 широко распространен в природе в виде минерала волластонита. Он является основным содержимым шлака, образующегося в металлургическом процессе при выплавке металлов из руд. Если в руде имеется избыток песка, то при выплавке добавляют известняк и, наоборот, при избытке известняка в руде добавляют песок; соответственно образующийся силикат кальция в виде шлака собирается на поверхности расплавленного металла и удаляется из печи. В природе существуют также силикаты кальция иного состава.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Родякин В.В. Кальций, его соединения и сплавы. М., 1967 Фрумина Н.С. и др. Аналитическая химия кальция. М., 1974
мед. кальций (calcium)
Содержится в организме в больших количествах.
- Необходим для крепости зубов и костей. Предотвращает болезненное истощение костей и развитие остеопороза, необходим для нормального развития скелета и ногтей.
- Нужен для нормальной работы мышц и нервной системы.
- Нужен для регулирования сердечного ритма и артериального давления (вместе с магнием).
- Играет важную роль в обмене веществ кожи, в свертывании крови.
В организме содержится около 1,5 кг кальция. 99% из этого количества - в костях и зубах. 1% играет жизненно важную роль для нормальной работы всех систем организма, и в случае необходимости его дефицит восполняется за счет кальция костных тканей.
Кальций усваивается только в желудке и должен приниматься вместе с едой.
Мультивитаминные добавки не обеспечивают вас достаточным количеством кальция.
Хороший источник кальция и магния - яйца, сардины, тунец, молочные продукты (йогурт, молоко, творог и твердые сыры), овощи с темно-зелеными листьями (листовая капуста, свекольные листья), орехи, семечки.
Соли кальция организм получает из молока, творога, сметаны, зернобобовых (горох, фасоль, бобы).
см. тж микроэлементы
Заимств. в начале XIX в. из англ. яз., где calcium является неологизмом химика Г. Дэви, суф. производным от лат. calx «известь». См. калька (1) (материал для снятия копий).
- «Стройматериал» для костей.
- Щёлочноземельный металл.
- «Коралловый» металл.
- Химический элемент, Ca.
- В результате круговорота солей этого металла в природе образовались знаменитые Ново-Афонские пещеры.
- Раковины морских моллюсков массивнее, чем у пресноводных, ведь этого элемента в морской воде куда больше.
- В России некоторое время этот металл называли «известковием».