м.
Химический элемент, легкий серебристо-белый металл.
СТРО́НЦИЙ, -я, муж. Химический элемент, лёгкий серебристо-белый металл. Радиоактивный изотоп стронция.
| прил. стронциевый, -ая, -ое.
СТРОНЦИЙ - муж. один из химически открытых металлов, схожий с барием; стронциан, -нная, -новая земля, окись стронция. Стронцит, - цианит, углекислый стронциан.
СТРО́НЦИЙ, -я, м
Химический элемент, серебристо-белый легкий металл.
В результате ядерных испытаний, аварий на АЭС с радиоактивными отходами в окружающую среду попадает радиоактивный изотоп стронция; он накапливается в скелете человека и животных.
СТРО́НЦИЙ -я; м. [лат. strontium] Химический элемент (Sr), лёгкий серебристо-белый металл, радиоактивные изотопы которого применяются в ядерных испытаниях и в технике.
◁ Стро́нциевый, -ая, -ое.
* * *
стро́нций (лат. Strontium), химический элемент II группы периодической системы, относится к щёлочноземельным металлам. Назван по минералу стронцианиту, найденному около деревни Строншиан (Strontian) в Шотландии. Серебристо-белый металл; плотность 2,63 г/см3, tпл 768°C. Химически очень активен, поэтому сам металл применяют мало (при выплавке меди и бронз для их очистки, в электровакуумной технике как геттер), соли - в производстве красок, светящихся составов, глазурей и эмалей. SrTiO3 - сегнетоэлектрик. При ядерных взрывах, в ядерных реакторах образуется радиоактивный изотоп 90Sr (период полураспада 29,1 года), представляющий большую опасность для человека при попадании его в природную среду.
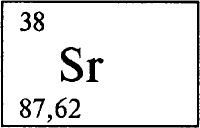
* * *
СТРОНЦИЙ - СТРО́НЦИЙ (лат. Strontium, от деревни Srtrontian в Шотландии, близ которой был найден), химический элемент с атомным номером 38, атомная масса 87,62. Химический символ Sr, читается «стронций». Расположен в 5 периоде в группе IIА периодической системы элементов. Щелочноземельный металл. Природный стронций состоит из четырех стабильных изотопов с массовыми числами 84 (0,56% по массе), 86 (9,86%), 87 (7,02%) и 88 (82,56%).
Конфигурация внешнего электронного слоя 5s2. Степень окисления +2 (валентность II). Радиус атома 0,215 нм, радиус иона Sr2+0,132 нм (координационное число 6). Энергии последовательной ионизации 5,6941 и 11,0302 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,0.
Стронций - мягкий серебристо-белый сравнительно легкий металл.
История открытия
В 1764 в свинцовом руднике был обнаружен новый минерал - стронцианит. В 1890 англичанин А. Кроуфорд и, одновременно с ним, англичанин Т. Хоп, немецкий химик М. Клапрот (см. КЛАПРОТ Мартин Генрих) и российский академик Т. Е. Ловиц (см. ЛОВИЦ Товий Егорович) выделили из стронцианита оксид нового элемента. В 1808 амальгаму стронция получил английский химик Г. Дэви (см. ДЭВИ Гемфри).
Распространенность в природе
Содержание в земной коре 0,034% по массе. В свободном виде не встречается. Важнейшие минералы: стронцианит (см. СТРОНЦИАНИТ) и целестин (см. ЦЕЛЕСТИН) SrSO 4. Как примесь, содержится в минералах кальция, например, во фторапатите 3Са 3 (РО4) 2 · СаF2.
Получение
Основной источник сырья при получении стронция и его соединений - целестин SrSO4 - сначала восстанавливают углем при сильном нагревании:
SrSO4 + 4С = SrS + 4СО
Затем сульфид стронция SrS соляной кислотой (см. СОЛЯНАЯ КИСЛОТА) переводят в SrCl2и обезвоживают его. Для получения Sr его хлорид восстанавливают магнием (см. МАГНИЙ) в атмосфере водорода:
SrCl2 + Mg = MgCl2+ Sr
Стронций получают также восстановлением SrO алюминием (см. АЛЮМИНИЙ), кремнием (см. КРЕМНИЙ) или ферросилицием:
4SrO + 2Al = 3Sr + SrAl2O4
Физические и химические свойства
Стронций - мягкий серебристо-белый металл, существующий в трех модификациях. До 231°C устойчива a-модификация с кубической гранецентрированной решеткой типа Cu, а = 0,6085 нм. При 231-623°C - b-модификация с гексагональной решеткой, при 623°C до температуры плавления (768°C) - g-модификация с кубической объемно центрированной решеткой. Температура кипения 1390°C, плотность 2,63 кг/дм3. Стронций ковкий, пластичный металл.
Стронций химически высокоактивен. Стандартный электродный потенциал Sr2+/Sr - 2,89 В.
При комнатной температуре на воздухе стронций покрывается пленкой из оксида SrO и пероксида SrO2. При нагревании на воздухе воспламеняется. Взаимодействуя с галогенами, (см. ГАЛОГЕНЫ) образует галогениды SrCl2 и SrBr2. При нагревании до 300-400°C реагирует с водородом (см. ВОДОРОД), образуя гидрид SrH2. Нагревая стронций в атмосфере CO2, получают:
5Sr + 2CO2 = SrC2+ 4SrO
Стронций активно реагирует с водой:
Sr + 2Н2О = Sr(ОН)2 + Н2
При нагревании стронций взаимодействует с азотом, серой, селеном и другими неметаллами с образованием нитрида Sr3N2, сульфида SrS, селенида SrSe и так далее.
Оксид стронция - основной, взаимодействует с водой, образуя гидроксид:
SrО + Н2О = Sr(ОН)2
При взаимодействии с кислотными оксидами SrO образует соли:
SrО +СО2 = SrСО3
Ионы Sr2+ бесцветны. Хлорид SrCl2, бромид SrBr2, иодид SrI2, нитрат Sr(NO3)2 хорошо растворимы в воде и окрашивают пламя в карминово-красный цвет. Нерастворимы карбонат SrCO3, сульфат SrSO4, средний ортофосфат Sr3(PO4)2.
Применение
Стронций используется, как легирующая добавка к сплавам на основе магния, алюминия, свинца, никеля и меди. Cтронций входит в состав геттеров. Соединения стронция используются в пиротехнике, входят в состав люминесцентных материалов, эмиссионных покрытий радиоламп, используются при изготовлении стекол.
Титанат стронция SrTiO3 используется при изготовлении диэлектрических антенн, пьезоэлементов, малогабаритных нелинейных конденсаторов, в качестве датчиков инфракрасного излучения. Препараты 90Sr используются при лучевой терапии кожных и некоторых глазных болезней.
Физиологическое действие
Соединения стронция токсичны. При попадании в организм возможно поражение костной ткани и печени. ПДК стронция в воде 8 мг/л, в воздухе для гидроксида, нитрата и оксида 1 мг/м3, для сульфата и фосфата 6 мг/м3.
Проблемы 90 Sr
При взрывах ядерных зарядов или из-за утечки радиоактивных отходов в окружающую среду поступает радиоактивный изотоп 90Sr. Образуя хорошо растворимый в воде гидрокарбонат Sr(HCO3)2, 90Sr мигрирует в воду, почву, растения и организмы животных.
СТРОНЦИЙ (лат. Strontium) - Sr, химический элемент II группы периодической системы, атомный номер 38, атомная масса 87,62, относится к щелочноземельным металлам. Назван по минералу стронцианиту, найденному около д. Строншиан (Strontian) в Шотландии. Серебристо-белый металл; плотность 2,63 г/см³, tпл 768 .С. Химически очень активен, поэтому сам металл применяют мало (при выплавке меди и бронз для их очистки, в электровакуумной технике как геттер). Соли - в производстве красок, светящихся составов, глазурей и эмалей. SrTiO3 - сегнетоэлектрик. При ядерных взрывах, в ядерных реакторах образуется радиоактивный изотоп 90Sr (период полураспада 27,7 лет), представляющий большую опасность для человека при попадании его в природную среду.
-я, м.
Химический элемент, легкий серебристо-белый металл, радиоактивные изотопы которого применяются в научных исследованиях и в технике.
[лат. strontium]
стро́нций, стро́нции, стро́нция, стро́нциев, стро́нцию, стро́нциям, стро́нцием, стро́нциями, стро́нциях
СТРОНЦИЙ (ново-лат.). Легкий металл желтого цвета, названный так по имени деревни в Шотландии, в окрестностях которой открыт впервые; в соединении с углекислотою образует минерал стронцианит.
- Щёлочноземельный металл.
- Этот элемент обнаружили в минерале, найденном в 1764 году на свинцовом руднике близ шотландской деревни Строншиан.
- В 1890 году оксид этого нового элемента получили одновременно четыре химика в разных странах.
- Соли этого металла горят красными бенгальскими огнями, а в природе образуют минерал небесно-голубого цвета целестин.
- Химический элемент, Sr.