м.
Химический элемент, тёмно-серые кристаллы с металлическим блеском, являющийся составной частью большинства горных пород.
м.
Химический элемент, тёмно-серые кристаллы с металлическим блеском, являющийся составной частью большинства горных пород.
КРЕ́МНИЙ, кремния, мн. нет, муж. (хим.). Химический элемент, входящий в состав большинства горных пород.
КРЕ́МНИЙ, -я, муж. Химический элемент, тёмно-серые кристаллы с металлическим блеском, одна из главных составных частей горных пород.
| прил. кремниевый, -ая, -ое.
КРЕ́МНИЙ, -я, м
Химический элемент, темно-серые с металлическим блеском, кристаллы которого входят в состав большинства горных пород.
Кремний используется в производстве фотоэлементов, транзисторов как важнейший полупроводниковый материал. Кремний составляет 27,6 % массы земной коры.
КРЕ́МНИЙ -я; м. [от греч. krēmnos - утёс, скала] Химический элемент (Si), тёмно-серые с металлическим блеском кристаллы которого входят в состав большинства горных пород.
◁ Кре́мниевый, -ая, -ое. К-ые соли. Кре́мни́стый (см. 2.К.; 1 зн.).
* * *
кре́мний (лат. Silicium), химический элемент IV группы периодической системы. Тёмно-серые кристаллы с металлическим блеском; плотность 2,33 г/см3, tпл 1415ºC. Стоек к химическим воздействиям. Составляет 27,6% массы земной коры (2-е место среди элементов), главные минералы - кремнезём и силикаты. Один из важнейших полупроводниковых материалов (транзисторы, термисторы, фотоэлементы). Составная часть многих сталей и других сплавов (повышает механическую прочность и устойчивость к коррозии, улучшает литейные свойства).

* * *
КРЕМНИЙ - КРЕ́МНИЙ (лат. Silicium от silex - кремень), Si (читается «силициум», но в настоящее время довольно часто и как «си»), химический элемент с атомным номером 14, атомная масса 28,0855. Русское название происходит от греческого kremnos - утес, гора.
Природный кремний состоит из смеси трех стабильных нуклидов (см. НУКЛИД) с массовыми числами 28 (преобладает в смеси, его в ней 92,27% по массе), 29 (4,68%) и 30 (3,05%). Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кремния 3s2р2. В соединениях обычно проявляет степень окисления +4 (валентность IV) и очень редко +3, +2 и +1 (валентности соответственно III, II и I). В периодической системе Менделеева кремний расположен в группе IVA (в группе углерода), в третьем периоде.
Радиус нейтрального атома кремния 0,133 нм. Энергии последовательной ионизации атома кремния 8,1517, 16,342, 33,46 и 45,13 эВ, сродство к электрону 1,22 эВ. Радиус иона Si4+ при координационном числе 4 (наиболее распространенном в случае кремния) 0,040 нм, при координационном числе 6 - 0,054 нм. По шкале Полинга электроотрицательность кремния 1,9. Хотя кремний принято относить к неметаллам, он по ряду свойств занимает промежуточное положение между металлами и неметаллами.
В свободном виде - коричневый порошок или светло-серый компактный материал с металлическим блеском.
История открытия
Соединения кремния были известны человеку с незапамятных времен. Но с простым веществом кремнием человек познакомился всего около 200 лет тому назад. Фактически первыми исследователями, получившими кремний, были французы Ж. Л. Гей-Люссак (см. ГЕЙ-ЛЮССАК Жозеф Луи)и Л. Ж. Тенар (см. ТЕНАР Луи Жак) . Они в 1811 обнаружили, что нагревание фторида кремния с металлическим калием приводит к образованию буро-коричневого вещества:
SiF4+ 4K = Si + 4KF, однако сами исследователи правильного вывода о получении нового простого вещества не сделали. Честь открытия нового элемента принадлежит шведскому химику Й. Берцелиусу (см. БЕРЦЕЛИУС Йенс Якоб), который для получения кремния нагревал также с металлическим калием соединение состава K2SiF6. Он получил тот же аморфный порошок, что и французские химики, и в 1824 объявил о новом элементарном веществе, которое назвал «силиций». Кристаллический кремний был получен только в 1854 году французским химиком А. Э. Сент-Клер Девилем (см. СЕНТ-КЛЕР ДЕВИЛЬ Анри Этьен) .
Нахождение в природе
По распространенности в земной коре кремний среди всех элементов занимает второе место (после кислорода). На долю кремния приходится 27,7% массы земной коры. Кремний входит в состав нескольких сотен различных природных силикатов (см. СИЛИКАТЫ)и алюмосиликатов (см. АЛЮМОСИЛИКАТЫ). Широко распространен и кремнезем, или кремния диоксид (см. КРЕМНИЯ ДИОКСИД) SiO2 (речной песок (см. ПЕСОК) , кварц (см. КВАРЦ) , кремень (см. КРЕМЕНЬ) и др.), составляющий около 12% земной коры (по массе). В свободном виде кремний в природе не встречается.
Получение
В промышленности кремний получают, восстанавливая расплав SiO2 коксом при температуре около 1800°C в дуговых печах. Чистота полученного таким образом кремния составляет около 99,9%. Так как для практического использования нужен кремний более высокой чистоты, полученный кремний хлорируют. Образуются соединения состава SiCl4 и SiCl3H. Эти хлориды далее очищают различными способами от примесей и на заключительном этапе восстанавливают чистым водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают летучий моносилан SiH4. Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000°C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Физические и химические свойства
Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si-Si по сравнению с длиной связи С-С твердость кремния значительно меньше, чем алмаза.
Плотность кремния 2,33 кг/дм3. Температура плавления 1410°C, температура кипения 2355°C. Кремний хрупок, только при нагревании выше 800°C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному (ИК)-излучению.
Элементарный кремний - типичный полупроводник (см. ПОЛУПРОВОДНИКИ) . Ширина запрещенной зоны при комнатной температуре 1,09 эВ. Концентрация носителей тока в кремнии с собственной проводимостью при комнатной температуре 1,5·1016 м-3. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы - бора (см. БОР (химический элемент)), алюминия (см. АЛЮМИНИЙ), галлия (см. ГАЛЛИЙ) и индия (см. ИНДИЙ), с электронной проводимостью - добавки элементов V-й группы - фосфора (см. ФОСФОР), мышьяка (см. МЫШЬЯК) или сурьмы (см. СУРЬМА). Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400-500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом - с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом - силаны (см. СИЛАНЫ) с общей формулой SinH2n+2 - получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Ca2Si + 4HCl = 2CaCl2 + SiH4
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (-Si-Si-Si-).
С азотом кремний при температуре около 1000°C образует нитрид Si3N4, с бором - термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева - углерода - карбид кремния SiС (карборунд (см. КАРБОРУНД) ) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды (см. СИЛИЦИДЫ) . Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000°C). Наиболее часто образуются металлоподобные силициды составов MSi, M3Si2, M2Si3, M5Si3 и MSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
Диоксид кремния SiO2- кислотный оксид, не реагирующий с водой. Существует в виде нескольких полиморфных модификаций (кварц (см. КВАРЦ), тридимит, кристобалит, cтеклообразный SiO2). Из этих модификаций наибольшее практическое значение имеет кварц. Кварц обладает свойствами пьезоэлектрика (см. ПЬЕЗОЭЛЕКТРИЧЕСКИЕ МАТЕРИАЛЫ) , он прозрачен для ультрафиолетового (УФ) излучения. Характеризуется очень низким коэффициентом теплового расширения, поэтому изготовленная из кварца посуда не растрескивается при перепадах температуры до 1000 градусов.
Кварц химически стоек к действию кислот, но реагирует с плавиковой кислотой:
SiO2 + 6HF =H2[SiF6] + 2H2O
и газообразным фтороводородом HF:
SiO2 + 4HF =SiF4 + 2H2O
Эти две реакции широко используют для травления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты (см. СИЛИКАТЫ) - соли не имеющих постоянного состава очень слабых нерастворимых в воде кремниевых кислот (см. КРЕМНИЕВЫЕ КИСЛОТЫ) общей формулы xH2O·ySiO2 (довольно часто в литературе не очень точно пишут не о кремниевых кислотах, а о кремниевой кислоте, хотя фактически речь при этом идет об одном и том же). Например, может быть получен ортосиликат натрия:
SiO2 + 4NaOH = (2Na2O)·SiO2 +2H2O,
метасиликат кальция:
SiO2 + СаО = СаО·SiO2
или смешанный силикат кальция и натрия:
Na2CO3 + CaCO3 + 6SiO2 = Na2O·CaO·6SiO2 + 2CO2
Из силиката Na2O·CaO·6SiO2 изготовляют оконное стекло.
Следует отметить, что большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют растворимым стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
Главным структурным элементом как твердого диоксида кремния, так и всех силикатов выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырех атомов кислорода О. При этом каждый атом кислорода соединен с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
При восстановлении SiO2 кремнием при высоких температурах образуется монооксид кремния состава SiO.
Для кремния характерно образование кремнийорганических соединений (см. КРЕМНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ) , в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода -О-, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Применение
Кремний используют как полупроводниковый материал. Кварц находит применение как пьезоэлектрик, как материал для изготовления жаропрочной химической (кварцевой) посуды, ламп УФ-излучения. Силикаты находят широкое применение как строительные материалы. Оконные стекла представляют собой аморфные силикаты. Кремнийорганические материалы характеризуются высокой износостойкостью и широко используются на практике в качестве силиконовых масел, клеев, каучуков, лаков.
Биологическая роль
Для некоторых организмов кремний является важным биогенным элементом (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ). Он входит в состав опорных образований у растений и скелетных - у животных. В больших количествах кремний концентрируют морские организмы - диатомовые водоросли (см. ДИАТОМОВЫЕ ВОДОРОСЛИ), радиолярии (см. РАДИОЛЯРИИ), губки (см. ГУБКИ) . Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань - 17·10-4%, кровь - 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния не ядовиты. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в легкие, в них кристаллизуются, а возникающие кристаллики разрушают легочную ткань и вызывают тяжелую болезнь - силикоз (см. СИЛИКОЗ). Чтобы не допустить попадания в легкие этой опасной пыли, следует использовать для защиты органов дыхания респиратор.
КРЕМНИЙ (лат. Silicium) - Si, химический элемент IV группы периодической системы, атомный номер 14, атомная масса 28,0855. Темно-серые кристаллы с металлическим блеском; плотность 2,33 г/см³, tпл 1415 .С. Стоек к химическим воздействиям. Составляет 27,6% массы земной коры (2-е место среди элементов), главные минералы - кремнезем и силикаты. Один из важнейших полупроводниковых материалов (транзисторы, термисторы, фотоэлементы). Составная часть многих сталей и других сплавов (повышает механическую прочность и устойчивость к коррозии, улучшает литейные свойства).
-я, м.
Химический элемент, входящий в состав большинства горных пород.
[От греч. κρημνός - утес, скала]
Si (silicium)
химический элемент IVA подгруппы (C, Si, Ge, Sn и Pb) периодической системы элементов, неметалл. Кремний в свободном виде был выделен в 1811 Ж.Гей-Люссаком и Л.Тенаром при пропускании паров фторида кремния над металлическим калием, однако он не был описан ими как элемент. Шведский химик Й.Берцелиус в 1823 дал описание кремния, полученного им при обработке калиевой соли K2SiF6 металлическим калием при высокой температуре, однако лишь в 1854 кремний был получен в кристаллической форме А.Девилем. Кремний - второй по распространенности (после кислорода) элемент в земной коре, где он составляет более 25% (масс.). Встречается в природе в основном в виде песка, или кремнезема, который представляет собой диоксид кремния, и в виде силикатов (полевые шпаты M[[AlSi3O8]] (M = Na, K, Ba), каолинит Al4[[Si4O10]](OH)8, слюды). Кремний можно получить прокаливанием измельченного песка с алюминием или магнием; в последнем случае его отделяют от образующегося MgO растворением оксида магния в соляной кислоте. Технический кремний получают в больших количествах в электрических печах путем восстановления кремнезема углем или коксом. Полупроводниковый кремний получают восстановлением SiCl4 или SiHCl3 водородом с последующим разложением образующегося SiH4 при 400-600° С. Высокочистый кремний получают выращиванием монокристалла из расплава полупроводникового кремния по методу Чохральского или методом бестигельной зонной плавки кремниевых стержней
(см. также ЗОННАЯ ПЛАВКА).
Элементный кремний получают в основном для полупроводниковой техники, в остальных случаях он используется как легирующая добавка в производстве сталей и сплавов цветных металлов (например, для получения ферросилиция FeSi, который образуется при прокаливании смеси песка, кокса и оксида железа в электрической печи и применяется как раскислитель и легирующая добавка в производстве сталей и как восстановитель в производстве ферросплавов). Применение. Наибольшее применение кремний находит в производстве сплавов для придания прочности алюминию, меди и магнию и для получения ферросилицидов, имеющих важное значение в производстве сталей и полупроводниковой техники. Кристаллы кремния применяют в солнечных батареях и полупроводниковых устройствах - транзисторах и диодах. Кремний служит также сырьем для производства кремнийорганических соединений, или силоксанов, получаемых в виде масел, смазок, пластмасс и синтетических каучуков. Неорганические соединения кремния используют в технологии керамики и стекла, как изоляционный материал и пьезокристаллы.
См. также КРЕМНИЙОРГАНИЧЕСКИЕ ПОЛИМЕРЫ. СВОЙСТВА КРЕМНИЯ
Атомный номер 14 Атомная масса 28,086 Изотопы
стабильные 28, 29, 30
нестабильные 25, 26, 27, 31, 32, 33
Температура плавления, ° С 1410 Температура кипения, ° С 2355 Плотность, г/см3 2,33 Твердость (по Моосу) 7,0 Содержание в земной коре, % (масс.) 27,72 Степени окисления -4, +2, +4
Свойства. Кремний - темносерое, блестящее кристаллическое вещество, хрупкое и очень твердое, кристаллизуется в решетке алмаза. Это типичный полупроводник (проводит электричество лучше, чем изолятор типа каучука, и хуже проводника - меди). При высокой температуре кремний весьма реакционноспособен и взаимодействует с большинством элементов, образуя силициды, например силицид магния Mg2Si, и другие соединения, например SiO2 (диоксид кремния), SiF4 (тетрафторид кремния) и SiC (карбид кремния, карборунд). Кремний растворяется в горячем растворе щелочи с выделением водорода: Si + NaOH (r) Na4SiO4 + 2H2. 4 (тетрахлорид кремния) получают из SiO2 и CCl4 при высокой температуре; это бесцветная жидкость, кипящая при 58° С, легко гидролизуется, образуя хлороводородную (соляную) кислоту HCl и ортокремниевую кислоту H4SiO4 (это свойство используют для создания дымовых надписей: выделяющаяся HCl в присутствии аммиака образует белое облако хлорида аммония NH4Cl). Тетрафторид кремния SiF4 образуется при действии фтороводородной (плавиковой) кислоты на стекло: Na2SiO3 + 6HF -> 2NaF + SiF4 + 3H2O SiF4 гидролизуется, образуя ортокремниевую и гексафторокремниевую (H2SiF6) кислоты. H2SiF6 по силе близка к серной кислоте. Многие фторосиликаты металлов растворимы в воде (соли натрия, бария, калия, рубидия, цезия малорастворимы), поэтому HF используют для перевода минералов в раствор при выполнении анализов. Сама кислота H2SiF6 и ее соли ядовиты.
Диоксид кремния (кремниевый ангидрид). Природный диоксид кремния встречается преимущественно в форме кварца, хотя существуют и другие минералы - кристобалит, тридимит, китит, коусит. Кристаллический диоксид кремния широко распространен в природе в виде прозрачных бесцветных или окрашенных монокристаллов (горный хрусталь, аметист, дымчатый кварц, тридимит, кварцит, розовый кварц, агат, яшма, сердолик, кремень, опал и халцедон) и в форме обломочных пород (морской песок, гравий, галька, песчаник и конгломерат). Окраска аметиста объясняется примесями Mn и Fe, а дымчатого кварца - органическими включениями. Опал и кремень являются слабогидратированными формами SiO2. Аморфный кремнезем встречается в диатомовых отложениях на дне морей и океанов (трепел, кизельгур); эти отложения образовались из SiO2, входившего в состав диатомовых водорослей и некоторых инфузорий. Диатомитовая земля и трепел обнаружены в Калифорнии, Орегоне и в разных частях Европы. Ежегодно добывается до 2 млн. т SiO2 для производства абразивов, теплоизоляции, фильтрующих сред, наполнителя полимеров, красок и композиций. См. также КВАРЦ.
Кремниевые кислоты. Две оксокислоты кремния H4SiO4 (ортокремниевая) и H2SiO3 (метакремниевая, или кремниевая) существуют только в растворе и необратимо превращаются в SiO2, если выпарить воду. Другие кремниевые кислоты получаются за счет различного количества воды в их составе: H6Si2O7 (пирокремниевая кислота из двух молекул ортокремниевой кислоты), H2Si2O5 и H4Si3O8 (ди- и трикремниевая кислоты из двух и соответственно трех молекул метакремниевой кислоты). Все кислоты кремния слабые. При добавлении в раствор силиката серной кислоты образуется гель (желатинообразное вещество), при нагревании и высушивании которого остается твердый пористый продукт - силикагель, имеющий развитую поверхность и используемый как адсорбент газов, осушитель, катализатор и носитель катализаторов.
Силикаты (соли кремниевых кислот). В тетраэдрической структуре природных силикатов атом кремния окружен четырьмя атомами кислорода; ион щелочного или щелочноземельного металла, слишком малый по сравнению с кислородными атомами, размещается в пространстве между тетраэдрами. Иногда тетраэдры выстраиваются в протяженные цепи (например, асбест), иногда образуется слоистая структура (слюда), в других случаях формируется кольцевая структура (например, берилл). К природным силикатам относятся полевые шпаты, слюды, глины, асбест и др. Силикаты входят в состав горных пород: гранита, гнейса, базальта, различных сланцев и т.д. Многие драгоценные камни (изумруд, топаз, аквамарин и др.) - это прозрачные кристаллы силикатов. Силикаты в большинстве своем (кроме силикатов натрия и калия) нерастворимы в воде. Силикаты натрия и калия внешне напоминают стекло, поэтому их называют растворимым стеклом. Жидкое стекло - это водный раствор силиката натрия или калия. Силикат натрия получается сплавлением кварцевого песка со щелочью (NaOH) или содой (Na2CO3) или кипячением смеси кварца с NaOH под давлением. Коммерческий продукт содержит Na2SiO3 с непостоянной примесью SiO2. Растворимое стекло широко используется как наполнитель в мылах. Некоторые моющие средства тоже содержат силикат натрия. Жидкое стекло используют для придания влаго- и огнестойкости деревянным строениям, в технологии кислото- и огнеупорного цемента и бетона, керосинонепроницаемых штукатурок по бетону, для пропитывания тканей, для приготовления огнезащитных красок по дереву, для химического укрепления слабых грунтов.
Гидриды. Подобно углероду кремний образует ковалентные связи Si-Si и Si-H. Соединения, в которых атомы кремния соединены одинарной связью, называются силанами, а если атомы кремния соединены двойной связью, -силенами. Подобно углеводородам эти соединения образуют цепи и кольца. SiH4 называется моносилан, Si2H6 - дисилан, Si3H8 - трисилан, Si4H10 - тетрасилан и т.д. Соединения, в которых атомы кремния соединены через атом кислорода, называются силоксанами, а через атомы серы - силазанами. Силаны и силены могут образовывать связь с углеводородными радикалами и галогенами, например, метилдихлорсилан CH3SiHCl2. Все силаны могут самовозгораться, образуют взрывчатые смеси с воздухом и легко реагируют с водой.
См. также
ПОЛУПРОВОДНИКОВЫЕ ЭЛЕКТРОННЫЕ ПРИБОРЫ.
ЛИТЕРАТУРА
Андрианов К.А. Методы элементоорганической химии. Кремний. М., 1968 Воронков М.Г. и др. Кремний и жизнь. Рига, 1978 Самсонов Г.В. и др. Силициды. М., 1979 Айлер Р. Химия кремнезема. М., 1982
КРЕМНИЙ (Silicium), Si, химический элемент IV группы периодической системы, атомный номер 14, атомная масса 28,0855; неметалл, tпл 1415°C. Кремний - второй после кислорода по распространенности на Земле элемент, содержание в земной коре 27,6% по массе. Один из основных полупроводниковых материалов в электронике, восстановитель при металлотермическом получении металлов, компонент сталей, чугунов и других сплавов. Открыт французскими учеными Ж. Гей-Люссаком и Л. Тенаром в 1811.
- В 2008 году международной группе учёных удалось получить силицен - слой этого элемента, толщиной в один атом.
- Химический элемент в составе жидкого стекла.
- Какой химический элемент присутствует в силиконовых имплантантах?
- Химический элемент, Si.
- Полупроводник.
- Элемент, который впервые выделен в чистом виде в 1811 году французскими учёными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Кремнийоргани́ческие жи́дкости (силиконовые масла), один из видов кремнийорганических полимеров. Применяются в качестве гидравлических жидкостей, гидрофобизаторов, смазок и др.
* * *
КРЕМНИЙОРГАНИЧЕСКИЕ ЖИДКОСТИ - КРЕМНИЙОРГАНИ́ЧЕСКИЕ ЖИ́ДКОСТИ (силиконовые масла), один из видов кремнийорганических полимеров. Применяются в качестве гидравлических жидкостей, гидрофобизаторов, смазок и др.
КРЕМНИЙОРГАНИЧЕСКИЕ ЖИДКОСТИ (силиконовые масла) - один из видов кремнийорганических полимеров. Применяются в качестве гидравлических жидкостей, гидрофобизаторов, смазок и др.
Кремнийоргани́ческие каучу́ки́ (силиконовые каучуки), один из видов кремнийорганических полимеров невысокой молекулярной массы. Применяются в производстве оболочек проводов и кабелей, трубок для переливания крови, протезов (например, искусственных клапанов сердца) и др. Жидкие кремнийорганические каучуки - герметики.
* * *
КРЕМНИЙОРГАНИЧЕСКИЕ КАУЧУКИ - КРЕМНИЙОРГАНИ́ЧЕСКИЕ КАУЧУ́КИ (силиконовые каучуки), один из видов кремнийорганических полимеров невысокой молекулярной массы. Применяются в производстве оболочек проводов и кабелей, трубок для переливания крови, протезов (напр., искусственных клапанов сердца) и др. Жидкие кремнийорганические каучуки - герметики.
КРЕМНИЙОРГАНИЧЕСКИЕ КАУЧУКИ (силиконовые каучуки) - один из видов кремнийорганических полимеров невысокой молекулярной массы. Применяются в производстве оболочек проводов и кабелей, трубок для переливания крови, протезов (напр., искусственных клапанов сердца) и др. Жидкие кремнийорганические каучуки - герметики.
Кремнийоргани́ческие пла́стики - один из видов кремнийорганических полимеров. Применяются в производстве электроизоляционных лаков, компаундов, клеёв, стеклопластиков и др.
* * *
КРЕМНИЙОРГАНИЧЕСКИЕ ПЛАСТИКИ - КРЕМНИЙОРГАНИ́ЧЕСКИЕ ПЛА́СТИКИ, один из видов кремнийорганических полимеров. Применяются в производстве электроизоляционных лаков, компаундов, клеев, стеклопластиков и др.
КРЕМНИЙОРГАНИЧЕСКИЕ ПЛАСТИКИ - один из видов кремнийорганических полимеров. Применяются в производстве электроизоляционных лаков, компаундов, клеев, стеклопластиков и др.
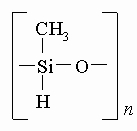
Кремнийоргани́ческие полиме́ры - синтетические полимеры, в молекулах которых содержатся атомы кремния и углерода. Наибольшее значение в промышленности имеют полиорганосилоксаны (полисилоксаны, силиконы), основная молекулярная цепь которых построена из чередующихся атомов кремния и кислорода, а атомы углерода входят в состав боковых (обрамляющих) групп, связанных с атомом кремния:
HO[-Si(R, R')-О-Si(R, R')-О-]nH
(R, R' - органические радикалы, например СН3-). В зависимости от молекулярной массы кремнийорганические полимеры - вязкие бесцветные жидкости (кремнийорганические жидкости), твердые эластичные вещества (кремнийорганические каучуки) или хрупкие продукты (кремнийорганические пластики). Наиболее важные свойства кремнийорганических полимеров - хорошие диэлектрические характеристики, высокая термостойкость, гидрофобность, физиологическая инертность; некоторые каучуки морозостойки.
* * *
КРЕМНИЙОРГАНИЧЕСКИЕ ПОЛИМЕРЫ - КРЕМНИЙОРГАНИ́ЧЕСКИЕ ПОЛИМЕ́РЫ (силиконы), синтетические полимеры, в молекулах которых содержатся атомы кремния и углерода. Наибольшее значение в промышленности имеют полиорганосилоксаны (полисилоксаны), основная молекулярная цепь которых построена из чередующихся атомов кремния и кислорода, а атомы углерода входят в состав боковых (обрамляющих) групп, связанных с атомом кремния:
НО[ - Si(R,R") - O - Si(R, R") - O - ]nH (R, R" - органические радикалы, напр. СН3 -). В зависимости от молекулярной массы кремнийорганические полимеры - вязкие бесцветные жидкости (кремнийорганические жидкости), твердые эластичные вещества (кремнийорганические каучуки) или хрупкие продукты (кремнийорганические пластики). Наиболее важные свойства кремнийорганических полимеров - хорошие диэлектрические характеристики, высокая термостойкость, гидрофобность, физиологическая инертность; некоторые каучуки морозостойки.
КРЕМНИЙОРГАНИЧЕСКИЕ полимеры (силиконы) - синтетические полимеры, в молекулах которых содержатся атомы кремния и углерода. Наибольшее значение в промышленности имеют полиорганосилоксаны (полисилоксаны), основная молекулярная цепь которых построена из чередующихся атомов кремния и кислорода, а атомы углерода входят в состав боковых (обрамляющих) групп, связанных с атомом кремния:НОКРЕМНИЙОРГАНИЧЕСКИЕ соединения - соединения, содержащие в молекуле атом кремния, связанный с атомом углерода непосредственно или через атомы других элементов (O, N, S и др.). Известны, напр., органогалогенсиланы RnSiX4-n, органосиланы R4Si, органосилоксаны R3SiOSiR3 и др., где R - органический радикал, Х - галоген. Применяются для получения кремнийорганических жидкостей, каучуков, клеев, лаков.
КРЕМНИЙОРГАНИЧЕСКИЕ ПОЛИМЕРЫ - силиконы, представляют собой большую группу разнообразных жидкостей, каучуков и смол. Все они содержат кремний, связанный с органическим углеродом непосредственно или через кислород (полиорганосилоксаны). Кремнийорганические полимерные жидкости не имеют запаха, сильно различаются по вязкости, температуре кипения и замерзания. Они очень термостойки и если горят, то с большим трудом, мало подвержены воздействию воды, большинства химических и физических факторов, разрушающих обычные органические материалы. В свою очередь, и они очень мало влияют или не влияют совсем на большинство таких органических материалов, как пластмассы, каучуки, краски или живые ткани и организмы. Кремнийорганические жидкости являются хорошими электроизоляционными материалами, прозрачны и обладают гидрофобными свойствами. Такое редкое сочетание физических свойств позволяет использовать их в присадках для моторных масел, для изготовления различных смазочных веществ, гидравлических и демпферных жидкостей, используемых в широком диапазоне положительных и отрицательных температур, в кулинарии в составе варенья и джемов (для предупреждения вспенивания), в косметике, лакокрасочных покрытиях, для пропитки одежды и обивочных тканей, в пленках, покрывающих стенки сосудов для хранения некоторых жидких лекарств, чувствительных к контакту со стеклянной поверхностью, в составе мебельных и автомобильных полиролей, медицинском оборудовании, производстве асфальта и т.д. Тонкие пленки, оставляемые после обработки поверхности кремнийорганическими полиролями и пропитанными ими полировальными тканями, обладают исключительными пыле- и водоотталкивающими свойствами. Поверхность после такой обработки не смачивается водой и легко очищается от грязи. Кремнийорганические полимерные жидкости используются и в чистом виде. Точность чувствительных приборов и устойчивость их к повреждениям часто повышаются, если в качестве амортизирующих жидкостей применяются кремнийорганические полимеры. Хорошо подобранная жидкость устраняет нежелательное дрожание и скачки стрелки, даже если прибор испытывает значительные вибрации. Кремнийорганические жидкости позволяют снять вибрацию маховиков в двигателях различных типов от автомобильных моторов до локомотивных дизелей. Кремнийорганические полимеры обладают хорошей сжимаемостью, что дает возможность применять их в жидкостных амортизаторах самолетных шасси. Поскольку большинство органических материалов не прилипает к кремнийорганическим полимерам, кремнийорганические жидкости часто используют в виде пленок, чтобы облегчить отделение готового изделия от формы (при формовании резин или пластмасс и при литье металлов под давлением). Термо- и водостойкость кремнийорганических жидкостей вместе с их отличными электроизоляционными свойствами и устойчивостью к пробою в электрических полях позволяет применять их в изоляции свечей авиадвигателей, в радио- и рентгеновском оборудовании, антеннах, переключателях, системах зажигания судовых двигателей, аккумуляторных батареях и электрических кабелях. Они также обеспечивают длительный срок и надежность работы конденсаторов и небольших трансформаторов, предназначенных для использования при высоких температурах. Жидкости, в молекулах которых к каждому атому кремния присоединены одна метильная группа CH3 и один атом водорода H
нашли широкое применение для обработки (аппретирования) текстиля. Ткани, обработанные ими, имеют дорогой вид и приятны на ощупь, к тому же приобретают водоотталкивающие свойства. На них не остается пятен от водосодержащих жидкостей - молока, безалкогольных напитков, кофе и даже чернил. Более того, силиконовый аппрет не удаляется ни стиркой, ни химической чисткой. Эти преимущества чрезвычайно ценны для одежных и обивочных тканей.
Смолы. Кремнийорганические смолы благодаря своим превосходным качествам находят разнообразное применение. Исключительная гидрофобность, термостойкость и другие ценные качества материалов на их основе позволили повысить надежность работы машин и оборудования, уменьшить их вес, сократить расход материалов и способствовали созданию новых более совершенных электроизоляторов, защитных покрытий и т.д. Ниже указаны основные области применения кремнийорганических смол. Смолы для покрытий используются в производстве красок, лаков и эмалей для улучшения внешнего вида и защиты объектов от коррозии и от воздействия высоких температур (например, в случае металлических дымовых труб). Связующие для слоистых материалов применяются для соединения в блоки большого числа слоев бумаги, ткани, асбеста или стеклоткани с целью получения прочных, надежных листовых материалов - слоистых диэлектриков, используемых для изготовления электрических панелей, изоляторов и прокладок в высоковольтных трансформаторах. Смолы для разобщающих покрытий используют там, где требуется "нелипучая" (антиадгезионная) поверхность. Примерами служат покрытия для противней в пекарнях и для вафельниц. Водоотталкивающие смолы применяют в составах для пропитки или обмазки каменной кладки и для получения водостойкого бетона. Формуемые смолы сходны со связующими для слоистых материалов с тем лишь различием, что в них вместо ткани или бумаги используются наполнители. Этим смолам можно придавать самую сложную форму. Из них штампуют втулки, шестерни, детали электрических переключателей, разъемов, патронов, электронного оборудования и моторов. Электроизоляционные материалы, сделанные из кремнийорганических смол, термостойки, устойчивы к озону и агрессивным средам. Переход на детали из таких смол позволяет улучшить технические характеристики и долговечность электрооборудования.
Эластомеры. Кремнийорганические полимеры с большими молекулярными массами после соответствующей термической обработки сшиваются поперечными связями, возникающими между их молекулами, с образованием силиконового каучука, при дальнейшей вулканизации которого получаются эластомеры, почти неотличимые от резин, получаемых из натурального каучука. В зависимости от степени сшивания можно изменять свойства (эластичность, прочность, твердость и т.п.) получаемых материалов. Силиконовые резины эластичны при растяжении и по отскоку. Их можно отформовать в листы, трубы или изделия сложной формы, а также превратить в массу, затвердевающую при комнатной температуре. Они сохраняют эластичность при достаточно низких температурах, когда обычная синтетическая резина становится хрупкой, и при довольно высоких температурах, когда обычная резина превращается в клейкую массу. Они также не подвержены старению, воздействию погоды, воды, электричества, большинства кислот, щелочей, солей и масел. Такие свойства полиорганосиликоновых эластомеров неоценимы для многих специальных целей. Неполный список изделий из них включает: прокладки и заглушки в домашних паровых утюгах и тостерах; изолирующие трубки для защиты свечей зажигания и электрооборудования в автомобилях, самолетах и судах; изоляционные втулки для конденсаторов и трансформаторов; изоляторы для наружной осветительной арматуры, электрических печей и нагревателей, моторов и навигационных систем; упругие уплотнители и замазки; покрытия для тканей из стеклянного и асбестового волокна и герметизирующих прокладок для самолетов, летающих на больших высотах (см. также КАУЧУК И РЕЗИНА).
Химические свойства. Силоксаны содержат два или более атомов кремния, связанных посредством одного или нескольких атомов кислорода:
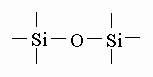
Два атома кремния, связанные таким образом, образуют дисилоксан, три - трисилоксан; полисилоксан содержит в молекуле большое число атомов кремния. Замкнутое кольцо из атомов кремния и кислорода
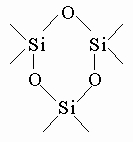
образует циклосилоксан (в данном случае - циклотрисилоксан, поскольку это циклическая структура с тремя атомами кремния). К свободным связям кремния (показанным в этих примерах черточками) могут присоединяться другие атомы кислорода. Если все связи кремния присоединены к кислороду, образуя регулярную структуру, то мы имеем дело с диоксидом кремния (кремнеземом или кварцем) SiO2 - одним из наиболее распространенных соединений в земной коре. С кремнием могут быть связаны небольшие органические группы. С метильными группами (-CH3) образуются метилсилоксаны (или метилсиликоны) - очень ценные химические продукты. Если каждый атом кремния соединен с тремя метильными группами, образуется гексаметилдисилоксан:
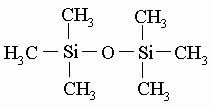
Это летучая жидкость, внешне напоминающая бесцветный бензин. Две метильные группы присоединены к каждому атому кремния в самых ценных продуктах из всех типов промышленных силиконов - в циклических и линейных силоксанах, примерами которых могут служить октаметилциклотетрасилоксан (I) и полидиметилсилоксан (II):
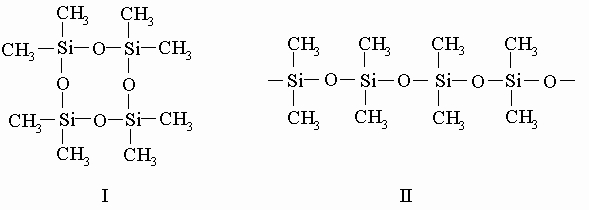
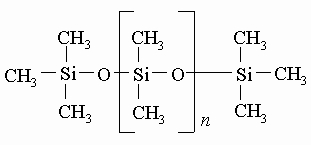
Известны способы превращения циклосилоксанов в полидиметилсилоксаны, которые могут состоять из 15 000 и более диметилсилоксановых единиц. Можно не допустить образования молекул полидиметилсилоксанов столь большого размера, добавляя вещество, содержащее триметилсилоксановые единицы, чтобы оборвать рост полидиметилсилоксановой цепи при достижении ее желаемой длины. При этом получается одна из разновидностей кремнийорганических жидкостей со структурой
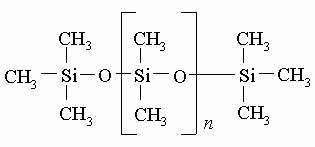
Вязкость таких соединений возрастает по мере увеличения n, чему соответствует переход от очень подвижных, похожих на бензин, жидкостей к более вязким маслам и, наконец, к смолообразным веществам. Если к кремнию присоединена только одна органическая группа, то возникает сетчатая структура, характерная для полисилоксановых смол:
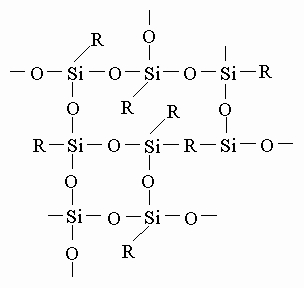
Обычно в производимых промышленностью таких смолах R - это метильные или фенильные (C6H5) группы. Силоксаны могут быть получены сочетанием структурных единиц всех указанных типов, т.е. с одной, двумя, тремя органическими группами при кремнии или вообще без них. Органические группы могут быть одинаковыми или представлять собой комбинацию различных типов групп. Изменяя тип и число групп при кремнии, можно получить почти бесконечное разнообразие структур. В большинстве кремнийорганических полимеров такими группами обычно являются метил, фенил или их комбинация, подобранная для получения определенных свойств. Историческая справка. Созданию большого разнообразия кремнийорганических соединений, выпускаемых современной промышленностью, предшествовала работа многих химиков в течение более 150 лет. Начало положил Й.Берцелиус открытием кремния (1823) (см. КРЕМНИЙ). Он показал, что кремний воспламеняется и энергично сгорает в токе горячего газообразного хлора с образованием жидкого вещества с удушливым запахом. Это тетрахлорид кремния SiCl4 - очень реакционноспособное соединение. С водой тетрахлорид кремния легко образует диоксид кремния и соляную кислоту: SiCl4 + 2H2O -> SiO2 + 4HCl В 1844 французский химик Эбельман показал, что SiCl4 реагирует со спиртом, образуя приятно пахнущую жидкость - тетраэтилортосиликат (тетраэтоксисилан), применяемый в наше время в больших количествах в производстве кремнийорганических полимеров: SiCl4 + 4C2H5OH -> Si(OC2H5)4 + 4HCl В 1857 Ф. Велер нагрел кремний с хлороводородом и получил дымящую жидкость - трихлорсилан HSiCl3, еще один важный промежуточный продукт для производства кремнийорганических полимеров. Ш. Фридель, профессор Сорбонны, и Дж. Крафтс, студент из Бостона, обучавшийся в Париже, сообщили в 1863, что ими получено соединение, в котором органический радикал присоединен непосредственно к кремнию, и поэтому считается, что именно эти исследователи осуществили самый важный синтез в истории кремнийорганических соединений. Использованный ими метод в наше время сочли бы трудоемким, но он привел к успеху. Они приготовили воспламеняющееся на воздухе жидкое соединение цинка, диэтилцинк, смешали его с тетрахлоридом кремния и запаяли смесь в стеклянную трубку, которую нагревали при 160° C: 2Zn(C2H5)2 + SiCl4 -> 2ZnCl2 + Si(C2H5)4 Полученное ими новое соединение кремния - тетраэтилсилан, в противоположность любым его ранее известным жидким соединениям, оказалось очень инертно: вода, кислоты и щелочи на него не действовали. Эта работа привлекла внимание молодого немецкого химика А.Ладенбурга. Ладенбург нашел способ управления реакцией с диэтилцинком, так что стало возможным по желанию присоединять к кремнию одну, две, три или четыре этильные группы. Полученный им диэтилдиэтоксисилан (C2H5)2 Si(OC2H5)2 реагировал с водой, образуя спирт и маслянистую жидкость:
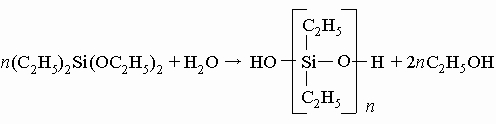
(В диэтилдиэтоксисилане этильные группы, присоединенные непосредственно к кремнию, действительно связаны очень прочно, но этоксильные группы легко удаляются водой c образованием спирта.) Полученная жидкость разлагалась только при очень высоких температурах и не затвердевала при температурах много ниже точки замерзания воды. Так в 1872 Ладенбург синтезировал предшественник современных промышленных кремнийорганических полимеров, но потребовалось много усовершенствований, прежде чем стало возможным развитие промышленности кремнийорганических полимеров. Заметный вклад в исследование кремнийорганических соединений в период 1898-1939 внес Ф. Киппинг из Ноттингемского университета в Англии. В конце 1930-х годов лишь немногие химики осознали огромную потенциальную ценность полисилоксанов. Среди них выделялись Дж. Хайд ("Стекольные заводы Корнинга") и Р. Макгрегор из Института Меллона в США и К. А. Андрианов в России. В 1945 Ю. Рохов обнаружил, что пары органических хлоридов реагируют с нагретым кремнием, образуя органохлорсиланы. Процесс наиболее гладко протекает с метилхлоридом. В идеальном случае реакция описывается следующим уравнением: 2CH3Cl + Si -> (CH3)2SiCl2 Процессом можно управлять, благоприятствуя этой реакции, но во всех случаях образуются побочные продукты CH3SiCl3, (CH3)3SiCl, SiCl4, HSiCl3, CH3SiHCl2, Si2Cl6 и многие другие соединения. Почти все они могут быть использованы. Для разделения продуктов смесь перегоняют, а полученные вещества применяют для синтеза разнообразных кремнийорганических полимеров. Процесс удобен для крупномасштабного производства кремнийорганических соединений. Это открытие вызвало новый взрыв интереса к химии и технологии кремнийорганических полимеров. Вскоре был открыт другой замечательный процесс, использующий дешевые углеводороды и трихлорид бора в качестве катализатора. Это позволило снизить стоимость производства целого спектра кремнийорганических соединений и цену товарных продуктов. Два примера этого процесса приведены ниже:
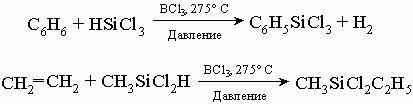
При обработке водой триметилхлорсилана происходит его гидролиз и получается одна из простейших промышленных кремнийорганических жидкостей, гексаметилдисилоксан: 2(CH3)3SiCl + H2O -> (CH3)3Si-O-Si(CH3)3 + 2HCl Гидролиз смеси триметилхлорсилана и диметилдихлорсилана, ведущий к более сложному соединению, представлен уравнением
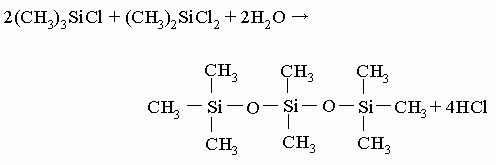
В присутствии избытка диметилдихлорсилана образуются полимеры уже упоминавшегося типа:
ЛИТЕРАТУРА
Соболевский М.В. и др. Свойства и области применения кремнийорганических продуктов. М., 1975 Хананашвили Л.М., Андрианов К.А. Технология элементоорганических мономеров и полимеров. М., 1983
Кремнийоргани́ческие соедине́ния - соединения, содержащие в молекуле атом кремния, связанный с атомом углерода непосредственно или через атомы других элементов (О, N, S и др.). Известны, например, органогалогенсиланы RnSiX4-n, органосиланы R4Si, органосилоксаны R3SiOSiR3 и др., где R - органический радикал, Х - галоген. Применяются для получения кремнийорганических жидкостей, каучуков, клеёв, лаков.
* * *
КРЕМНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ - КРЕМНИЙОРГАНИ́ЧЕСКИЕ СОЕДИНЕ́НИЯ, соединения, содержащие в молекуле атом кремния, связанный с атомом углерода непосредственно или через атомы других элементов (O, N, S и др.). Известны, напр., органогалогенсиланы RnSiX4-n, органосиланы R4Si, органосилоксаны R3SiOSiR3 и др., где R - органический радикал, Х - галоген. Применяются для получения кремнийорганических жидкостей, каучуков, клеев, лаков.
Кремнийорганические эмали представляют собой взвеси пигментов и наполнителей в кремнийорганическом лаке, в который добавлен растворитель. Эти эмали можно использовать для окраски практически любых поверхностей - они хорошо держатся на бетоне, штукатурке, металле, картоне, дереве, пластмассах, стекле и бумаге. Кремнийорганические эмали щелочестойкие, ими можно красить по свежей штукатурке и бетону; их можно применять и для наружных и для внутренних работ. Эмали хорошо выдерживают перепады температур, защищают металлические поверхности от коррозии (их рекомендуется использовать для окраски радиаторов отопления, труб и арматуры).
Поверхность под кремнийорганические эмали готовят так же, как под алкидные краски. В некоторых случаях можно обойтись без грунтования и наносить эмаль сразу после очистки поверхности. Кремнийорганические эмали отличаются хорошим блеском и чистотой тона.
Через некоторое время на лакокрасочном покрытии появляются сколы, вмятины, трещины, царапины, повреждается грунтовка и, что особенно опасно, обнажается металл. Всякое "ранение" металла ведет к его ржавлению, которое неизбежно будет захватывать все новые и новые участки. Подкраска требуется и тогда, когда предыдущее лакокрасочное покрытие просто состарилось, "потеряло вид". Небольшие дефекты лакокрасочного покрытия, протяженностью менее 5 мм, закрасить "незаметно" довольно просто. Это лучше всего сделать с помощью распылителя, приняв меры предосторожности от загрязнения свежего покрытия пылью, приносимой ветром, и использовать для этой цели (из тех же соображений) быстросохнущие эмали, например нитроэмали.