Рассмотрим такой признак, как группа крови. Имеется целый ряд типов, или систем, групп крови. Наиболее известна система AB0, по которой различают четыре основных группы: I, II, III и IV; эти группы обозначают также как 0, A, B и AB, поскольку различие между ними определяется тем, какой белок (антиген) присутствует в эритроцитах человека: A или B. Генетически система групп крови AB0 контролируется тремя аллелями: один аллель, обозначаемый A, контролирует синтез антигена A, другой аллель, B, - синтез антигена B, а третий аллель 0 - неактивный и не вызывает образования антигена. Соответственно синтезируемым антигенам и различают четыре группы крови, но им отвечают шесть генетических вариантов (генотипов):
Аллель 0 проявляется фенотипически, т.е. как признак организма, только тогда, когда он оказывается в гомозиготном состоянии (00); этому соответствует первая группа крови, характеризующаяся отсутствием групповых антигенов. В гетерозиготном состоянии (генотипы A0 и B0) он никак не влияет на формируемый фенотип, который целиком определяется альтернативным аллелем (A или B). Поэтому фенотипически генотипы A0 и AA тождественны: они характеризуются наличием антигена A и определяют вторую группу крови. Точно так же тождественны генотипы B0 и BB, определяющие третью группу, т.е. наличие антигена B. В том случае, когда у гетерозиготной особи фенотипически проявляется только один аллель, говорят, что этот аллель доминантный; при этом другой аллель называется рецессивным. Для системы групп крови AB0, аллели A и B доминируют над аллелем 0; последний же рецессивен по отношению к ним. Если оба аллеля проявляются в фенотипе гетерозиготной особи, то говорят, что они кодоминантны. Так, аллели A и B кодоминантны по отношению друг к другу: в гетерозиготном состоянии (AB) они определяют присутствие обоих антигенов, A и B, т.е. четвертую группу крови.
Механизмы рецессивности и доминантности. Рецессивными часто бывают "дефектные" аллели, не способные производить соответствующий продукт (белок). Поэтому многие наследственные заболевания, обусловленные нехваткой или отсутствием какого-либо белка или фермента, передаются как рецессивный признак: ими страдают только лица гомозиготные по дефектному аллелю. Доминантные болезни чаще всего вызываются аллелями, кодирующими измененные полипептидные цепи. Последние, входя в состав белка, нарушают его пространственную структуру и функциональную активность. Доминантным заболеваниям подвержены лица гетерозиготные по дефектному аллелю. В гомозиготном состоянии доминантные аллели, как правило, летальны.
Расщепление признака в потомстве гетерозигот. У индивидов, гомозиготных по данному гену, все гаметы несут один и тот же его аллель. Среди гамет, производимых гетерозиготной особью, половина несет один аллель, а половина - другой. Знак "плюс" в следующей таблице показывает, какие гаметы производятся разными индивидами по локусу системы групп крови AB0.
Из этой таблицы видно, что люди со второй и третьей группами крови продуцируют разные гаметы в зависимости от того, гомозиготны они или гетерозиготны. Из таблицы также видно, какой генотип ожидается у детей от родителей с теми или иными группами крови. Если оба родители гомозиготны, то все их дети будут одинаковой группы. Например, родители с первой группой крови образуют гаметы, несущие только аллель 0, поэтому у их детей может быть только первая группа. Если мать имеет вторую, а отец третью группу крови и при этом они гомозиготны, т.е. их генотип, соответственно, АА и ВВ, то дети могут иметь только четвертую группу крови (АВ). Если же один или оба родителя гетерозиготны, то наблюдается т.н. расщепление признака в потомстве, вытекающее из сформулированного выше Первого правила Менделя и проявляющееся в том, что у детей могут появиться признаки, отсутствующие у родителей. Так, если бы в вышеприведенном примере мать была гетерозиготна, то она производила бы яйцеклетки двух типов - с аллелем A и с аллелем 0. При этом у нее может равновероятно родиться ребенок с третьей либо с четвертой группой крови (генотипа B0 или AB, соответственно). Таким образом, при генотипе матери А0 и отца ВВ дети не могут иметь группу крови матери; их группа крови будет либо такой же, как у отца, либо такой, какая не свойственна ни отцу, ни матери. Если оба родителя гетерозиготны, то разнообразие генотипов среди детей еще выше. Например, если отец и мать имеют вторую группу крови и генотип их A0, то генотип и группа крови их ребенка зависит от того, какая именно яйцеклетка созрела и каким сперматозоидом она будет оплодотворена. Поскольку в данном примере каждый из родителей производит гаметы A и 0, то генотип их ребенка может быть AA, A0 или 00, а согласно теории вероятностей шансы получить их распределяются как 1:2:1. Поскольку первые два генотипа определяют одну и ту же группу крови, то по признаку "группа крови" шансы иметь ребенка с первой или второй группой крови будут 1:3 (эти соотношения в потомстве гетерозиготных родителей были открыты Менделем). И наконец, если бы мать имела вторую, а отец третью группу крови и оба они были бы гетерозиготными, то с равной вероятностью у них мог бы родиться ребенок с любой группой крови.
Наследование сцепленных признаков. К настоящему времени составлены подробные карты генов для многих видов растений, животных и человека, из которых можно видеть, какие из генов на какой хромосоме находятся. Знание карты генов позволяет предсказать поведение нескольких признаков в потомстве. Если разные признаки определяются генами, расположенными в негомологичных хромосомах, то они наследуются независимо друг от друга, поскольку в процессе мейотического деления негомологичные хромосомы (а значит и аллели разных генов) расходятся по гаметам случайно (см. ГЕНЕТИКА). Последнее известно как Второе правило Менделя. Например, такой признак, как альбинизм, связан с отсутствием меланина, синтез которого контролируется геном, расположенным в 11-й хромосоме. Следовательно, вероятность того, что у супругов-альбиносов будет ребенок-альбинос, не связана с вероятностью иметь определенную группу крови системы AB0, поскольку последняя определяется геном, находящимся в иной, негомологичной, 9-й хромосоме. Поэтому, если один или оба родителя имеют дефектные аллели, расположенные на разных хромосомах и вызывающие два разных заболевания, то вероятность того, что ребенок получит оба дефектных аллеля, будет равна произведению вероятностей получить каждый из этих аллелей в отдельности. Ситуация иная, если оба гена находятся в одной хромосоме, т.е. сцеплены. Например, на 2-й хромосоме человека имеется ген системы групп крови MN с двумя кодоминантными аллелями M и N. Близко к нему располагается другой ген, с доминантным аллелем S и рецессивным s, определяющий систему групп крови Ss. В зависимости от расположения этих аллелей на гомологичных хромосомах, будет наблюдаться различное распределение генотипов в гаметах и у потомков от гетерозиготных родителей. Действительно, если генотип матери MNSs, то ее хромосомная структура по этим двум генам может быть одного из двух типов:
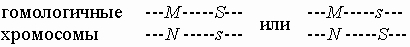
В первом случае продуцируются яйцеклетки и , а во втором - и . Пусть отец будет гомозиготным по обоим генам и имеет генотип MMss. Тогда в первом случае их дети могут иметь генотип MMSs и MNss, в то время как во втором случае возможные генотипы детей иные: MMss и MNSs. Рекомбинация сцепленных генов. В мейозе происходит событие, называемое кроссинговером, в ходе которого гомологичные хромосомы могут обменяться своими участками. Например, в рассмотренном выше примере, участок обмена может оказаться между генами систем MN и Ss:
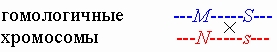
В результате обмена происходит т.н. рекомбинация генов и получаются кроссоверные гаметы ---M---s--- и ---N---s---.
Рекомбинация может произойти, а может не произойти в данном мейозе. Чем ближе гены располагаются на хромосоме, тем теснее их сцепление и тем реже она происходит. В частности, гены систем MN и Ss так тесно сцеплены, что их рекомбинация случается чрезвычайно редко, и в приближенных расчетах ею можно пренебречь. В общем случае вероятность, или частота, рекомбинации довольно значительна. Ее величина (R) находится между 0 (полное сцепление) и 0,5 (несцепленные гены) и является мерой генетического расстояния между генами на хромосоме; однако она не тождественна физическому расстоянию между генами, поскольку кроссинговер идет с разной интенсивностью в разных участках одной и той же хромосомы. Частота каждой из кроссоверных гамет равна R/2. Поскольку кроссинговер может и не произойти (с вероятностью 1-R), то данный индивид производит помимо кроссоверных еще и некроссоверные гаметы: и . Частота каждой из них среди всех гамет данного индивида равна (1-R)/2. Вернемся к приведенному выше примеру, где мать имеет генотип MNSs с хромосомной структурой.
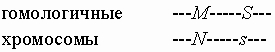
а отец - генотип MMss. С учетом рекомбинации, возможными генотипами их детей будут не только MMSs и MNss, но и MMss и MNSs. Однако их вероятности не одинаковы, как было бы в случае отсутствия сцепления, а равны 1-R для первых двух генотипов и R для остальных двух.
НАСЛЕДОВАНИЕ ПОЛА И СЦЕПЛЕННЫХ С ПОЛОМ ПРИЗНАКОВ
Наследование пола. Пол особи - это сложный признак, формируемый как действием генов, так и условиями развития. У человека одна из 23 пар хромосом - половые хромосомы, обозначаемые как X и Y. Женщины - гомогаметный пол, т.е. имеют две X-хромосомы, одну - полученную от матери, а другую - от отца. Мужчины - гетерогаметный пол, имеют одну X- одну Y-хромосому, причем X передается от матери, а Y - от отца. Заметим, что гетерогаметный пол не всегда обязательно мужской; например, у птиц это самки, в то время как самцы гомогаметны. Имеются и другие механизмы детерминации пола. Так, у ряда насекомых Y-хромосома отсутствует. При этом один из полов развивается при наличии двух X-хромосом, а другой - при наличии одной X-хромосомы. У некоторых насекомых пол определяется соотношением числа аутосом и половых хромосом. У ряда животных может происходить т.н. переопределение пола, когда в зависимости от факторов внешней среды зигота развивается либо в самку, либо в самца. Развитие пола у растений имеет столь же разнообразные генетические механизмы, как и у животных. Отклонение от баланса половых хромосом, приводит к патологии, подобно тому как и отклонение от нормального числа аутосом также приводит к тяжелым болезням (см. ВРОЖДЕННЫЕ ПОРОКИ). Однако следует иметь в виду, что формирование пола и нормальных половых признаков - сложный физиологический процесс, в который вовлечены гены не только половых хромосом, но и аутосом. Гормональные и другие физиологические нарушения могут приводить к тому, что из "мужской" зиготы XY развивается внешне почти нормальная женщина, но с определенными мужскими признаками - по типу волосяного покрова, структуре мышц, тембру голоса и др. - и имеющая вместо матки недоразвитые семенники, что делает ее бесплодной. Возможно и обратное, когда при наличии генотипа XX индивид развивается с вторичными половыми признаками мужского пола. Подобные отклонения встречаются не только у человека, но и у других видов. Генетическая детерминация пола, определяемая набором половых хромосом, поддерживает равное воспроизводство самок и самцов. Действительно, женские яйцеклетки содержат только X-хромосому, поскольку женщины имеют генотип XX по половым хромосомам. Генотип же мужчин - XY, и потому рождение девочки или мальчика в каждом конкретном случае определяется тем, несет ли спермий X- или Y-хромосому. Поскольку же в процессе мейоза хромосомы имеют равные шансы попасть в гамету, то половина гамет, производимых индивидами мужского пола, содержит X-, а половина - Y-хромосому. Поэтому половина потомков ожидается одного пола, а половина - другого. Следует подчеркнуть, что предсказать заранее рождение мальчика или девочки невозможно, поскольку невозможно предугадать, какая мужская половая клетка будет участвовать в оплодотворении яйцеклетки: несущая X- или Y-хромосому. Поэтому наличие большего или меньшего числа мальчиков в семье - дело случая:
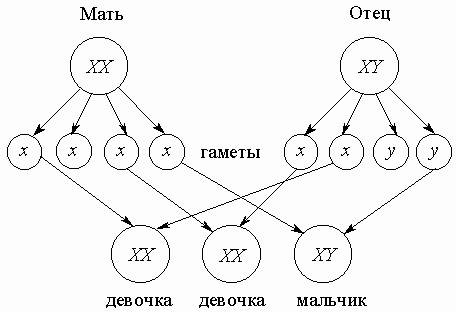
Теоретически возможна избирательная элиминация спермиев с X- или Y-хромосомой, приводящая к разным вероятностям рождения мальчиков или девочек в каких-то семьях; однако в среднем эта вероятность остается близкой к 0,5.
Признаки, сцепленные с X-хромосомой. Если ген находится в половой хромосоме (его называют сцепленным с полом), то проявление его у потомков следует иным, чем для аутосомых генов, правилам. Рассмотрим гены, находящиеся в X-хромосоме. Дочь наследует две X-хромосомы: одну - от матери, а другую - от отца. Сын же имеет только одну X-хромосому - от матери; от отца же он получает Y-хромосому. Поэтому отец передает гены, имеющиеся в его X-хромосоме, только своей дочери, сын же их получить не может. Поскольку X-хромосома более "богата" генами по сравнению с Y-хромосомой, то в этом смысле дочь генетически более схожа с отцом, чем сын; сын же более схож с матерью, чем с отцом. Один из исторически наиболее известных сцепленных с полом признаков у человека - это гемофилия, приводящая к тяжелым кровотечениям при малейших порезах и обширным гематомам при ушибах. Она вызывается рецессивным дефектным аллелем 0, блокирующим синтез белка, необходимого для свертывания крови. Ген этого белка локализован в Х-хромосоме. Гетерозиготная женщина +0 (+ означает нормальный активный аллель, доминантный по отношению к аллелю гемофилии 0) не заболевает гемофилией, и ее дочери тоже, если у отца нет этой патологии. Однако ее сын может получить аллель 0, и тогда у него развивается гемофилия. Гемофилией был поражен царевич Алексей, сын императора России Николая II. Его мать, царица Александра Федоровна, была гетерозиготна по этому аллелю и унаследовала его от своей матери Алисы, которая, в свою очередь, получила его от прабабушки царевича Алексея, английской королевы Виктории:
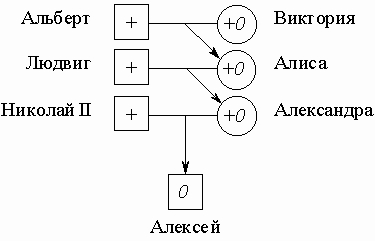
В гетерозиготном состоянии ген гемофилии не проявляется, и поэтому женщины в королевских семьях Европы не страдали гемофилией. Однако многие принцы - потомки королевы Виктории (мутация произошла, по-видимому, именно у нее) получили этот ген и были поражены гемофилией. Вероятность того, что царевич Алексей мог получить дефектный аллель 0 от матери была равна 1/2; с той же вероятностью он мог получить от нее нормальный аллель. Осуществись второе из этих равновероятных событий в образовании гамет, и сценарий судьбы императорской четы выглядел бы иначе. Рецессивные заболевания, вызываемые генами X-хромосомы, намного реже поражают женщин, чем мужчин, поскольку у них заболевание проявляется только при гомозиготности - наличии рецессивного аллеля в каждой из двух гомологичных X-хромосом; мужчины заболевают во всех случаях, когда их единственная X-хромосома несет дефектный аллель. Количественно это следует из соотношений Харди - Вайнберга(см. ПОПУЛЯЦИОННАЯ ГЕНЕТИКА).
Пусть q означает частоту рецессивного аллеля в популяции,
т.е. долю X- хромосом, несущих этот аллель. Доля мужчин, имеющих данный аллель и подверженных вызываемой им болезни, равна q. В то же время доля больных женщин равна частоте гомозигот, т.е. q2. Следовательно, число мужчин, больных рецессивным сцепленным с X-хромосомой заболеванием, в 1/q больше, чем число больных женщин. Например, если частота расположенного в X-хромосоме аллеля, вызывающего дальтонизм (неспособность различать цвета), равна 0,05 (т.е. дальтонизм имеется у 5% мужчин), то число дальтоников-мужчин в 20 раз больше, чем дальтоников-женщин. Пример сцепленного с полом кодоминантного наследования - рыжая окраска домашней кошки, определяемая аллелем у. В гетерозиготном состоянии активными являются оба аллеля (нормальный и у), и поэтому местами шерсть кошки имеет обычную окраску, а местами рыжую. Гомозиготные кошки - целиком рыжие (за исключением возможных белых пятен, вызываемых другим геном, блокирующим синтез пигментов). Самцы же не могут быть частично рыжими; они либо нерыжие, либо целиком рыжие (с возможными белыми пятнами). Исходя из тех же рассуждений, что и абзацем выше, можно было бы заключить, что целиком рыжие коты встречаются гораздо чаще, чем полностью рыжие гомозиготные кошки: частоты их в популяции, соответственно, q и q2, где q - частота "рыжего" аллеля y. Однако в случаях кодоминантного наследования эти рассуждения неприменимы. На самом деле кошки с наличием рыжего цвета (как полностью, так и частично) встречаются гораздо чаще, чем рыжие коты: их частота равна сумме частот гомо- и гетерозигот: q2 + 2q (1- q) = 2q - q2. Например, если частота "рыжего" аллеля равна 0,05, то чисто рыжих кошек должно быть 0,25%, рыжих котов - 5%, а кошек с рыжими пятнами - почти 10%. Хромосомные перестройки иногда приводят к тому, что фрагмент одной хромосомы "отламывается" и присоединяется к другой хромосоме. Это может произойти и с половыми хромосомами. Так, например, изредка встречаются коты с частично рыжей окраской; это обусловлено тем, что часть X-хромосомы, несущей аллель y, присоединились к Y-хромосоме. В результате по этому локусу наследование осуществляется так же, как и аутосомных генов, т.е. коты с указанным хромосомным нарушением тоже могут быть гетерозиготными, а потому частично рыжими. Однако поломка хромосом приводит к патологиям, в данном случае - глухоте и бесплодию. Это было подмечено давно и выражено во фразе "трехцветные коты глухие". Под третьим цветом здесь понимаются белые пятна. Однако этой патологией страдают и "двуцветные", частично рыжие без белых пятен коты (не путать рыжий цвет с коричневым, который вызывается другим, аутосомным, геном и распространен в ряде пород кошек).
Сцепление с Y-хромосомой. Сведения о генах, находящихся в Y-хромосоме, весьма скудны. Предполагается, что она практически не несет генов, обусловливающих синтез белков, необходимых для функционирования клетки. Но она играет ключевую роль в развитии мужского фенотипа. Отсутствие Y-хромосомы при наличии только одной X-хромосомы приводит к т.н. синдрому Тернера: развитию женского фенотипа с плохо развитыми первичными и вторичными половыми признаками и другими отклонениями от нормы. Встречаются мужчины с добавочной Y-хромосомой (XYY); они высокого роста, агрессивны и нередко аномального поведения. В Y-хромосоме выявлено несколько генов, ответственных за регуляцию синтеза специфических ферментов и гормонов, и нарушения в них приводят к патологиям полового развития. Имеется ряд морфологических признаков, которые, как полагают, определяются генами Y-хромосомы; среди них - развитие волосяного покрова ушей. Подобного рода признаки передаются только по мужской линии: от отца к сыну.
НАСЛЕДОВАНИЕ СЛОЖНЫХ ПРИЗНАКОВ
Мы рассмотрели правила передачи признака потомству в случае, когда он определяется одним геном. Они справедливы для всех организмов, но тем не менее являются лишь основой для понимания того, как наследуются свойства организма. Дело в том, что многие признаки определяются двумя или большим числом генов. Аллели каждого из этих генов наследуются так, как описано выше. Однако характер наследования признака, который они определяют, зависит от взаимодействия этих аллелей и может быть очень сложным. Рассмотрим в качестве примера окраску. Окраска шерсти у животных или цветка у растений определяется типом пигмента, его распределением по волосу, перу или лепесткам, пространственным распределением по-разному пигментированных структур и т.д. Все эти частные свойства контролируются разными генами, а в совокупности они все и определяют то, что мы называем окраской. Например, окраска такого детально изученного экспериментального животного, как мышь, детерминируется по меньшей мере пятью генами. Обычная окраска мыши - серая. Однако сам волос не может быть серым, пигмента такого цвета нет. На самом деле у такой мыши синтезируется и мигрирует в волос черный пигмент, но черная пигментация основания и кончика волоса прерывается желтым кольцом, в котором находится желтый пигмент. Такая окраска называется "агути", именно она и делает мышь "серой". Желтая полоса контролируется геном агути, A, аллель A которого контролирует образование желтой полосы. Рецессивный аллель этого гена, a, блокирует поступление желтого пигмента в волос и обусловливает в гомозиготном состоянии черную окраску мыши. Другой ген, B, контролирует синтез пигментов: доминантный аллель B вызывает образование черного, а рецессивный аллель b коричневого пигмента. В результате, мышь, имеющая оба доминантных аллеля, A и B, - это обычная "серая мышь", а мышь aa и с аллелем B - черная. Однако мышь гомозиготная по второму гену, т.е. bb, и с аллелем A имеет окраску цвета корицы (комбинация коричневого волоса и желтого кольца агути). Мышь же гомозиготная по обоим генам, aabb, полностью коричневая. Имеется ген C, рецессивный аллель которого может прерывать синтез пигментов, и гомозиготная по этому аллелю мышь - белая (альбинос). Ген D контролирует количество пигмента в волосе, так что воспринимаемые глазом различия в интенсивности окраски (например, от светло- до темнокоричневого), определяются различными аллелями этого гена. Ген S детерминирует распределение пигментов по телу и может приводить к пятнистой окраске. Аналогичные гены описаны и у других млекопитающих: домашней кошки, лошади, пушных зверей. Окраска оперения у птиц, надкрылий у жуков, цветка у растений тоже контролируются многими генами; разнообразие сочетаний различных аллелей и определяет то разноцветье, что мы видим в природе. Многие сложные признаки имеют количественную природу, т.е. степень их выраженности бывает разной и может быть измерена. Например, активность фермента измеряется скоростью катализируемой им реакции, т.е. количеством вещества, подвергшегося превращению в единицу времени. Этот показатель зависит от физико-химических свойств фермента, которые, в свою очередь, определяются его пространственной структурой, а в конечном итоге - генами, контролирующими синтез составляющих его полипептидных цепей. Различные аллели каждого из этих генов могут по-разному влиять на конечный (самый важный) признак - активность фермента, образуя почти непрерывный ряд: от слабой активности до очень высокой. Более того, влияние этих аллелей сказывается и на других, не менее важных свойствах, таких, например, как стабильность работы белка при низкой или высокой температуре, пониженной или повышенной кислотности, нехватке или избытке субстрата. Различная интенсивность работы сотен ферментов и белковых гормонов, вызванная различием в аллельном составе, ведет к различиям между особями в росте и развитии, в способности усваивать пищу, переносить нехватку кислорода, перепады температуры и другие изменения условий среды. Целый ряд признаков, в частности рост, размеры тела, плодовитость, сопротивляемость инфекциям, также контролируются многими генами и проявляют непрерывную, количественную изменчивость. В медицинской генетике выделяют т.н. мультифакторные заболевания, которые нередко проявляются в форме слабых отклонений от нормы и диагностируются как болезнь, когда эти отклонения оказываются значительными. Такие заболевания можно рассматривать как различную выраженность неких количественных признаков (или признака), создающих предрасположенность к данному заболеванию. В становлении сложных признаков большую роль играют условия среды, в которой развивается организм. Так, рост человека в основном обусловлен генетически, но при хорошем питании и хороших условиях жизни люди в среднем выше, чем в популяции с такими же генетическими данными, но находящейся в худших условиях. Подверженность туберкулезу и полиомиелиту определяется специфическими генами, но даже предрасположенные к ним люди не заболевают, если они не инфицированы соответствующими бактериями или вирусами. Уровень интеллекта тоже наследуется, но вклад среды в формирование подобных различий между людьми столь велик, что на самом деле мы должны больше говорить о социальных, нежели генетических, различиях (см. ИНТЕЛЛЕКТ).
ЛИТЕРАТУРА
Айала Ф., Кайгер Дж. Современная генетика, тт. 1-3, М., 1988 Фогель Ф., Мотульски А. Генетика человека, тт. 1-3, М., 1990