м.
Химический элемент, газ без цвета и запаха, составляющий основную часть воздуха и являющийся одним из главных элементов питания растений.
м.
Химический элемент, газ без цвета и запаха, составляющий основную часть воздуха и являющийся одним из главных элементов питания растений.
АЗО́Т, азота, мн. нет, муж. (от греч. отриц. a и zoe - жизнь). Газ без цвета и запаха, входящий в состав воздуха.
|| Химический элемент (хим.).
АЗО́Т, -а, муж. Химический элемент, газ без цвета и запаха, главная составная часть воздуха, входящий также в состав белков и нуклеиновых кислот.
| прил. азотистый, -ая, -ое и азотный, -ая, -ое. Азотная, азотистая кислоты. Азотные удобрения.
АЗОТ - муж., хим. основание, главная стихия селитры; селитротвор, селитрород, селитряк; он же главная, по количеству, составная часть нашего воздуха (азота - 79 объемов, кислорода - 21). Азотистый, азотный, азотовый, азот в себе содержащий. Химики различают этими словами меру или степени содержания азота в сочетаниях его с другими веществами.
АЗО́Т, -а, м
Газ без цвета и запаха, химический элемент, не поддерживающий горения, главная составная часть воздуха, входящий в состав белков и нуклеиновых кислот (является одним из главных элементов питания растений).
Азот применяется как инертная среда для многих технологических процессов.
АЗО́Т -а; м. [франц. azote от греч. an- не-, без- и zōtikos - дающий жизнь]. Химический элемент (N), газ без цвета и запаха, не поддерживающий дыхания и горения (составляет основную по объёму и массе часть воздуха, является одним из главных элементов питания растений).
◁ Азо́тный, -ая, -ое. А-ая кислота. А-ые удобрения. Азо́тистый, -ая, -ое. А-ая кислота.
* * *
азо́т (лат. Nitrogenium), химический элемент V группы периодической системы. Название от греч. а... - отрицательная приставка, и zōē - жизнь (не поддерживает дыхания и горения). Свободный азот состоит из 2-атомных молекул (N2); газ без цвета и запаха; плотность 1,25 г/л, tпл -210ºC, tкип -195,8ºC. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09% объёма), разделением которого получают промышленный азот (более 3/4 идёт на синтез аммиака). Применяется как инертная среда для многих технологических процессов; жидкий азот - хладагент. Азот - один из основных биогенных элементов, входящий в состав белков и нуклеиновых кислот.
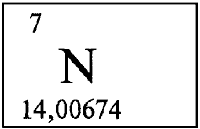
* * *
АЗОТ - АЗО́Т (лат. Nitrogenium - рождающий селитры), N (читается «эн»), химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14,0067. В свободном виде - газ без цвета, запаха и вкуса, плохо растворим в воде. Состоит из двухатомных молекул N2, обладающих высокой прочностью. Относится к неметаллам.
Природный азот состоит из стабильных нуклидов (см. НУКЛИД) 14N (содержание в смеси 99,635% по массе) и 15N. Конфигурация внешнего электронного слоя 2s22р3. Радиус нейтрального атома азота 0,074 нм, радиус ионов: N3- - 0,132 , N3+ - 0,030 и N5+ - 0,027 нм. Энергии последовательной ионизации нейтрального атома азота равны, соответственно, 14,53, 29,60, 47,45, 77,47 и 97,89 эВ. По шкале Полинга электроотрицательность азота 3,05.
История открытия
Открыт в 1772 шотландским ученым Д. Резерфордом в составе продуктов сжигания угля, серы и фосфора как газ, непригодный для дыхания и горения («удушливый воздух») и в отличие от CO2 не поглощаемый раствором щелочи. Вскоре французский химик А. Л. Лавуазье (см. ЛАВУАЗЬЕ Антуан Лоран) пришел к выводу, что «удушливый» газ входит в состав атмосферного воздуха, и предложил для него название «azote» (от греч. azoos - безжизненный). В 1784 английский физик и химик Г. Кавендиш (см. КАВЕНДИШ Генри) установил присутствие азота в селитре (отсюда латинское название азота, предложенное в 1790 французским химиком Ж. Шанталем).
Нахождение в природе
В природе свободный (молекулярный) азот входит в состав атмосферного воздуха (в воздухе 78,09% по объему и 75,6% по массе азота), а в связанном виде - в состав двух селитр: натриевой NaNO3 (встречается в Чили, отсюда название чилийская селитра (см. ЧИЛИЙСКАЯ СЕЛИТРА)) и калиевой KNO3 (встречается в Индии, отсюда название индийская селитра) - и ряда других соединений. По распространенности в земной коре азот занимает 17-е место, на его долю приходится 0,0019% земной коры по массе. Несмотря на свое название, азот присутствует во всех живых организмах (1-3% на сухую массу), являясь важнейшим биогенным элементом (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ). Он входит в состав молекул белков, нуклеиновых кислот, коферментов, гемоглобина, хлорофилла и многих других биологически активных веществ. Некоторые, так называемые азотфиксирующие, микроорганизмы способны усваивать молекулярный азот воздуха, переводя его в соединения, доступные для использования другими организмами (см. Азотфиксация (см. АЗОТФИКСАЦИЯ)). Превращения соединений азота в живых клетках - важнейшая часть обмена веществ у всех организмов.
Получение
В промышленности азот получают из воздуха. Для этого воздух сначала охлаждают, сжижают, а жидкий воздух подвергают перегонке (дистилляции). Температура кипения азота немного ниже (-195,8 °C), чем другого компонента воздуха - кислорода (-182,9 °C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым. Потребителям газообразный азот поставляют в сжатом виде (150 атм. или 15 МПа) в черных баллонах, имеющих желтую надпись «азот». Хранят жидкий азот в сосудах Дьюара (см. ДЬЮАРА СОСУД).
В лаборатории чистый («химический») азот получают, добавляя при нагревании насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2:
NaNO2 + NH4Cl = NaCl + N2 + 2H2O.
Можно также нагревать твердый нитрит аммония:
NH4NO2 = N2 + 2H2O.
Физические и химические свойства
Плотность газообразного азота при 0 °C 1,25046 г/дм3, жидкого азота (при температуре кипения) - 0,808 кг/дм3. Газообразный азот при нормальном давлении при температуре -195,8 °C переходит в бесцветную жидкость, а при температуре -210,0 °C - в белое твердое вещество. В твердом состоянии существует в виде двух полиморфных модификаций: ниже -237,54 °C устойчива форма с кубической решеткой, выше - с гексагональной.
Критическая температура азота -146,95 °C, критическое давление 3,9МПа, тройная точка лежит при температуре -210,0 °C и давлении 125,03 гПа, из чего следует, что азот при комнатной температуре ни при каком, даже очень высоком давлении, нельзя превратить в жидкость.
Теплота испарения жидкого азота 199,3 кДж/кг (при температуре кипения), теплота плавления азота 25,5 кДж/кг (при температуре -210 °C).
Энергия связи атомов в молекуле N2 очень велика и составляет 941,6 кДж/моль. Расстояние между центрами атомов в молекуле 0,110 нм. Это свидетельствует о том, что связь между атомами азота тройная. Высокая прочность молекулы N2 может быть объяснена в рамках метода молекулярных орбиталей. Энергетическая схема заполнения молекулярных орбиталей в молекуле N2 показывает, что электронами в ней заполнены только связывающие s- и p-орбитали. Молекула азота немагнитна (диамагнитна).
Из-за высокой прочности молекулы N2процессы разложения различных соединений азота (в том числе и печально знаменитого взрывчатого вещества гексогена (см. ГЕКСОГЕН)) при нагревании, ударах и т. д. приводят к образованию молекул N2. Так как объем образовавшегося газа значительно больше, чем объем исходного взрывчатого вещества, гремит взрыв.
Химически азот довольно инертен и при комнатной температуре реагирует только с металлом литием (см. ЛИТИЙ) с образованием твердого нитрида лития Li3N. В соединениях проявляет различные степени окисления (от -3 до +5). С водородом образует аммиак (см. АММИАК) NH3. Косвенным путем (не из простых веществ) получают гидразин (см. ГИДРАЗИН) N2H4 и азотистоводородную кислоту HN3. Соли этой кислоты - азиды (см. АЗИДЫ). Азид свинца Pb(N3)2 разлагается при ударе, поэтому его используют как детонатор, например, в капсюлях патронов.
Известно несколько оксидов азота (см. АЗОТА ОКСИДЫ). С галогенами азот непосредственно не реагирует, косвенными путями получены NF3, NCl3, NBr3 и NI3, а также несколько оксигалогенидов (соединений, в состав которых, кроме азота, входят атомы и галогена, и кислорода, например, NOF3).
Галогениды азота неустойчивы и легко разлагаются при нагревании (некоторые - при хранении) на простые вещества. Так, NI3 выпадает в осадок при сливании водных растворов аммиака и иодной настойки. Уже при легком сотрясении сухой NI3 взрывается:
2NI3 = N2 + 3I2.
Азот не реагирует с серой, углеродом, фосфором, кремнием и некоторыми другими неметаллами.
При нагревании азот реагирует с магнием и щелочноземельными металлами, при этом возникают солеобразные нитриды общей формулы М3N2, которые разлагаются водой с образованием соответствующих гидроксидов и аммиака, например:
Са3N2 + 6H2O = 3Ca(OH)2 + 2NH3.
Аналогично ведут себя и нитриды щелочных металлов. Взаимодействие азота с переходными металлами приводит к образованию твердых металлоподобных нитридов различного состава. Например, при взаимодействии железа и азота образуются нитриды железа состава Fe2N и Fe4N. При нагревании азота с ацетиленом C2H2 может быть получен цианистый водород HCN.
Из сложных неорганических соединений азота наибольшее значение имеют азотная кислота (см. АЗОТНАЯ КИСЛОТА) HNO3, ее соли нитраты (см. НИТРАТЫ), а также азотистая кислота HNO2 и ее соли нитриты (см. НИТРИТЫ).
Применение
В промышленности газ азот используют главным образом для получения аммиака (см. АММИАК). Как химически инертный газ азот применяют для обеспечения инертной среды в различных химических и металлургических процессах, при перекачке горючих жидкостей. Жидкий азот широко используют как хладагент (см. ХЛАДАГЕНТ), его применяют в медицине, особенно в косметологии. Важное значение в поддержании плодородия почв имеют азотные минеральные удобрения (см. МИНЕРАЛЬНЫЕ УДОБРЕНИЯ).
АЗОТ (лат. Nitrogenium) - N, химический элемент V группы периодической системы, атомный номер 7, атомная масса 14,0067. Название от греческой a - отрицательная приставка и zoe - жизнь (не поддерживает дыхания и горения). Свободный азот состоит из 2-атомных молекул (N2); газ без цвета и запаха; плотность 1,25 г/л, tпл - 210 .C, tкип - 195,8 .C. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09% объема), разделением которого получают промышленный азот (более 3/4 идет на синтез аммиака). Применяется как инертная среда для многих технологических процессов; жидкий азот - хладагентный азот - один из основных биогенных элементов, входящий в состав белков и нуклеиновых кислот.
-а, м.
Химический элемент, газ без цвета и запаха, не поддерживающий горения (составляет основную по объему или массе часть воздуха, является одним из главных элементов питания растений).
[франц. azote от греч. ’α- не-, без- и ζωή - жизнь]
N (nitrogenium),
химический элемент (ат. номер 7) VA подгруппы периодической системы элементов. Атмосфера Земли содержит 78% (об.) азота. Чтобы показать, как велики эти запасы азота, отметим, что в атмосфере над каждым квадратным километром земной поверхности находится столько азота, что из него можно получить до 50 млн. т нитрата натрия или 10 млн. т аммиака (соединение азота с водородом) и все же это составляет малую долю азота, содержащегося в земной коре. Существование свободного азота свидетельствует о его инертности и трудности взаимодействия с другими элементами при обычной температуре. Связанный азот входит в состав как органической, так и неорганической материи. Растительный и животный мир содержит азот, связанный с углеродом и кислородом в белках. Помимо этого известны и могут быть получены в больших количествах азотсодержащие неорганические соединения, такие, как нитраты (NO3-), нитриты (NO2-), цианиды (CN-), нитриды (N3-) и азиды (N3-).
Историческая справка. Опыты А. Лавуазье, посвященные исследованию роли атмосферы в поддержании жизни и процессов горения, подтвердили существование относительно инертного вещества в атмосфере. Не установив элементную природу остающегося после сгорания газа, Лавуазье назвал его azote, что на древнегреческом означает "безжизненный". В 1772 Д.Резерфорд из Эдинбурга установил, что этот газ является элементом, и назвал его "вредный воздух". Латинское название азота происходит от греческих слов nitron и gen, что означает "образующий селитру".
Фиксация азота и азотный цикл. Термин "фиксация азота" означает процесс связывания атмосферного азота N2. В природе это может происходить двумя путями: либо бобовые растения, например горох, клевер и соя, накапливают на своих корнях клубеньки, в которых бактерии, фиксирующие азот, превращают его в нитраты, либо происходит окисление атмосферного азота кислородом в условиях разряда молнии. С.Аррениус установил, что таким способом фиксируется до 400 млн. т азота ежегодно. В атмосфере оксиды азота соединяются с дождевой водой, образуя азотную и азотистую кислоты. Кроме того, установлено, что с дождем и снегом на каждый гектар земли попадает ок. 6700 г азота; достигая почвы, они превращаются в нитриты и нитраты. Растения используют нитраты для образования растительных белковых веществ. Животные, питаясь этими растениями, усваивают белковые вещества растений и превращают их в животные белки. После смерти животных и растений происходит их разложение, азотные соединения превращаются в аммиак. Аммиак используется двумя путями: бактерии, не образующие нитратов, разрушают его до элементов, выделяя азот и водород, а другие бактерии образуют из него нитриты, которые другими бактериями окисляются до нитратов. Таким образом происходит круговорот азота в природе, или азотный цикл.
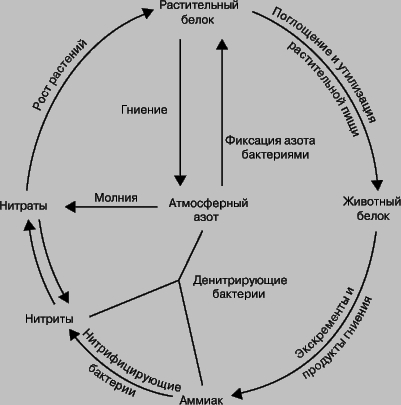
КРУГОВОРОТ АЗОТА В ПРИРОДЕ
Строение ядра и электронных оболочек. В природе существуют два стабильных изотопа азота: с массовым числом 14 (N содержит 7 протонов и 7 нейтронов) и с массовым числом 15 ( содержит 7 протонов и 8 нейтронов). Их соотношение составляет 99,635:0,365, поэтому атомная масса азота равна 14,008. Нестабильные изотопы азота 12N, 13N, 16N, 17N получены искусственно. Схематически электронное строение атома азота таково: 1s22s22px12py12pz1. Следовательно, на внешней (второй) электронной оболочке находится 5 электронов, которые могут участвовать в образовании химических связей; орбитали азота могут также принимать электроны, т.е. возможно образование соединений со степенью окисления от (-III) до (V), и они известны.
См. также АТОМА СТРОЕНИЕ.
Молекулярный азот. Из определений плотности газа установлено, что молекула азота двухатомна, т.е. молекулярная формула азота имеет вид NєN (или N2). У двух атомов азота три внешних 2p-электрона каждого атома образуют тройную связь :N:::N:, формируя электронные пары. Измеренное межатомное расстояние N-N равно 1,095 . Как и в случае с водородом (см. ВОДОРОД), существуют молекулы азота с различным спином ядра - симметричные и антисимметричные. При обычной температуре соотношение симметричной и антисимметричной форм равно 2:1. В твердом состоянии известны две модификации азота: a - кубическая и b - гексагональная с температурой перехода a (r) b -237,39° С. Модификация b плавится при -209,96° С и кипит при -195,78° C при 1 атм (см. табл. 1). Энергия диссоциации моля (28,016 г или 6,023*10 23 молекул) молекулярного азота на атомы (N2 2N) равна примерно -225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
Получение и применение. Способ получения элементного азота зависит от требуемой его чистоты. В огромных количествах азот получают для синтеза аммиака, при этом допустимы небольшие примеси благородных газов.
Азот из атмосферы. Экономически выделение азота из атмосферы обусловлено дешевизной метода сжижения очищенного воздуха (пары воды, CO2, пыль, другие примеси удалены). Последовательные циклы сжатия, охлаждения и расширения такого воздуха приводят к его сжижению. Жидкий воздух подвергают фракционной перегонке при медленном подъеме температуры. Первыми выделяются благородные газы, затем азот, и остается жидкий кислород. Очистка достигается многократностью процессов фракционирования. Таким методом производят многие миллионы тонн азота ежегодно, преимущественно для синтеза аммиака, который является исходным сырьем в технологии производства различных азотсодержащих соединений для промышленности и сельского хозяйства. Кроме того, очищенную азотную атмосферу часто используют, когда недопустимо присутствие кислорода.
Лабораторные способы. Азот в небольших количествах можно получать в лаборатории разными способами, окисляя аммиак или ион аммония, например:
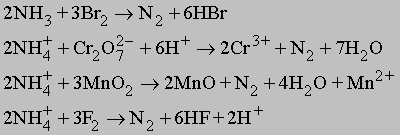
Очень удобен процесс окисления иона аммония нитрит-ионом:
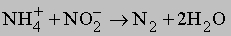
Известны и другие способы - разложение азидов при нагревании, разложение аммиака оксидом меди(II), взаимодействие нитритов с сульфаминовой кислотой или мочевиной:
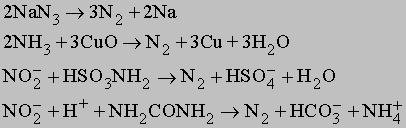
При каталитическом разложении аммиака при высокой температуре тоже можно получить азот:

Физические свойства. Некоторые физические свойства азота приведены в табл. 1.
Таблица 1. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА
Плотность, г/см3 0,808 (жидк.) Температура плавления, ° С -209,96 Температура кипения, ° С -195,8 Критическая температура, ° С -147,1 Критическое давление, атма 33,5 Критическая плотность, г/см3 а 0,311 Удельная теплоемкость, Дж/(мольЧК) 14,56 (15° С) Электроотрицательность по Полингу 3 Ковалентный радиус, 0,74 Кристаллический радиус, 1,4 (M3-) Потенциал ионизации, Вб
первый 14,54 второй 29,60
а Температура и давление, при которых плотности азота жидкого и газообразного состояния одинаковы.
б Количество энергии, необходимое для удаления первого внешнего и следующего за ним электронов, в расчете на 1 моль атомарного азота.
Химические свойства. Как уже было отмечено, преобладающим свойством азота при обычных условиях температуры и давления является его инертность, или малая химическая активность. Электронная структура азота содержит электронную пару на 2s-уровне и три наполовину заполненные 2р-орбитали, поэтому один атом азота может связывать не более четырех других атомов, т.е. его координационное число равно четырем. Небольшой размер атома также ограничивает количество атомов или групп атомов, которые могут быть связаны с ним. Поэтому многие соединения других членов подгруппы VA либо вовсе не имеют аналогов среди соединений азота, либо аналогичные соединения азота оказываются нестабильными. Так, PCl5 - стабильное соединение, а NCl5 не существует. Атом азота способен связываться с другим атомом азота, образуя несколько достаточно стабильных соединений, такие, как гидразин N2H4 и азиды металлов MN3. Такой тип связи необычен для химических элементов (за исключением углерода и кремния). При повышенных температурах азот реагирует со многими металлами, образуя частично ионные нитриды MxNy. В этих соединениях азот заряжен отрицательно. В табл. 2 приведены степени окисления и примеры соответствующих соединений.
Таблица 2. СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА И СООТВЕТСТВУЮЩИЕ СОЕДИНЕНИЯ
Степень окисления Примеры соединений
-III Аммиак NH3, ион аммония NH4+, нитриды M3N2 -II Гидразин N2H4 -I Гидроксиламин NH2OH I Гипонитрит натрия Na2N2O2, оксид азота(I) N2O II Оксид азота(II) NO III Оксид азота(III) N2O3, нитрит натрия NaNO2 IV Оксид азота(IV) NO2, димер N2O4 V Оксид азота(V) N2O5, азотная кислота HNO3 и ее соли (нитраты) Нитриды. Соединения азота с более электроположительными элементами, металлами и неметаллами - нитриды, - похожи на карбиды и гидриды. Их можно разделить в зависимости от характера связи M-N на ионные, ковалентные и с промежуточным типом связи. Как правило, это кристаллические вещества.
Ионные нитриды. Связь в этих соединениях предполагает переход электронов от металла к азоту с образованием иона N3-. К таким нитридам относятся Li3N, Mg3N2, Zn3N2 и Cu3N2. Кроме лития, другие щелочные металлы IA подгруппы нитридов не образуют. Ионные нитриды имеют высокие температуры плавления, реагируют с водой, образуя NH3 и гидроксиды металлов.
Ковалентные нитриды. Когда электроны азота участвуют в образовании связи совместно с электронами другого элемента без перехода их от азота к другому атому, образуются нитриды с ковалентной связью. Нитриды водорода (например, аммиак и гидразин) полностью ковалентны, как и галогениды азота (NF3 и NCl3). К ковалентным нитридам относятся, например, Si3N4, P3N5 и BN - высокостабильные белые вещества, причем BN имеет две аллотропные модификации: гексагональную и алмазоподобную. Последняя образуется при высоких давлениях и температурах и имеет твердость, близкую к твердости алмаза.
Нитриды с промежуточным типом связи. Переходные элементы в реакции с NH3 при высокой температуре образуют необычный класс соединений, в которых атомы азота распределены между регулярно расположенными атомами металла. В этих соединениях нет четкого смещения электронов. Примеры таких нитридов - Fe4N, W2N, Mo2N, Mn3N2. Эти соединения, как правило, совершенно инертны и обладают хорошей электрической проводимостью.
Водородные соединения азота. Азот и водород взаимодействуют, образуя соединения, отдаленно напоминающие углеводороды (см. также ОРГАНИЧЕСКАЯ ХИМИЯ). Стабильность азотоводородов уменьшается с увеличением числа атомов азота в цепи в отличие от углеводородов, которые устойчивы и в длинных цепях. Наиболее важные нитриды водорода - аммиак NH3 и гидразин N2H4. К ним относится также азотистоводородная кислота HNNN (HN3).
Аммиак NH3. Аммиак - один из наиболее важных промышленных продуктов современной экономики. В конце 20 в. США производили ок. 13 млн. т аммиака ежегодно (в пересчете на безводный аммиак).
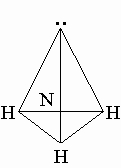
Строение молекулы. Молекула NH3 имеет почти пирамидальное строение. Угол связи H-N-H составляет 107°, что близко к величине тетраэдрического угла 109°. Неподеленная электронная пара эквивалентна присоединенной группе, в результате координационное число азота равно 4 и азот располагается в центре тетраэдра.
Cвойства аммиака. Некоторые физические свойств аммиака в сравнении с водой приведены в табл. 3.
Таблица 3. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА И ВОДЫ
Температуры кипения и плавления у аммиака намного ниже, чем у воды, несмотря на близость молекулярных масс и сходство строения молекул. Это объясняется относительно большей прочностью межмолекулярных связей у воды, чем у аммиака (такая межмолекулярная связь называется водородной).
Аммиак как растворитель. Высокая диэлектрическая проницаемость и дипольный момент жидкого аммиака позволяют использовать его как растворитель для полярных или ионных неорганических веществ. Аммиак-растворитель занимает промежуточное положение между водой и органическими растворителями типа этилового спирта. Щелочные и щелочноземельные металлы растворяются в аммиаке, образуя темносиние растворы. Можно полагать, что в растворе происходит сольватация и ионизация валентных электронов по схеме
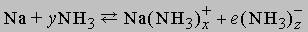
Синий цвет связывают с сольватацией и движением электронов или с подвижностью "дырок" в жидкости. При высокой концентрации натрия в жидком аммиаке раствор принимает бронзовую окраску и отличается высокой электропроводностью. Несвязанный щелочной металл можно выделить из такого раствора испарением аммиака или добавлением хлорида натрия. Растворы металлов в аммиаке являются хорошими восстановителями. В жидком аммиаке происходит автоионизация

аналогично процессу, протекающему в воде
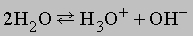
Некоторые химические свойства обеих систем сопоставлены в табл. 4. Жидкий аммиак как растворитель имеет преимущество в некоторых случаях, когда невозможно проводить реакции в воде из-за быстрого взаимодействия компонентов с водой (например, окисление и восстановление). Например, в жидком аммиаке кальций реагирует с KCl с образованием CaCl2 и K, поскольку CaCl2 нерастворим в жидком аммиаке, а К растворим, и реакция протекает полностью. В воде такая реакция невозможна из-за быстрого взаимодействия Ca с водой. Получение аммиака. Газообразный NH3 выделяется из солей аммония при действии сильного основания, например, NaOH:
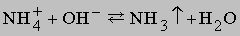
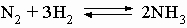
Метод применим в лабораторных условиях. Небольшие производства аммиака основаны также на гидролизе нитридов, например Mg3N2, водой. Цианамид кальция CaCN2 при взаимодействии с водой также образует аммиак. Основным промышленным методом получения аммиака является каталитический синтез его из атмосферного азота и водорода при высоких температуре и давлении:
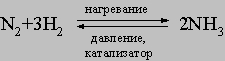
Водород для этого синтеза получают термическим крекингом углеводородов, действием паров воды на уголь или железо, разложением спиртов парами воды или электролизом воды. На синтез аммиака получено множество патентов, отличающихся условиями проведения процесса (температура, давление, катализатор). Существует способ промышленного получения при термической перегонке угля. С технологической разработкой синтеза аммиака связаны имена Ф.Габера и К.Боша.
Химические свойства аммиака. Кроме реакций, упомянутых в табл. 4, аммиак реагирует с водой, образуя соединение NH3ЧH2O, которое часто ошибочно считают гидроксидом аммония NH4OH; в действительности существование NH4OH в растворе не доказано. Водный раствор аммиака ("нашатырный спирт") состоит преимущественно из NH3, H2O и малых концентраций ионов NH4+ и OH-, образующихся при диссоциации
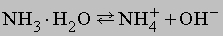
Основной характер аммиака объясняется наличием неподеленной электронной пары азота :NH3. Поэтому NH3 - это основание Льюиса, которое имеет высшую нуклеофильную активность, проявляемую в форме ассоциации с протоном, или ядром атома водорода:

Любые ион или молекула, способные принимать электронную пару (электрофильное соединение), будут взаимодействовать с NH3 с образованием координационного соединения. Например:
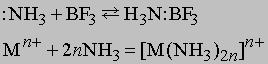
Символ Mn+ представляет ион переходного металла (B-подгруппы периодической таблицы, например, Cu2+, Mn2+ и др.). Любая протонная (т.е. Н-содержащая) кислота реагирует с аммиаком в водном растворе с образованием солей аммония, таких, как нитрат аммония NH4NO3, хлорид аммония NH4Cl, сульфат аммония (NH4)2SO4, фосфат аммония (NH4)3PO4. Эти соли широко применяются в сельском хозяйстве как удобрения для введения азота в почву. Нитрат аммония кроме того применяют как недорогое взрывчатое вещество; впервые оно было применено с нефтяным топливом (дизельным маслом). Водный раствор аммиака применяют непосредственно для введения в почву или с орошающей водой. Мочевина NH2CONH2, получаемая синтезом из аммиака и углекислого газа, также является удобрением. Газообразный аммиак реагирует с металлами типа Na и K с образованием амидов:
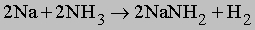
Аммиак реагирует с гидридами и нитридами также с образованием амидов:
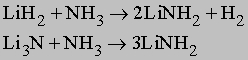
Амиды щелочных металлов (например, NaNH2) реагируют с N2O при нагревании, образуя азиды:
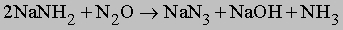
Газообразный NH3 восстанавливает оксиды тяжелых металлов до металлов при высокой температуре, по-видимому, благодаря водороду, образующемуся в результате разложения аммиака на N2 и H2:
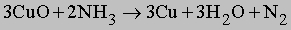
Атомы водорода в молекуле NH3 могут замещаться на галоген. Иод реагирует с концентрированным раствором NH3, образуя смесь веществ, содержащую NI3. Это вещество очень неустойчиво и взрывается при малейшем механическом воздействии. При реакции NH3 c Cl2 образуются хлорамины NCl3, NHCl2 и NH2Cl. При воздействии на аммиак гипохлорита натрия NaOCl (образуется из NaOH и Cl2) конечным продуктом является гидразин:
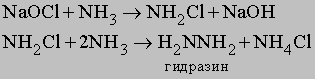
Гидразин. Приведенные выше реакции представляют собой способ получения моногидрата гидразина состава N2H4ЧH2O. Безводный гидразин образуется при специальной перегонке моногидрата с BaO или другими водоотнимающими веществами. По свойствам гидразин слегка напоминает пероксид водорода H2O2. Чистый безводный гидразин - бесцветная гигроскопичная жидкость, кипящая при 113,5° C; хорошо растворяется в воде, образуя слабое основание
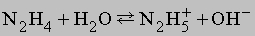
В кислой среде (H+) гидразин образует растворимые соли гидразония типа [[NH2NH2H]]+X-. Легкость, с которой гидразин и некоторые его производные (например, метилгидразин) реагируют с кислородом, позволяет использовать его в качестве компонента жидкого ракетного топлива. Гидразин и все его производные сильно ядовиты. Оксиды азота. В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2 (N2O4), N2O5. Имеется скудная информация об образовании пероксидов азота (NO3, NO4). Оксид азота(I) N2O (монооксид диазота) получается при термической диссоциации нитрата аммония:
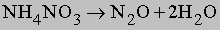
Молекула имеет линейное строение
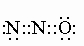
N2O довольно инертен при комнатной температуре, но при высоких температурах может поддерживать горение легко окисляющихся материалов. N2O, известный как "веселящий газ", используют для умеренной анестезии в медицине. Оксид азота(II) NO - бесцветный газ, является одним из продуктов каталитической термической диссоциации аммиака в присутствии кислорода:
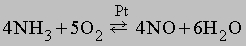
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:
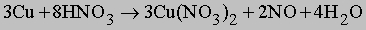
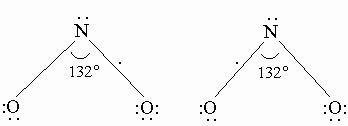
NO можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например, в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями. В жидком или твердом состоянии оксид имеет голубую окраску, поскольку неспаренный электрон вызывает частичную ассоциацию в жидком состоянии и слабую димеризацию в твердом состоянии: 2NO N2O2. Оксид азота(III) N2O3 (триоксид азота) - ангидрид азотистой кислоты: N2O3 + H2O 2HNO2. Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (-20° С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. -102,3° С), в жидком и газообразном состояния он снова разлагается на NO и NO2. Оксид азота(IV) NO2 (диоксид азота) также имеет в молекуле неспаренный электрон (см. выше оксид азота(II)). В строении молекулы предполагается трехэлектронная связь, и молекула проявляет свойства свободного радикала (одна линия соответствует двум спаренным электронам):
NO2 получается каталитическим окислением аммиака в избытке кислорода или окислением NO на воздухе:
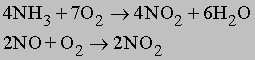
а также по реакциям:
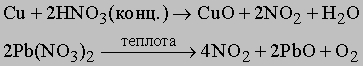
При комнатной температуре NO2 - газ темнокоричневого цвета, обладает магнитными свойствами благодаря наличию неспаренного электрона. При температурах ниже 0° C молекула NO2 димеризуется в тетраоксид диазота, причем при -9,3° C димеризация протекает полностью: 2NO2 N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100° C остается в виде димера 10% N2O4. NO2 (или N2O4) реагирует в теплой воде с образованием азотной кислоты: 3NO2 + H2O = 2HNO3 + NO. Технология NO2 поэтому очень существенна как промежуточная стадия получения промышленно важного продукта - азотной кислоты. Оксид азота(V) N2O5 (устар. ангидрид азотной кислоты) - белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида фосфора P4O10:
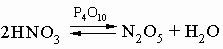
N2O5 легко растворяется во влаге воздуха, вновь образуя HNO3. Свойства N2O5 определяются равновесием
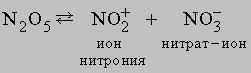
N2O5 - хороший окислитель, легко реагирует, иногда бурно, с металлами и органическими соединениями и в чистом состоянии при нагреве взрывается. Вероятную структуру N2O5 можно представить как
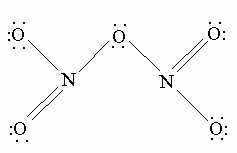
Оксокислоты азота. Для азота известны три оксокислоты: гипоазотистая H2N2O2, азотистая HNO2 и азотная HNO3. Гипоазотистая кислота H2N2O2 - очень нестабильное соединение, образуется в неводной среде из соли тяжелого металла - гипонитрита при действии другой кислоты: M2N2O2 + 2HX 2MX + H2N2O2. При выпаривании раствора образуется белое взрывчатое вещество с предполагаемой структурой H-O-N=N-O-H.
Азотистая кислота HNO2 не существует в чистом виде, однако водные растворы ее невысокой концентрации образуются при добавлении серной кислоты к нитриту бария:
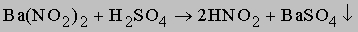
Азотистая кислота образуется также при растворении эквимолярной смеси NO и NO2 (или N2O3) в воде. Азотистая кислота немного сильнее уксусной кислоты. Степень окисления азота в ней +3 (ее структура H-O-N=O), т.е. она может являться и окислителем, и восстановителем. Под действием восстановителей она восстанавливается обычно до NO, а при взаимодействии с окислителями окисляется до азотной кислоты. Скорость растворения некоторых веществ, например металлов или иодид-иона, в азотной кислоте зависит от концентрации азотистой кислоты, присутствующей в виде примеси. Соли азотистой кислоты - нитриты - хорошо растворяются в воде, кроме нитрита серебра. NaNO2 применяется в производстве красителей. Азотная кислота HNO3 - один из наиболее важных неорганических продуктов основной химической промышленности. Она используется в технологиях множества других неорганических и органических веществ, например, взрывчатых веществ, удобрений, полимеров и волокон, красителей, фармацевтических препаратов и др.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Справочник азотчика. М., 1969 Некрасов Б.В. Основы общей химии. М., 1973 Проблемы фиксации азота. Неорганическая и физическая химия. М., 1982
АЗОТ (Nitrogenium), N, химический элемент V группы периодической системы, атомный номер 7, атомная масса 14,0067; газ, tкип - 195,80 °С. Азот - основной компонент воздуха (78,09% по объему), входит в состав всех живых организмов (в организме человека около 3% по массе азота, в белках до 17%), участвует в круговороте веществ в природе. Основная область применения - синтез аммиака; соединения азота - азотные удобрения. Азот - инертная среда в химических и металлургических процессах, в овощехранилищах и т.д. Открыл азот в 1772 шотландский ученый Д. Резерфорд.
один из пяти главных городов филистимских на восточном берегу Средиземного моря, между Аккароном и Аскалоном. Здесь находился храм Дагона, в котором филистимляне поставили ковчег завета (Нав. 11, 22; 13,3; 15, 47; Суд. 1, 18; Деян. 8, 40).
сущ., кол-во синонимов: 8
газ (55)
неметалл (17)
нитроген (1)
органоген (6)
селитрород (3)
селитротвор (3)
селитряк (3)
элемент (159)
Это слово было создано искусственно в 1787 году, когда потребовался научный термин для названия этого газа. Поскольку этот газ не поддерживает дыхания и название ему было придумано соответствующее: из греческого zot "жизнь" и греческой же отрицательной приставки а; таким образом, в переводе с греческого это искусственное слово означает "неживой". В русский язык этот термин попал из французского - именно во Франции это слово и было создано.
Французское - azote.
Греческое - azoos (неживой).
Слово «азот» стало известно и употребляется в русском языке с XVIII в. как научный термин, называющий химический элемент, бесцветный газ.
В русском языке слово «азот» считается заимствованием из французского, где azote представляет собой придуманный известным химиком Лавуазье термин. Слово образовано от греческого а - «не» и zoos «живой», буквально - «не дающий жизни», «нежизненный газ». Термин Лавуазье стал распространенным во многих европейских языках (английском, немецком и т.д.).
Производное: азотистый.
Заимств. из франц. яз. в XVIII в. Франц. azote является новообразованием химика Лавуазье (греч. a «не» и zōos «живой»). Азот буквально - «не дающий жизни». См. зоология с тем же корнем.
АЗОТ -а м. azote m. <араб. 1787. Лексис.
1. алхим. Первая материя металлов - металлическая ртуть. Сл. 18. Пустился он <парацельс> на конец по свету, предлагая всем за весьма умеренную цену свой Лауданум и свой Азот, для изцеления всех возможных болезней. НЕС 2 75.
2. хим. Азот. Новейшие же Химики Французские называют сим именем часть Атмосферического воздуха, неспособную к дыханию и горению. Ян. 1 51. После прекращения бомбардировки твердого азота катодными лучами свечение продолжается. Природа 1924 1-6 42. Без сомнения, желваки эти являются аккумуляторами атмосферного азота. Природа 1937 6 94. | перен. Видно необходимо, чтобы в нравственной атмосфере было семьдесят девять процентов мертвого газа и только двадцать один живого. Все они азот; азота и требуют, чтобы жизнь не кипятилась очень, не шла семимильными шагами, не сгорала ярким пламенем, а тлела себе осторожно, потихоньку, полегоньку. Дело 1876 12 2 125. - Лекс. Ян. 1803: азот, азоф или азох; Сл. 18: азо/т 1786.
АЗОТ (N) химический элемент, газ, без цвета, вкуса и запаха; составляет 4/5 (79 %) воздуха; уд. вес 0,972; атомный вес 14; сгущается в жидкость при - 140 °С. и давлении 200 атмосфер; составная часть многих растительных и животных веществ.
- Монополист в воздухе.
- Удобрение, витающее в воздухе.
- Воздух на три четверти.
- Газ, который закачивают в шины гоночного болида.
- Этот газ, составляющая воздуха, практически отсутствовал в первичной атмосфере Земли 4,5 млрд лет назад.
- Газ, делающий металл хрупким.
- Главный компонент вдыхаемого вами воздуха, которым в чистом виде дышать нельзя.
- Газ, чья жидкость служит для охлаждения сверхточных приборов.
- Какой газ в жидком состоянии хранят в сосуде Дьюара?
- Газ, заморозивший Терминатора II.
- Газ-охладитель.
- Какой газ тушит огонь?
- Самый распространённый элемент в атмосфере.
- Химический элемент, N.
- Газ, из которого на 78% состоит воздух.
- Химический элемент, один из основных питательных веществ растений.
- Химический элемент, составная часть воздуха.
- Замораживающий газ.
- В 1887 году биолог Томас Гексли предсказывал гибель человечества из-за того, что растения используют весь этот элемент из почвы, а месторождения чилийской селитры истощатся.
- Хорваты называют этот газ «душиком».
- Химический элемент, газ.
- На латыни этот газ называется «nitrogenium», то есть «рождающий селитру».
- Название этого газа произошло от латинского слова «безжизненный».
- Основа всех нитратов.
- Магический меч Парацельса.
АЗОТА ОКСИДЫ - АЗО́ТА ОКСИ́ДЫ: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO - несолеобразующие оксиды, N2O3 с водой дает азотистую кислоту, N2O5 - азотную, NO2 - их смесь. Все оксиды азота физиологически активны. N2O - средство для наркоза («веселящий газ»), NO и NO2 - промежуточные продукты в производстве азотной кислоты, NO2 - окислитель в жидком ракетном топливе, смесевых ВВ, нитрующий агент.
АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы) - сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO - несолеобразующие оксиды, N2O3 с водой дает азотистую кислоту, N2O5 - азотную, NO2 - их смесь. Все оксиды азота физиологически активны. N2O - средство для наркоза ("веселящий газ"), NO и NO2 - промежуточные продукты в производстве азотной кислоты, NO2 - окислитель в жидком ракетном топливе, смесевых ВВ, нитрующий агент.
ПОДГРУППА VA. СЕМЕЙСТВО АЗОТА ФОСФОРА
Тенденция изменения свойств от неметаллических до металлических, которая выявлена в подгруппах IIIA и IVA, характерна и для этой подгруппы. Переход к металличности (хотя и нерезкий) начинается с мышьяка, у которого в отличие от фосфора уже заполнен 18 электронами электронный слой, расположенный под валентными электронами (табл. 6). Однако ни As, ни Sb не имеют типичных металлических свойств, как можно было бы ожидать у элементов с такой электронной структурой. Полностью металлическая природа элемента проявляется в этой подгруппе только у висмута, хотя и его металлические свойства не ярко выражены, особенно по проводимости.
АЗОТ
Химический элемент азот, N, седьмой элемент периодической таблицы элементов и первый элемент подгруппы VA. Наиболее распространенная форма азота изотоп 147N, в ядре которого содержится семь протонов и семь нейтронов. Общее содержание этого изотопа азота в природе равно 99,635%, остальное количество (0,365%) составляет изотоп 157N, содержащий в ядре 7 протонов и восемь нейтронов; атомная масса азота соответственно равна 14,008.
Около 79% (об.) азота в атмосфере состоит из двухатомных молекул N2. В природе существует примерный баланс азота: с одной стороны, азот из атмосферы усваивается бактериями и расходуется в химических и электрических (молния) процессах, а с другой, азот возвращается в атмосферу при разложении азотсодержащих веществ. Азот бесцветный газ. Он имеет ничтожную растворимость в воде, всего 23 мл/л при 0° C и 1 атм.
Азот выделяют из воздуха сжижением. При этом вначале азот и кислород отделяются от CO2, паров H2O и некоторых примесей химическими и механическими методами (адсорбция, охлаждение, фильтрация). При медленном нагревании жидкий воздух подвергается фракционной перегонке и при этом азот отделяется от остающегося жидкого кислорода. Благородные газы (He, Ne, Ar, Kr, Xe) выкипают раньше, чем азот, и, если необходимо, их сжижают вместе.
См. также ВОЗДУХ.
Химическая связь в молекуле азота очень прочная, поэтому азот совершенно инертен при низких температурах. В условиях электрического разряда или электрической дуги азот соединяется с кислородом, образуя несколько оксидов, в основном оксид азота(II) NO и оксид азота(IV) NO2. Известны и другие оксиды азота, их получают по следующим реакциям:
1) оксид азота(I) N2O
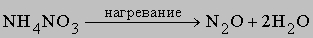
2) оксид азота(III) N2O3
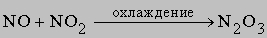
3) димер оксида азота(IV) N2O4
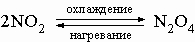
4) оксид азота(V) N2O5
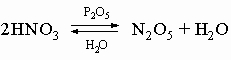
Аммиак. При высоких температуре и давлении азот соединяется с водородом на поверхности платинового катализатора, образуя важное соединение аммиак:
Этот процесс (в промышленности применяют метод Габера или метод Клода) относится к процессам фиксации азота, так как образующийся из химически инертного молекулярного атмосферного азота аммиак способен к участию в химических реакциях и образованию других соединений азота и может использоваться для удобрения почвы. Количества азота в атмосфере, находящегося над 1 кв. километром земной поверхности, теоретически достаточно для получения 7 млн. т аммиака. Среди других соединений азота, пригодных в качестве удобрений для почвы и получаемых из аммиака, известны нитрат аммония NH4NO3, получаемый по реакции аммиака с азотной кислотой, фосфат аммония (NH4)3PO4, получаемый по реакции аммиака с фосфорной кислотой H3PO4, и мочевина, образующаяся из аммиака и CO2. Из аммиака также можно получать азотную кислоту HNO3 (окислением аммиака на воздухе с поглощением оксидов азота водой), гидразин NH2NH2 (по реакции аммиака с гипохлоритом натрия NaOCl). Гидразин и некоторые его производные используются в качестве ракетного топлива. Аммиак, гидразин и азотистоводородная кислота HN3 это гидриды азота. Аммиак и вода имеют ряд сходных свойств, позволяющих использовать аммиак как растворитель для некоторых неорганических веществ. Для сравнения приведены два процесса автоионизации аммиака и воды:
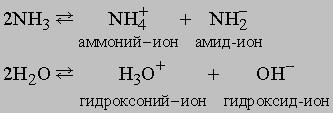
Нитриды. При высокой температуре азот реагирует с некоторыми металлами, образуя соединения класса нитридов. Например,
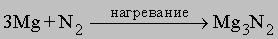
Нитрид магния гидролизуется:
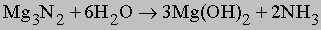
Другие азотсодержащие соединения. Азот также реагирует с карбидом кальция CaC2 при высокой температуре с образованием цианамида кальция CaCN2. При гидролизе цианамида образуется аммиак:
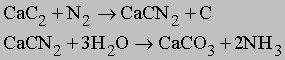
Нитрат натрия NaNO3, известный как чилийская селитра, добывается в больших количествах в Чили. Он используется как сырье для производства азотной кислоты по следующей реакции:
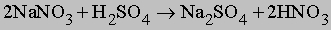
Азот, образуя связь с углеродом, входит в состав многих природных органических соединений, например аминокислот RCHNH2COOH, аминов RNH2 и амидов RCONH2
(см. также АЗОТ).
ФОСФОР, МЫШЬЯК, СУРЬМА, ВИСМУТ
Получение. Некоторые элементы этой подгруппы встречаются в свободном состоянии и известны с древних времен; они относительно легко получаются из их оксидов или сульфидов. Сурьма иногда встречается в свободном состоянии, а другие элементы в основном в виде оксидов или сульфидов и реже в соединениях с другими неметаллами (см. табл. 6). Фосфор занимает 12-е место по распространенности элементов в природе. Он входит в состав многих горных пород и содержится в живых организмах (в костях, зубах и т.д.). Фосфор впервые был выделен из человеческой мочи. Химические связи PO в фосфат-ионе PO43одни из наиболее прочных, поэтому для получения свободного фосфора требуются большие затраты энергии. В промышленности фосфор получают при прокаливании смеси фосфата кальция, оксида кремния(IV) (песка) и кокса при высокой температуре в соответствии с реакцией Ca3(PO4)2 + 3SiO2 + 5C (r) 3CaSiO3 + 0,5P4 + 5CO
Фосфор возгоняют и плавят, в результате образуется белая модификация фосфора, которую хранят под слоем холодной воды (с холодной водой он не реагирует). Другие элементы этого семейства получают из оксидов восстановлением углеродом.
Аллотропия. Все элементы подгруппы, встречающиеся в свободном состоянии, имеют аллотропные модификации (состояния с различной кристаллической или атомной структурой вещества). С ростом атомного номера многообразие и сложность модификаций постепенно уменьшаются. У фосфора известны более 10 аллотропических модификаций, из которых наиболее важные белый, красный и черный фосфор; взаимопревращения между ними представлены следующей схемой:
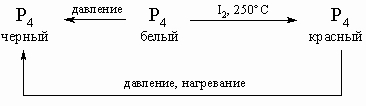
Отметим некоторые различия в свойствах. Белая модификация как более реакционноспособная активно реагирует с молекулярным кислородом, поэтому белый фосфор применяют в устройствах для воспламенения. Он растворим в CS2, но нерастворим в холодной воде. Белый фосфор очень ядовит, вызывает сильные ожоги и работа с ним требует особой осторожности. Белый фосфор имеет тетраэдрическое строение, компактность такой молекулы объясняет высокую летучесть фосфора. Ковалентные связи в тетраэдре не очень прочные, чем и объясняется образование оксидов, некоторых сульфидов и других соединений. Красная модификация фосфора значительно менее реакционноспособна, чем белая; красный фосфор нерастворим в любых растворителях (как и черный), воде и не так ядовит. Структура ближе к форме связанных треугольников, чем к тетраэдру. Соединения, образуемые из белого или красного фосфора, идентичны. Черный фосфор обладает металличностью некоторой проводимостью и блеском. Мышьяк образует аллотропные модификации, частично подобные модификациям фосфора. Сурьма существенно отличается от фосфора и мышьяка, а висмут демонстрирует многие свойства, характерные для металлических структур.
Применение. Фосфор применяется в основном для химических синтезов, другие элементы находят применение в технологии сплавов. Сурьму добавляют к свинцу для увеличения твердости; сплавы, содержащие до 12% (масс.) сурьмы, применяют в производстве аккумуляторов. Сплавы свинца с висмутом, как и с другими элементами этого семейства, используют в производстве легкоплавких материалов, например, сплава Вуда (Pb, Bi, Sn, Cd). Соединения мышьяка являются инсектицидами. Фосфид натрия (Na3P), синтезируемый из элементов, применяют для изготовления морских сигнальных огней. При реакции фосфидов с водой образуется ядовитое вещество фосфин PH3, запах которого часто обнаруживается при реакции цинка или железа с HCl в водной среде, так как фосфиды могут присутствовать как примеси.
Реакции. Для всех элементов подгруппы характерно общее строение внешнего электронного слоя ns2np3, однако трудно достаточно точно предсказать химические свойства элементов. Азот проявляет все степени окисления от III до V, у фосфора (см. табл. 6) реализуются почти все степени окисления от III до V. Разнообразие степеней окисления уменьшается с ростом массы элемента; висмут в степени окисления V неустойчив, легко восстанавливается до степени окисления III, основной для висмута. В особых условиях все же можно получить соединения этих элементов с необычными степенями окисления. Азот может принимать только 8 электронов от 4 доноров, а остальные элементы являются акцепторами 10, 12 и более электронов (от 5, 6 и более доноров или лигандов). Однако в этом у них мало общего, определенные сходства и различия более четко проявляются при рассмотрении соединений этих элементов.
Оксиды. Кроме азота, все элементы подгруппы VA активно реагируют с кислородом, фосфор образует оксид P(V) P4O10, а другие, более тяжелые элементы только оксиды в степени окисления III. Более легкие элементы образуют оксиды тетраэдрического строения. Для мышьяка и сурьмы кроме As4O6 и Sb4O6 известны также As2O5, Sb2O4 и Sb2O5, но структуры их недостаточно изучены. As2O5 и Sb2O5 получают дегидратацией соответствующих кислот, H3AsO4 и HSb(OH)6. Sb2O4 образуется при прокаливании Sb4O6 или Sb2O5 на воздухе.
Кислоты. Фосфорные кислоты легко получаются при растворении оксидов фосфора. Схема образования многообразных кислот и солей фосфора приведена ниже:
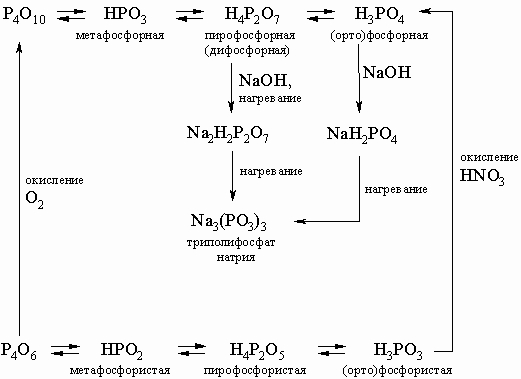
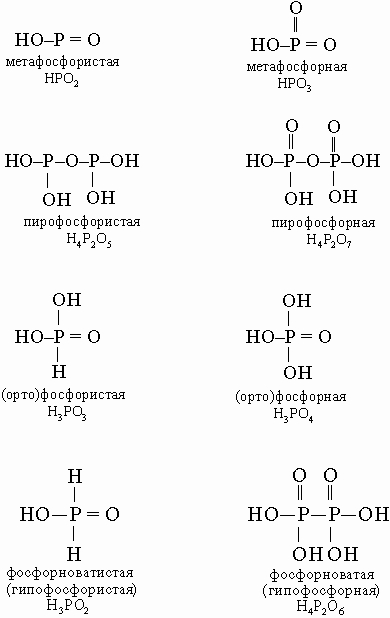
В этой схеме отсутствует фосфорноватистая (гипофосфористая) кислота H3PO2 (сильный восстановитель, образуется в небольших количествах при реакции белого фосфора с кипящей водой), а также фосфорноватая (гипофосфорная) кислота H4P2O6 (получается по реакции красного фосфора с NaOCl в кислой среде). Ниже приводятся структурные формулы некоторых кислот фосфора:
Кислоты других элементов, проявляющих больше металлических свойств, отчасти сходны по форме, однако с ростом молекулярной массы уменьшается способность атомов образовывать прочные двойные связи (такие, как P=O). Поэтому образуются одиночные OH-группы, например, состав ортосурьмяной кислоты HSb(OH)6, а не H3SbO4.
Фосфорные кислоты и их соли находят многочисленные применения в промышленности. Средние фосфаты и полифосфаты Na3P3O6 и более сложного состава применяют в многотоннажном производстве моющих средств, в процессах умягчения и очистки воды. Фосфат кальция CaH4P2O8 применяют при изготовлении муки и в качестве заменителя дрожжей. Ca3P2O8 применяют в производстве зубных порошков и паст, пирофосфаты расходуются для изготовления буровых растворов, в стекольном производстве, в водоподготовке, для очистки металлов и антикоррозионной защиты. Тысячи тонн фосфатов используют как удобрение в сельском хозяйстве: практически нерастворимый Ca3(PO4)2 переводят в растворимую форму Ca(H2PO4)2 добавлением серной или азотной кислоты, причем при использовании азотной кислоты в почву вводится помимо фосфора также и азот в усвояемой форме.
Сульфиды. Сера реагирует непосредственно со всеми элементами подгруппы VA, с фосфором образуются P4S3, P4S7, P4S5, а с P4O10 образуется оксосульфид P4O6S2. P4S3 используют для производства легковоспламеняющихся (небезопасных) спичек, а для изготовления безопасных спичек применяют смесь P4S3 и Sb2S3: сульфид сурьмы входит в состав спичечной головки вместе с окислителем KClO3, а смесь P4S3 и Sb2S3 с песком покрывает боковую поверхность спичечного коробка. Существование As2S5 и Sb2S5 не установлено надежно, а образующийся Bi2S5 самопроизвольно разлагается на S и Bi2S3.
Гидриды. Изменения свойств гидридов элементов этой подгруппы вполне предсказуемы. Аммиак NH3 стабильное соединение со слабыми основными свойствами (донор электронной пары), а в жидком состоянии слабый донор H+. Устойчивость гидридов в подгруппе убывает с увеличением атомного номера, ослабевают донорные способности электронной пары, но возрастает способность к отщеплению водорода; получить BiH3 не просто.
Галогениды. В ряду галогенидов систематичности свойств не наблюдается. Только BiF3 является ионным соединением, что связано с максимальной металличностью висмута в этой подгруппе элементов. Все элементы образуют галогениды состава MX3, а фосфор также и P2Cl4 и P2I4. Среди галогенидов MX5 не установлено образование AsCl5, а висмут образует только BiF5, легко разлагающийся на F2 и BiF3 (поэтому BiF5 хороший фторирующий агент). Фосфор несмотря на малый радиус способен образовывать PCl5 и даже PBr5. Устойчивость этих галогенидов фосфора объясняется слабым окислительным действием P(V) в отличие от Bi(V), а также особенностями строения галогенида (в случае хлорида PCl4+ PCl6). Галогениды MX3 несмотря на наличие неподеленной электронной пары не образуют аддуктов по донорно-акцепторному механизму. Все галогениды энергично реагируют с водой (гидролиз), например:
PCl3 + 3H2O -> P(OH)3 + 3HCl
Однако гидролиз галогенидов азота(III) протекает иначе, чем у галогенидов остальных элементов этой группы.
Взаимодействие с кислотами. Элементы этой группы по-разному реагируют с кислотами. Ни один из них самопроизвольно не взаимодействует с HCl с выделением водорода. Кислоты-окислители, такие, как HNO3, реагируют с As и Sb; сурьма при длительной обработке образует Sb2O4. Висмут растворяется в азотной кислоте, образуя нитрат Bi(NO3)3. Сульфаты мышьяка, сурьмы и висмута можно получать при растворении соответствующих оксидов в серной кислоте.
См. также ФОСФОР; МЫШЬЯК; СПИЧКИ.
ж.
Избыточное содержание в крови азотистых продуктов белкового обмена - мочевины, мочевой кислоты и т.п.
Азотеми́я (от азот и греч. háima - кровь), избыточное содержание в крови азотсодержащих продуктов белкового обмена (мочевины, мочевой кислоты, креатинина и др.) при почечных заболеваниях, усиленном распаде тканевых белков, резком уменьшении содержания хлоридов и т. д.
* * *
АЗОТЕМИЯ - АЗОТЕМИ́Я (от азот (см. АЗОТ) и греч. haima - кровь), избыточное содержание в крови азотсодержащих продуктов белкового обмена (мочевины, мочевой кислоты, креатинина и др.) при почечных заболеваниях, усиленном распаде тканевых белков, резком уменьшении содержания хлоридов и т. д.
АЗОТЕМИЯ (от азот и греч. haima - кровь) - избыточное содержание в крови азотсодержащих продуктов белкового обмена (мочевины, мочевой кислоты, креатинина и др.) при почечных заболеваниях, усиленном распаде тканевых белков, резком уменьшении содержания хлоридов и т. д.
азотеми́я, азотеми́и, азотеми́й, азотеми́ям, азотеми́ю, азотеми́ей, азотеми́ею, азотеми́ями, азотеми́ях
азоте́мия
(азот + гр. haima кровь) увеличенное содержание в крови азотистых продуктов белкового обмена (мочевины, мочевой кислоты и др.); признак недостаточной деятельности почек, а также нек-рых урологических заболеваний.
азотиза́ция, азотиза́ции, азотиза́ций, азотиза́циям, азотиза́цию, азотиза́цией, азотиза́циею, азотиза́циями, азотиза́циях
- Процесс поверхностной химико-термической обработки стальных изделий для повышения их твёрдости и устойчивости против коррозии.
ср.
1. процесс действия по несов. гл. азотировать
2. Результат такого действия; один из способов химико-термической обработки, заключающийся в насыщении азотом поверхностного слоя металлических изделий.
Азоти́рование - насыщение азотом поверхности металлических изделий (главным образом стальных и титановых) для повышения твёрдости, износостойкости, предела усталости, коррозионной стойкости.
* * *
АЗОТИРОВАНИЕ - АЗОТИ́РОВАНИЕ, насыщение азотом поверхности металлических изделий (главным образом стальных и титановых) для повышения твердости, износостойкости, предела усталости, коррозионной стойкости.
АЗОТИРОВАНИЕ - насыщение азотом поверхности металлических изделий (главным образом стальных и титановых) для повышения твердости, износостойкости, предела усталости, коррозионной стойкости.
азоти́рование
- тех. насыщение поверхностного слоя стальных изделий азотом (при температуре 500-600°c) с целью придания им большей твердости, износоустойчивости, повышения предела усталости и коррозионной стойкости.
АЗОТИРОВАНИЕ я, Ср. azote m. Один из способов химико-термической обработки, заключающейся в насыщении азотом поверхностного слоя металлических изделий. Азотирование. Андреев Техн. сл. // ИОТ 1898. - Лекс. САН 1933: азоти/рование.
АЗОТИ́РОВАТЬ -рую, -руешь; св. и нсв. что. Насытить - насыщать азотом, соединениями азота. А. почву, сталь.
◁ Азоти́роваться, -руется; страд. Азоти́рование, -я; ср.
-рую, -руешь; сов. и несов., перех.
Насытить (насыщать) азотом, азотными веществами.
Азотировать почву.
Азо́тистые ипри́ты - группа органических веществ общей формулы RN(CH2CH2Cl)2, где R - CH3, C2H5, CH2CH2Cl; по общеядовитому и сильному кожно-нарывному действию аналогичны иприту. Некоторые производные азотистых ипритов, подавляющие клеточное деление, применяют как противоопухолевые препараты.
* * *
АЗОТИСТЫЕ ИПРИТЫ - АЗО́ТИСТЫЕ ИПРИ́ТЫ, группа органических веществ общей формулы RN(CH2CH2Cl)2, где R - CH3, C2H5, СH2CH2Cl; по общеядовитому и сильному кожно-нарывному действию аналогичны иприту (см. ИПРИТ). Некоторые производные азотистых ипритов, подавляющие клеточное деление, применяют как противоопухолевые препараты.
АЗОТИСТЫЕ ИПРИТЫ - группа органических веществ общей формулы RN(CH2CH2Cl)2, где R - CH3, C2H5, СH2CH2Cl; по общеядовитому и сильному кожно-нарывному действию аналогичны иприту. Некоторые производные азотистых ипритов, подавляющие клеточное деление, применяют как противоопухолевые препараты.
прил.
1. соотн. с сущ. азот, связанный с ним
2. Содержащий в своём составе азот (с меньшим, чем в азотных соединениях, количеством кислорода).
АЗО́ТИСТЫЙ, АЗОТНОВАТИСТЫЙ, АЗОТНОВАТЫЙ, АЗОТНЫЙ, азотистая, азотистое (хим.). прил., употр. для обозначения химических соединений азота в разных сочетаниях с кислородом, напр.: азотная кислота, азотистая кислота, азотистый ангидрид, азотноватистая кислота.
АЗО́Т, -а, м. Химический элемент, газ без цвета и запаха, главная составная часть воздуха, входящий также в состав белков и нуклеиновых кислот.
азо́тистый, азо́тистая, азо́тистое, азо́тистые, азо́тистого, азо́тистой, азо́тистых, азо́тистому, азо́тистым, азо́тистую, азо́тистою, азо́тистыми, азо́тистом, азо́тист, азо́тиста, азо́тисто, азо́тисты, азо́тистее, поазо́тистее, азо́тистей, поазо́тистей
азотистый
- относящийся к азоту, азотная кислота - соединение азота с кислородом и водородом, обозначаемое химической формулой HNO3; химически чистая азотная кислота - бесцветная прозрачная едкая жидкость, дымящаяся на воздухе, уд. вес 1,52; обладает сильными окислительными свойствами; растворяет все обычные металлы, кроме золота и платины; имеет обширное применение при выработке взрывчатых веществ, органических красок, пластических масс, лаков и т.п.; азотные или азотистые удобрения - удобрения, содержащие азот (селитра, навоз, гуано, зелёные удобрения и др.)
АЗОТИСТЫЙ ая, ое. azoté, -e adj. 1826. Лексис. Отн. к азоту, содержащий в своем составе азот с определенным (меньшим, чем в азотных соединениях) количеством кислорода. БАС-2. - Лекс. Энц. лекс. 1835: азотистый; САН 1847: азо/тистый.
Азо́тная кислота́ - HNO3, бесцветная жидкость с резким удушливым запахом; плотность 1,513 г/см3, tпл -41,59ºC, tкип 82,6ºC. С водой смешивается во всех отношениях. В промышленности получают каталитическим окислением аммиака. Применяют для получения удобрений, нитратов целлюлозы, красителей, серной кислоты, для травления металлов и полупроводниковых материалов, как окислитель ракетного топлива, компонент «нитрирующей смеси» (с серной кислотой). Соли и эфиры азотной кислоты - нитраты.
* * *
АЗОТНАЯ КИСЛОТА - АЗО́ТНАЯ КИСЛОТА́, HNO3, бесцветная жидкость с резким удушливым запахом; плотность 1,513 г/см3, tпл - 41,59 °C, tкип 82,6 °C. С водой смешивается во всех отношениях. В промышленности получают каталитическим окислением аммиака. Применяют для получения удобрений, нитратов целлюлозы, красителей, серной кислоты, для травления металлов и полупроводниковых материалов, как окислитель ракетного топлива, компонент «нитрующей смеси» (с серной кислотой). Соли и эфиры азотной кислоты - нитраты (см. НИТРАТЫ).
АЗОТНАЯ КИСЛОТА - HNO3, бесцветная жидкость с резким удушливым запахом; плотность 1,513 г/см³, tпл -41,59 .C, tкип 82,6 .C. С водой смешивается во всех отношениях. В промышленности получают каталитическим окислением аммиака. Применяют для получения удобрений, нитратов целлюлозы, красителей, серной кислоты, для травления металлов и полупроводниковых материалов, как окислитель ракетного топлива, компонент "нитрующей смеси" (с серной кислотой). Соли и эфиры азотной кислоты - нитраты.