ТЕЛЛУ́Р [тэ], -а; м. [от лат. tellus (telluris) - земля] Химический элемент (Те), хрупкий кристаллический металл серебристо-серого цвета (применяется при изготовлении коричневых красителей, полупроводниковых материалов).
◁ Теллу́рный, -ая, -ое.
* * *
теллу́р (лат. Tellurium), химический элемент VI группы периодической системы. Назван от лат. tellus, род. п. telluris - Земля. Серебристо-серые, очень хрупкие кристаллы с металлическим блеском, плотность 6,25 г/см3, tпл 450°C; полупроводник. На воздухе устойчив, при высокой температуре горит с образованием диоксида ТеО2. В природе встречается в виде теллуридов и как самородный теллур; часто сопутствует сере и селену; добывают из отходов электролиза меди. Компонент сплавов (меди, свинца, литейного чугуна); краситель для стекла и керамики (коричневый цвет). Многие соединения теллура - полупроводниковые материалы, приёмники ИК-излучения.
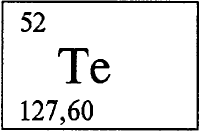
* * *
ТЕЛЛУР - ТЕЛЛУ́Р (лат. Tellurium от латинского tellus - Земля), Te (читается «теллур»), химический элемент с атомным номером 52, атомная масса 127,60. Природный теллур состоит из восьми стабильных изотопов: 120Te (содержание 0,089% по массе), 122Te (2,46%), 123Te (2,46%), 124Te (4,74%), 125Te (7,03%), 126Te (18,72%), 128Te (31,75%) и 130Te (34,27%). Радиус атома 0,17 нм. Радиусы ионов: Te2- - 0,207 нм (координационное число 6), Te4+ - 0,066 нм (3), 0,08 нм (4), 0,111 нм (6), Te6+- 0,057 (4) и 0,070 нм (6). Энергии последовательной ионизации: 9,009, 18,6, 28,0, 37,42 и 58,8 эВ. Расположен в VIA группе , в 5 периоде периодической системы элементов. Халькоген (см. ХАЛЬКОГЕНЫ), неметалл. Конфигурация внешнего электронного слоя 5s2p4. Степени окисления: -2, +2, +4, +6 (валентности II, IV и VI). Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 2,10.
Теллур - хрупкое серебристо-белое вещество с металлическим блеском.
История открытия
Впервые был обнаружен в 1782 в золотоносных рудах Трансильвании горным инспектором Ф. И. Мюллером, принявшем его за новый металл. В 1798 М. Г. Клапрот (см. КЛАПРОТ Мартин Генрих) выделил теллур и определил важнейшие его свойства.
Нахождение в природе
Содержание в земной коре 1·10-6% по массе. Известно около 100 минералов теллура. Важнейшие из них: алтаит PbTe, сильванит AgAuTe4, калаверит AuTe2, тетрадимит Bi2Te2S. Встречаются кислородные соединения теллура, например ТеО2- теллуровая охра. Встречается самородный теллур и вместе с селеном (см. СЕЛЕН) и серой (см. СЕРА) (японская теллуристая сера содержит 0,17% Те и 0,06% Se).
Вaжный источник теллура - медные и свинцовые руды.
Получение
Основной источник - шламы электролитического рафинирования меди (см. МЕДЬ) и свинца. (см. СВИНЕЦ) Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ SO2.
Для разделения селена и теллура добавляют серную кислоту. При этом выпадает диоксид теллура ТеО 2, а селенистая кислота остается в растворе.
Для выделения Te из шламов используют их спекание с содой с последующим выщелачиванием. Те переходит в щелочной раствор, из которого при нейтрализации он осаждается в виде TeO2:
Na2TeO3+2HC=TeO2Ї+2NaCl.
Из оксида ТеО2 теллур восстановливают углем.
Для очистки теллура от S и Se используют его способность под действием восстановителя (Al) в щелочной среде переходить в растворимый дителлурид динатрия Na2Te2:
6Te+2Al+8NaOH=3Na2Te2+2Na[Al(OH)4].
Для осаждения теллура через раствор пропускают воздух или кислород:
2Na2Te2+2H2O+O2=4Te+4NaOH.
Для получения теллура особой чистоты его хлорируют:
Te+2Cl2=TeCl4.
Образующийся тетрахлорид очищают дистилляцей или ректификацией. Затем тетрахлорид гидролизуют водой:
TeCl4+2H2O=TeO2Ї+4HCl,
а образовавшийся ТеО2 восстанавливают водородом:
TeO2+4H2=Te+2H2O.
Физические и химические свойства
Тaллур - хрупкое серебристо-белое вещество с металлическим блеском. Кристаллическая решетка гексагональная, a=0,44566 нм, c=0,59268 нм. Структура состоит из параллельно расположенных спиральных цепочек. Плотность 6,247 г/см3. Температура плавления 449,8°C, кипения 990°C. В тонких слоях на просвет красно-коричневый, в парах - золотисто-желтый.
Полупроводник p-типа. Ширина запрещенной зоны 0,32 эВ. Электропроводность увеличивается при освещении.
При осаждении из растворов выделяется аморфный теллур, плотность 5,9 г/см3. При 4,2 ГПа и 25°C образуется модификация со структурой типа b-Sn (Тe-II). При 6,3 ГПа получена модификация Те-III с ромбоэдрической структурой. Те-II и Te-III проявляют свойства металлов.
Устойчив на воздухе при комнатной температуре даже в мелкодисперсном состоянии. При нагревании на воздухе сгорает голубовато-зеленым пламенем с образованием диоксида TeO2. Стандартный потенциал полуреакции:
TeO32-+3H2O+4e=Te+6OH-: 0,56В.
При 100-160°C окисляется водой:
Te+2H2O= TeO2+2H2
При кипячении в щелочных растворах теллур диспропорционирует с образование теллурида и теллурита:
8Te+6KOH=2K2Te+ K2TeO3+3H2O.
С соляной и разбавленной серной кислотами Te не взаимодействует. Концентрированная H2SO4 растворяет Te, образующиеся катионы Te42+ окрашивают раствор в красный цвет. Разбавленная HNO3 окисляет Te до теллуристой кислоты H2TeO3:
3Te+4HNO3+H2O=3H2TeO3+4NO.
Сильные окислители (HClO3, KMnO4) окисляют Te до слабой теллуровой кислоты H6TeO6:
Te+HClO3+3H2O=HCl+H6TeO6.
С галогенами (см. ГАЛОГЕНЫ) (кроме фтора) образует тетрагалогениды. Фтор окисляет Te до гексафторида TeF6.
Теллуроводород H2Te - бесцветный ядовитый газ с неприятным запахом образуется при гидролизе теллуридов.
Соединения теллура (+2) неустойчивы и склонны к диспропорционированию:
2TeCl2=TeCl4+Te.
Применение
Основное применение Te и его соединений - полупроводниковая техника. Добавки Te в чугун (см. ЧУГУН) и сталь (см. СТАЛЬ), свинец (см. СВИНЕЦ) или медь повышают их механическую и химическую стойкость. Те и его соединения применяют в производстве катализаторов, специальных стекол, инсектицидов, гербицидов.
Физиологическое действие
Теллур и его летучие соединения токсичны. Попадание в организм вызывает тошноту, бронхиты, пневмонию. ПДК в воздухе 0,01 мг/м3, в воде 0,01 мг/л. При отравлениях теллур выводится из организма в виде отвратительно пахнущих теллурорганических соединений.
Микроколичества Te всегда содержатся в живых организмах, его биологическая роль не выяснена.