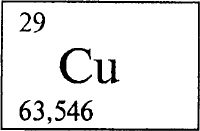Толковый словарь
I ж.
1. Химический элемент, мягкий и ковкий металл красновато-жёлтого цвета, широко применяемый в промышленности.
2. разг.
Изделия из такого металла.
3. разг.
Мелкие разменные монеты, отлитые из такого металла.
4. разг.
Красно-жёлтый цвет чего-либо.
II ж. разг.
1. Медные - обычно духовые - музыкальные инструменты.
2. перен.
Звуки, извлекаемые при игре на таких музыкальных инструментах.
МЕДЬ - сущ., ж., употр. сравн. часто
Морфология: (нет) чего? ме́ди, чему? ме́ди, (вижу) что? ме́дь, чем? ме́дью, о чём? о ме́ди
1. Медь - это металл красно-жёлтого цвета, который часто используется для изготовления монет, проводов и других изделий.
Добыча меди.
2. Медью называют изделия из этого металла.
Среди украшений, найденных на раскопках, было много меди.
3. Медью называют монеты красно-жёлтого цвета, в состав которых входит медь.
В карманах у меня одна только медь.
4. Медью чего-либо называют красно-жёлтый цвет, который похож на цвет этого металла.
Он любовался красной медью осенних деревьев. | Её волосы отливали медью.
Толковый словарь Ушакова
МЕДЬ, меди, мн. нет, жен.
1. Металл красноватого цвета, наиболее вязкий после железа, ковкий, широко употребительный. Красная медь (чистая медь). Желтая медь (сплав меди с цинком).
2. Медные деньги (разг.). Сдали сдачи серебром и медью.
Толковый словарь Ожегова
МЕДЬ, -и, жен.
1. Химический элемент, металл красновато-жёлтого цвета, вязкий и ковкий. Добыча меди. М. оркестра (о медных музыкальных инструментах). М. волос (перен.: о ярком, рыжем цвете волос).
2. Мелкие разменные монеты из этого металла или из сплава этого металла с никелем и алюминием. Получить сдачу медью.
| прил. медный, -ая, -ое. Медная руда. М. лоб (перен.: о бестолковом, тупом человеке; разг.). Учиться на медные гроши или на медные деньги (получить недостаточное образование по бедности; устар.).
Толковый словарь Даля
МЕДЬ - жен. в чистом, корольковом виде называется красною, а в сплаве с цинком - желтою или зеленою.
| Медные деньги;
| медная посуда. Медь, в продаже, вообще бывает: штыковая, дощатая, листовая (или латунь), прутковая. Медь дороже серебра: серебро чертово ребро, а медь Богу служит и царю честь воздает (колокол). Медный и медяный, в сказках медяный, в народе медяной, из меди сделанный или медь в себе содержащий, на медь похожий. Медный шандал. Медная руда. Медный цвет. * Медный лоб, бесстыжий человек, наглец. Видена девка медяна, а невидена золотая. Медной посуды - крест да пуговица; рогатой скотины - таракан да жуколица (или: петух да курица). Мы, бедные, учимся на медные, а богачи на рублевички. Он учился на медные деньги. Павлушка медный лоб. Только у молодца и серебреца, что медненький грошик. Медная зелень, водная углекислая медь, ярь. Медная лазурь, синь, углекислая же синяя медь. Медная пена, - слюдка, мышьяковокислая медь. Медная чернь, чернедь, окись меди. Медный блеск, серистая медь, стекловатая медная руда. Медный изумруд, ашерит, диоптас, кремнекислая окись. - колчедан, серистая медь с железом. Медный купорос, синий купорос, сернокислая окись меди; - блеск, сернистая. Медный рубин, вид красной медной руды. Медные цветы, волокнистая красная руда. Медистый, на медь похожий; содержащий примесь меди. Медянистый, много меди в себе содержащий. Медноватый, медистый, в меньшей степени. Медник муж. работающий медную посуду ·и·др. вещи.
| твер., архан., сиб. медный котел или горшок, в коем греют воду; он же медяник, медяник, медяк; а медник, ·в·знач. ремесленика, также медяник. Медников, ему принадлежащий. Медничиха, жена медника. Меднический, относящийся к медникам; медничество ср. ремесло их. Медница, медяница жен., церк. медная монетка;
| медный сосуд.
| Медяница, медяница, медянка, два различные вида змей: одна полуящерка, маленькая, медянистого цвета, хрупкая и неядовита (Anguis fragilis), другая же побольше, голова шире тела, ядовитая (Vipera chersea); вернее, первая медяница, вторая медянка. Слеп как медяница, ошибочно поверье.
| Медянкой зовут и насекомое Buprestis, и
| ярь, зеленую углекислую медь, также
| медную литую бабку, биток, а
| в тамб. хлебную меру, четверик. Медить, меднить? что, покрывать медью. Медиковач муж. кующий что-либо (холодной ковкой) из меди. Медиковательный завод, выделывающий листовую медь;. медиплющильный прил. то же. Медеплавильный или медноплавильный завод, добывающий медь из руды. Медеплавильщик муж. занятый медеплавленьем. Медноцветный, красный как медь.
Словарь существительных
МЕДЬ1́, -и, ж
Химический элемент, красновато-желтый вязкий и ковкий металл.
Широкое применение меди обусловлено ее высокой электропроводностью (по которой медь уступает только серебру), хорошей теплопроводностью, химической устойчивостью, а также ценными механическими свойствами - ковкостью, тягучестью и др.
МЕДЬ2́, -и, ж
Монеты, мелкие, разменные, изготовленные из меди или сплава меди с никелем и алюминием.
В кошельке была только медь.
Энциклопедический словарь
МЕДЬ -и; ж.
1. Химический элемент (Сu), ковкий металл желтого цвета с красноватым отливом (широко применяется в промышленности). Добыча меди. Надраить м. самовара. Изготовить из меди котелок.
2. собир. Изделия из этого металла. Вся м. в подвале позеленела. / О музыкальных инструментах из такого металла (преимущественно духовых). М. оркестра.
3. собир. Разг. Монеты из такого металла. Дать сдачу медью. В кошельке одна м.
4. обычно чего. Красновато-желтый, цвета такого металла. Осенняя м. листьев. Любоваться медью заката.
5. Звонкий, низкий, отчётливый (о звуках). Слушать м. колоколов. В голосе звучала м.
◁ Ме́дный (см.).
* * *
медь (лат. Cuprum), химический элемент I группы периодической системы. Металл красного (в изломе розового) цвета, ковкий и мягкий; хороший проводник тепла и электричества (уступает только серебру); плотность 8,92 г/см3, tпл 1083,4°C. Химически малоактивна; в атмосфере, содержащей CO2, пары Н2O и др., покрывается патиной - зеленоватой плёнкой основного карбоната (ядовит). Из минералов важны борнит, халькопирит, халькозин, ковеллин, малахит; встречается также самородная медь. Главное применение - производство электрических проводов. Из меди изготовляют теплообменники, трубопроводы. Более 30% меди идёт на сплавы.
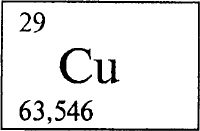
* * *
МЕДЬ - МЕДЬ (лат. Cuprum), Cu (читается «купрум»), химический элемент с атомным номером 29, атомная масса 63,546. Латинское название меди происходит от названия острова Кипра (Cuprus), где в древности добывали медную руду; однозначного объяснения происхождения этого слова в русском языке нет.
Природная медь состоит из двух стабильных нуклидов (см. НУКЛИД) 63Cu (69,09% по массе) и 65Cu (30,91%). Конфигурация двух внешних электронных слоев нейтрального атома меди 3s2p6d104s1. Образует соединения в степенях окисления +2 (валентность II) и +1 (валентность I), очень редко проявляет степени окисления +3 и +4.
В периодической системе Менделеева медь расположена в четвертом периоде и входит в группу IВ, к которой относятся такие благородные металлы, как серебро (см. СЕРЕБРО) и золото (см. ЗОЛОТО (химический элемент)).
Радиус нейтрального атома меди 0,128 нм, радиус иона Cu+ от 0,060 нм (координационное число 2) до 0,091 нм (координационное число 6), иона Cu2+ - от 0,071 нм (координационное число 2) до 0,087 нм (координационное число 6). Энергии последовательной ионизации атома меди 7,726, 20,291, 36,8, 58,9 и 82,7 эВ. Сродство к электрону 1,8 эВ. Работа выхода электрона 4,36 эВ. По шкале Полинга электроотрицательность меди 1,9; медь принадлежит к числу переходных металлов. Стандартный электродный потенциал Cu/Cu2+ 0,339 В. В ряду стандартных потенциалов медь расположена правее водорода и ни из воды, ни из кислот водорода не вытесняет.
Простое вещество медь - красивый розовато-красный пластичный металл.
Нахождение в природе
В земной коре содержание меди составляет около 5·10-3 % по массе. Очень редко медь встречается в самородном виде (см. МЕДЬ САМОРОДНАЯ) (самый крупный самородок в 420 тонн найден в Северной Америке). Из руд наиболее широко распространены сульфидные руды: халькопирит (см. ХАЛЬКОПИРИТ), или медный колчедан, CuFeS2 (30% меди), ковеллин (см. КОВЕЛЛИН) CuS (64,4% меди), халькозин (см. ХАЛЬКОЗИН), или медный блеск, Cu2S (79,8% меди), борнит (см. БОРНИТ) Cu5FeS4.(52-65% меди). Существует также много и оксидных руд меди, например: куприт (см. КУПРИТ) Cu2O, (81,8% меди), малахит (см. МАЛАХИТ) CuCO3·Cu(OH)2 (57,4% меди) и другие. Известно 170 медьсодержащих минералов, из которых 17 используются в промышленных масштабах.
Различных руд меди много, а вот богатых месторождений на земном шаре мало, к тому же медные руды добывают уже многие сотни лет, так что некоторые месторождения полностью исчерпаны. Часто источником меди служат полиметаллические руды, в которых, кроме меди, присутствуют железо, цинк, свинец, и другие металлы. Как примеси медные руды обычно содержат рассеянные элементы (см. РАССЕЯННЫЕ ЭЛЕМЕНТЫ) (кадмий, селен, теллур, галий, германий и другие), а также серебро, а иногда и золото. Для промышленных разработок используют руды, в которых содержание меди составляет немногим более 1% по массе, а то и менее.
В морской воде содержится примерно 1·10-8 % меди.
Получение
Промышленное получение меди - сложный многоступенчатый процесс. Добытую руду дробят, а для отделения пустой породы используют, как правило, флотационный метод обогащения. Полученный концентрат (содержит 18-45% меди по массе) подвергают обжигу в печи с воздушным дутьем. В результате обжига образуется огарок - твердое вещество, содержащее, кроме меди, также и примеси других металлов. Огарок плавят в отражательных печах или электропечах. После этой плавки, кроме шлака, образуется так называемый штейн (см. ШТЕЙН (в металлургии)) , в котором содержание меди составляет до 40-50%.
Далее штейн подвергают конвертированию - через расплавленный штейн продувают сжатый воздух, обогащенный кислородом. В штейн добавляют кварцевый флюс (песок SiO2). В процессе конвертирования содержащийся в штейне как нежелательная примесь сульфид железа FeS переходит в шлак и выделяется в виде сернистого газа SO2:
2FeS + 3O2 + 2SiO2 = 2FeSiO3 + 2SO2
Одновременно сульфид меди(I) Cu2S окисляется:
2Cu2S + 3О2 = 2Cu2О + 2SO2
Образовавшийся на этой стадии Cu2О далее реагирует с Cu2S:
2Cu2О + Cu2S = 6Cu + SО2
В результате возникает так называемая черновая медь, в которой содержание самой меди составляет уже 98,5-99,3% по массе. Далее черновую медь подвергают рафинированию. Рафинирование на первой стадии - огневое, оно заключается в том, что черновую медь расплавляют и через расплав пропускают кислород. Примеси более активных металлов, содержащихся в черновой меди, активно реагируют с кислородом и переходят в оксидные шлаки.
На заключительной стадии медь подвергают электрохимическому рафинированию в сернокислом растворе, при этом черновая медь служит анодом, а очищенная медь выделяется на катоде. При такой очистке примеси менее активных металлов, присутствовавшие в черновой меди, выпадают в осадок в виде шлама (см. ШЛАМ), а примеси более активных металлов остаются в электролите. Чистота рафинированной (катодной) меди достигает 99,9% и более.
Физические и химические свойства
Кристаллическая решетка металлической меди кубическая гранецентрированная, параметр решетки а = 0,36150 нм. Плотность 8,92 г/см3, температура плавления 1083,4 °C, температура кипения 2567 °C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20 °C удельное сопротивление 1,68·10-3 Ом·м).
В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина предохраняет металл от дальнейшего разрушения. Для создания на художественных предметах «налета старины» на них наносят слой меди, который затем специально патинируется.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем - оксид CuO.
Красновато-коричневый оксид меди(I) Cu2O при растворении в бромо- и иодоводородной кислотах образует, соответственно, бромид меди(I) CuBr и иодид меди(I) CuI. При взаимодействии Cu2O с разбавленной серной кислотой возникают медь и сульфат меди:
Cu2O + H2SO4 = Cu + CuSO4 + H2O.
При нагревании на воздухе или в кислороде Cu2O окисляется до CuO, при нагревании в токе водорода - восстанавливается до свободного металла.
Черный оксид меди (II) CuO, как и Cu2O, c водой не реагирует. При взаимодействии CuO с кислотами образуются соли меди (II):
CuO + H2SO4 = CuSO4 + H2O
При сплавлении со щелочами CuO образуются купраты, например:
CuO + 2NaOH = Na2CuO2 + H2O
Нагревание Cu2O в инертной атмосфере приводит к реакции диспропорционирования:
Cu2O = CuO + Cu.
Такие восстановители, как водород, метан, аммиак, оксид углерода (II) и другие восстанавливают CuO до свободной меди, например:
CuO +СО = Cu + СО2.
Кроме оксидов меди Cu2O и CuO, получен также темно-красный оксид меди (III) Cu2O3, обладающий сильными окислительными свойствами.
Медь реагирует с галогенами (см. ГАЛОГЕНЫ), например, при нагревании хлор реагирует с медью с образованием темно-коричневого дихлорида CuCl2. Существуют также дифторид меди CuF2 и дибромид меди CuBr2, но дииодида меди нет. И CuCl2, и CuBr2 хорошо растворимы в воде, при этом ионы меди гидратируются и образуют голубые растворы.
При реакции CuCl2 с порошком металлической меди образуется бесцветный нерастворимый в воде хлорид меди (I) CuCl. Эта соль легко растворяется в концентрированной соляной кислоте, причем образуются комплексные анионы [CuCl2]-, [CuCl3]2- и [СuCl4]3-, например за счет процесса:
CuCl + НCl = H[CuCl2]
При сплавлении меди с серой образуетcя нерастворимый в воде сульфид Cu2S. Сульфид меди (II) CuS выпадает в осадок, например, при пропускании сероводорода через раствор соли меди (II):
H2S + CuSO4 = CuS + H2SO4
C водородом, азотом, графитом, кремнием медь не реагирует. При контакте с водородом медь становится хрупкой (так называемая «водородная болезнь» меди) из-за растворения водорода в этом металле.
В присутствии окислителей, прежде всего кислорода, медь может реагировать с соляной кислотой и разбавленной серной кислотой, но водород при этом не выделяется:
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O.
С азотной кислотой различных концентраций медь реагирует довольно активно, при этом образуется нитрат меди (II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой реакция меди протекает так:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
С концентрированной серной кислотой медь реагирует при сильном нагревании:
Cu + 2H2SO4 = CuSO4 + SO2+ 2H2O.
Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
2FeCl3 + Cu = CuCl2 + 2FeCl2
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu2+ легко образуют комплексы с аммиаком, например, состава [Cu(NH3)]2+ . При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
Гидроксид меди Cu(OH)2 характеризуется преобладанием основных свойств. Он реагирует с кислотами с образованием соли и воды, например:
Сu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O.
Но Сu(OH)2 реагирует и с концентрированными растворами щелочей, при этом образуются соответствующие купраты, например:
Сu(OH)2 + 2NaOH = Na2[Cu(OH)4]
Если в медноаммиачный раствор, полученный растворением Сu(OH)2 или основного сульфата меди в аммиаке, поместить целлюлозу, то наблюдается растворение целлюлозы и образуется раствор медноаммиачного комплекса целлюлозы. Из этого раствора можно изготовить медноаммиачные волокна, которые находят применение при производстве бельевого трикотажа и различных тканей.
Применение
Медь, как полагают, - первый металл, который человек научился обрабатывать и использовать для своих нужд. Найденные в верховьях реки Тигр изделия из меди датируются десятым тысячелетием до нашей эры. Позднее широкое применение сплавов меди определило материальную культуру бронзового века (см. БРОНЗОВЫЙ ВЕК) (конец 4 - начало 1 тысячелетия до нашей эры) и в дальнейшем сопровождало развитие цивилизации на всех этапах. Медь и ее использовались для изготовления посуды, утвари, украшений, различных художественных изделий. Особенно велика была роль бронзы (см. БРОНЗА) .
С 20 века главное применение меди обусловлено ее высокой электропроводимостью. Более половины добываемой меди используется в электротехнике для изготовления различных проводов, кабелей, токопроводящих частей электротехнической аппаратуры. Из-за высокой теплопроводности медь - незаменимый материал различных теплообменников и холодильной аппаратуры. Широко применяется медь в гальванотехнике - для нанесения медных покрытий, для получения тонкостенных изделий сложной формы, для изготовления клише в полиграфии и др.
Большое значение имеют медные сплавы - латуни (см. ЛАТУНЬ) (основная добавка цинк, Zn), бронзы (сплавы с разными элементами, главным образом металлами - оловом, алюминием, берилием, свинцом, кадмием и другими, кроме цинка и никеля) и медно-никелевые сплавы, в том числе мельхиор (см. МЕЛЬХИОР) и нейзильбер (см. НЕЙЗИЛЬБЕР) . В зависимости от марки (состава) сплавы используются в самых различных областях техники как конструкционные, антидикционные, стойкие к коррозии материалы, а также как материалы с заданной электро- и теплопроводностью Так называемые монетные сплавы (медь с алюминием и медь с никелем) применяют для чеканки монет - «меди» и «серебра»; но медь входит в состав и настоящих монетного серебра и монетного золота.
Биологическая роль
Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития (см. Биогенные элементы (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ) ). В растениях и животных содержание меди варьируется от 10-15 до 10-3 %. Мышечная ткань человека содержит 1·10-3 % меди, костная ткань - (1-26) ·10-4%, в крови присутствует 1,01 мг/л меди. Всего в организме среднего человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных - участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов, прежде всего оксидаз (см. ОКСИДАЗЫ), катализирующих реакции биологического окисления. Медьсодержащий белок пластоцианин участвует в процессе фотосинтеза (см. ФОТОСИНТЕЗ). Другой медьсодержащий белок, гемоцианин (см. ГЕМОЦИАНИН), выполняет роль гемоглобина (см. ГЕМОГЛОБИН) у некоторых беспозвоночных. Так как медь токсична, в животном организме она находится в связанном состоянии. Значительная ее часть входит в состав образующегося в печени белка церулоплазмина, циркулирующего с током крови и деставляющего медь к местам синтеза других медьсодержащих белков. Церулоплазмин обладает также каталитической активностью и участвует в реакциях окисления. Медь необходима для осуществления различных функций организма - дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.
Сульфат меди и другие соединения меди используют в сельском хозяйстве в качестве микроудобрений и для борьбы с различными вредителями растений. Однако при использовании соединений меди, при работах с ними нужно учитывать, что они ядовиты. Попадание солей меди в организм приводит к различным заболеваниям человека. ПДК для аэрозолей меди составляет 1 мг/м3, для питьевой воды содержание меди должно быть не выше 1,0 мг/л.
Большой энциклопедический словарь
МЕДЬ (лат. Cuprum) - Cu, химический элемент I группы периодической системы Менделеева, атомный номер 29, атомная масса 63,546. Металл красного (в изломе розового) цвета, ковкий и мягкий; хороший проводник тепла и электричества (уступает только серебру); плотность 8,92 г/см³, tпл 1083,4 .С. Химически малоактивен; в атмосфере, содержащей СО2, пары Н2О и др., покрывается патиной - зеленоватой пленкой основного карбоната (ядовит). Из минералов важны борнит, халькопирит, халькозин, ковеллин, малахит; встречается также самородная медь. Главное применение - производство электрических проводов. Из меди изготовляют теплообменники, трубопроводы. Более 30% меди идет на сплавы.
Академический словарь
-и, ж.
1. Металл красноватого цвета, вязкий и ковкий.
2. собир.
Изделия из этого металла.
Тройка, рванувшись и стуча по доскам, вылетела из каретника, сверкая лаком и медью коляски. А. Н. Толстой, Детство Никиты.
[На пароходе] было много красной меди. Поручни, компасы, бинокли, всякие приборы и даже высокие пороги кают - все это было медное. Паустовский, Золотая роза.
3. собир.
Медные (преимущ. духовые) музыкальные инструменты.
Гремели марши. Сверкала медь оркестра. Б. Полевой, Саянские записи.
Слышишь - звонко поет оркестровая медь. Сурков, Дорогая моя.
Взмыл на воздух жезл капельмейстера, грохнула медь оркестра, тяжко вздохнули трубы. Нагибин, Полет с президентом.
4. собир. разг. Медные деньги.
За одни грибы бабы получили сорок две копейки медью. Тургенев, Отцы и дети.
У него в кармане осталось два двугривенных и немного меди - на сигареты и на метро. Березко, Необыкновенные москвичи.
5. перен.; обычно чего. Красновато-желтый цвет чего-л.
Густые зеленя сменялись медью жнива. Федин, Трансвааль.
Одетый медью заката, Конвой подровнял штыки. Сурков, Шестой.
Энциклопедия Кольера
Cu (cuprum),
химический элемент IB подгруппы (семейства монетных металлов - Cu, Ag, Au) периодической системы элементов. Известна и широко используется с древних времен (медный век, бронзовый век). Медь наряду с серебром и золотом используется для чеканки монет, применяется в произведениях искусства и в электротехнике. Медь получают из ее руд: куприта, содержащего оксид меди, малахита, содержащей основной карбонат меди, халькозина (медный блеск) и халькопирита (медный колчедан), содержащих сульфид меди. Мировым лидером по производству меди считается Чили, затем идут США, Россия, Казахстан, Канада, Замбия, Заир, Польша и Перу.
Свойства. Медь - мягкий, тяжелый, ковкий, тягучий, вязкий и достаточно прочный металл красновато-желтого цвета в отраженном свете и зеленый в проходящем (в очень тонком слое). Чистая медь очень хорошо проводит тепло и электрический ток, уступая в этом только серебру, но ее электрическая проводимость резко падает в присутствии примесей мышьяка, сурьмы, кремния и др. Расплавленная медь поглощает воздух и после затвердевания в отливке остаются пузырьки воздуха, затрудняющие обработку. В ряду напряжений медь стоит после водорода и при реакции с кислотами не вытесняет из них водород, поэтому медь широко используется в гальванических элементах. Медь устойчива к коррозии при обычной температуре в сухом воздухе, но при нагревании окисляется, образуя оксиды меди(I) и меди(II): Cu2O и CuO. При долговременной атмосферной коррозии постепенно образует основной карбонат, по составу аналогичный малахиту: 2Cu + O2 + CO2 + H2O = Cu2(OH)2CO3. С галогенами медь соединяется уже при комнатной температуре, легко взаимодействует с серой и селеном; с водородом, азотом и углеродом не реагирует даже при высокой температуре. В отсутствие кислорода медь не реагирует ни с хлороводородной (соляной) кислотой, ни с разбавленной серной, но растворяется в горячей концентрированной серной кислоте (Cu + 2H2SO4 (r) CuSO4 + SO2 + 2H2O) и хорошо в азотной, образуя нитрат меди и оксиды азота. СВОЙСТВА МЕДИ
Атомный номер 29 Атомная масса 63,54 Изотопы
стабильные 63, 65
нестабильные 58-62, 64, 66-68
Температура плавления, ° С 1083 Температура кипения, ° С 2567 Плотность, г/см3 8,92 Твердость (по Моосу) 2,5 Содержание в земной коре, % (масс.) 0,007 Степени окисления +1, +2
Применение. Большая часть мирового производства меди используется в электротехнической промышленности для изготовления проводов. Листовая медь широко применяется для изготовления кровли, желобов, водостоков. Из-за коррозионной стойкости в морской воде, и в частности к действию морских организмов и растений, она является прекрасным материалом для кораблей. Медь часто используют в химической, пищевой промышленности и промышленности ферментов, для изготовления чайников, перегонных аппаратов, емкостей, теплообменников и другой утвари. Благодаря своему блеску и красивому цвету медь широко используется в декоративных изделиях и произведениях искусства, а также в гальванопластике и гравировании. Медь входит в состав многочисленных сплавов, которых известно более 1000. Самые распространенные из них - латуни (сплавы с цинком), бронзы (сплавы с оловом), медно-никелевые сплавы (мельхиор, нейзильбер, манганин, копель и т.д.); одним из наиболее распространенных применений меди является ее использование в сплавах для чеканки монет. Медь принадлежит к числу микроэлементов, необходимых для нормальной жизнедеятельности растений. Ее вносят в почву с микроудобрениями. Она способствует росту растений, повышению устойчивости против засухи, холода и некоторых заболеваний.
Соединения. Электронное строение атома меди 1s22s22p63s23p63d104s1. Атом меди легко отдает внешний электрон, образуя соединения Cu(I). Не все электроны на 3d-оболочке прочно удерживаются ядром, поэтому многие элементы способны оттягивать два электрона от атома меди, образуя устойчивый ион Cu2+. Соединения Cu(II) наиболее распространены и более стабильны, а относительно малый радиус иона и высокий заряд ядра позволяют меди проявлять акцепторные свойства с образованием комплексных ионов, например [[CuCl4]]2-, имеющего координационную связь. Ионы меди координируют молекулы воды в растворе, образуя стабильный комплексный ион [[Cu(H2O)4]]2+, который и вызывает голубую окраску разбавленных водных растворов соединений меди. Медь образует много соединений в степени окисления +1 и +2, но известны и некоторые нестабильные соединения меди в степени окисления +3. Соединения в степени окисления +1 обычно плохо растворяются в воде, являются восстановителями, легко окисляются на воздухе и, как правило, менее практически ценны и реже используются по сравнению с соединениями, в которых медь находится в степени окисления +2.
Соединения меди(I). Cu2O - темнокрасный кристаллический порошок, применяемый для изготовления рубинового стекла, окрашивания фарфора, гальванопластики металлических поверхностей. Хлорид меди(I) CuCl - серовато-белый кристаллический порошок, используемый как инсектицид, для очистки ацетилена и денитрации искусственного шелка. Кислота HCuCl2 (с комплексным анионом) используется в газовом анализе для поглощения CO.
Соединения меди(II). Оксид CuO - черный порошок, активный окислитель, используемый при сжигании органических соединений в элементном анализе. CuO используется также для производства солей, окраски в зеленый или голубой цвет стекла, фарфора, глиняных изделий, для очистки нефти от серы и в медицине. Гидроксид Cu(OH)2 - голубовато-зеленый порошок - в горячих растворах превращается в черный оксид меди(II). Гидроксид меди(II) растворяется в растворе тартрата щелочного металла с образованием тартрата меди CuC4H4O6 (реактив Фелинга), применяемого для обнаружения и определения восстанавливающих сахаров. Гидроксид меди(II) используется также как фунгицид в составе бордоской жидкости для уничтожения или предотвращения развития патогенных грибов и бактерий на семенах и сельскохозяйственных растениях на полях и на фабриках производства кормов. Гидроксид тетрамминмеди(II) (комплексное соединение) темноголубого цвета используется в качественном анализе на медь, как растворитель для хлопка, шелка, полотна и в производстве искусственного шелка. Хлорид меди CuCl2.2H2O в виде голубовато-зеленых кристаллов поглощает влагу из влажного воздуха, может увлажнять сухой воздух и используется в производстве краски, стойких чернил и в текстильной промышленности. Сульфат меди CuSO4 - наиболее распространенное соединение меди - получают растворением оксида (гидроксида или карбоната) меди в серной кислоте или металла в конц. серной кислоте. В промышленности его получают обжигом сульфида с дальнейшим растворением оксида в серной кислоте. Безводный сульфат бесцветен, но, хорошо поглощая воду, образует голубой пентагидрат CuSO4.5H2O (медный купорос). Сульфат меди(II) используется в изготовлении электролитических покрытий, гальванопластике, для изготовления пигментов, инсектицидов, для консервирования и дубления кожи, пропитки шпал, в крашении хлопка и шелка и как вяжущее средство. Он ядовит для низших организмов, особенно для морских водорослей, и поэтому используется на станциях водоподготовки. Ацетат меди(II) Cu(CH3COO)3*H2O (ярь-медянка) применяется для приготовления зеленой масляной краски. Смешанный ацетат-арсенит меди(II) Cu(CH3COO)2*Cu3(AsO3)2 (парижская зелень) применяется для уничтожения вредителей растений. Все соли меди ядовиты, поэтому медную посуду лудят, т.е. покрывают внутри слоем олова, чтобы предотвратить возможность образования солей.
См. также
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ;
МЕДНАЯ ПРОМЫШЛЕННОСТЬ.
ЛИТЕРАТУРА
Смирнягин А.П. и др. Промышленные цветные металлы и сплавы. М., 1974 Подчайнова В.Н., Симонова Л.Н. Медь. М., 1990
Иллюстрированный энциклопедический словарь
МЕДЬ (Cuprum), Cu, химический элемент I группы периодической системы, атомный номер 29, атомная масса 63,546; розовато-красный металл, tпл 1083,4°C. Содержание в земной коре (4,7-5,5)´10-3% по массе. Медь - главный металл электротехники, ее используют также для изготовления теплообменной аппаратуры, художественных изделий и др. Важнейшие сплавы меди - бронза, латунь, мельхиор. Медь известна с древнейших времен (смотри Медный век).
Практический толковый словарь
мед. медь (copper, cuprum)
Компонент (наряду с цинком и марганцем) антиоксидантной энзимной системы.
- Необходима для образования меланина и метаболизма железа.
см. тж микроэлементы
Поговорки
Белая медь. Арх. Никелированный металл. АОС 1, 159.
Медь звенящая. Книжн. 1. Нечто большое и громкое, но по существу пустое и бесплодное. 2. О пышных, но малосодержательных словах. Выражение из Первого послания апостола Павла к Коринфянам. БМС 1998, 371.
Орфографический словарь
Формы слов для слова медь
ме́дь, ме́ди, ме́дей, ме́дям, ме́дью, ме́дями, ме́дях
Синонимы к слову медь
сущ., кол-во синонимов: 6
Морфемно-орфографический словарь
Грамматический словарь
Этимологический словарь русского языка
Общесл. Точных соответствий в других индоевр. яз. не имеет.
Этимологический словарь
Общеслав. Общепринятой этимологии не имеет. Заслуживает внимания объяснение слова из собств. имени Мидия.
ж., род. п. -и, укр. мiдь, др.-русск., ст.-слав. мѣдь χαλκός (Супр.), болг. мед, сербохорв. мjе̏д. словен. mẹ̑d, чеш. měd᾽, слвц. mеd᾽, польск. miedź, в.-луж. mjedź, н.-луж. měź "латунь".
Существующие этимологии гадательны. Предполагают родство с др.-исл. smiðr "ремесленник, кузнец", гот. aiza-smiÞa χαλκεύς, д.-в.-н. smid "кузнец", smîdа "металл", греч. σμίλη "нож для вырезания", ирл. mēin(n) ж. "руда, металл"; см. Буазак 885 и сл.; Мi. ЕW 194; Бецценбергер у Стокса 205; Торп 529; оговорки по этому поводу см. у Бернекера (2, 46), который осторожно привлекает цслав. смѣдъ "fuscus, темный", против чего см. Коржинек (LF 61, 44). [Оригинальна этимология Абаева (Езиков. изследв. Младенов, стр. 321 и сл.) - от названия страны Мидии: *Мѣдь из ир. Мādа- через греч. Μηδία; ср. еще Згуста, "Sрrасhе", 4, 1958, стр. 98 и сл.; Чоп ("Slavistična Revija", 9, 1958, стр. 27 и сл.) сравнивает слав. слово с хетт. miti-, mita- "красный". - Т.]
Сканворды для слова медь
- Грошовый металл.
- Что выдувает трубач, когда оркестр гремит басами?
- Химический элемент, металл.
- Алхимический знак этого металла совпадал с символом богини любви и красоты Венеры.
- Антимикробный металл.
- Самоварное золото.
- Материал, из которого должен быть сделан подарок, преподнесённый к седьмой годовщине свадьбы.
- Переведите с латинского слово «купрум».
- Компонент бронзы.
- Компонент латуни.
- Металл, из которого сделан пушкинский всадник.
- Химический элемент, Cu.
- Атом какого химического элемента является «главным» в соединении, окрашивающем кровь кальмаров и осьминогов в голубой цвет?
- Сернистые соединения этого металла позволили создать колонны внутри Исаакиевского собора и красивейший зал Эрмитажа.
- Препараты на основе солей этого металла применяются для опрыскивания винограда, например в составе бордосской жидкости.
- Из этого металла были сделаны доспехи великана Голиафа, весившие «пять тысяч сиклей».
Полезные сервисы