- Французский физик, открывший уравнение состояния идеального газа.
клапейрон (clapeyron) бенуа поль эмиль
Большой энциклопедический словарь
КЛАПЕЙРОН (Clapeyron) Бенуа Поль Эмиль (1799-1864) - французский физик и инженер. В 1820-30 работал в России, член-корреспондент Петербургской АН (1830). Ввел в термодинамику индикаторные диаграммы, вывел т. н. уравнения Клапейрона и Клапейрона - Клаузиуса.
Полезные сервисы
клапейрон бенуа поль эмиль
Энциклопедический словарь
Клапейро́н Бенуа Поль Эмиль (Clapeyron) (1799-1864), французский физик и инженер. В 1820-1830 работал в России, член-корреспондент Петербургской АН (1830). Ввёл в термодинамику индикаторные диаграммы, вывел так называемые уравнения Клапейрона и Клапейрона-Клаузиуса.
Энциклопедия Кольера
КЛАПЕЙРОН Бенуа Поль Эмиль (Clapeyron, Benois Paul Emile) (1799-1864), французский физик и инженер. Родился 26 января 1799 в Париже. Окончил Политехническую школу (1818). Работал в Институте инженеров путей сообщения в Петербурге (1820-1830). По возвращении во Францию стал профессором Школы мостов и дорог в Париже. Физические исследования Клапейрона посвящены тепловым процессам. В 1834 он ввел в термодинамику графический метод, представив в геометрической форме рассуждения Карно. Анализируя цикл Карно, вывел уравнение состояния идеального газа (уравнение Клапейрона), объединяющее закон Бойля - Мариотта, закон Гей-Люссака и закон Авогадро. Это было наиболее простое уравнение, применимое с определенной степенью точности к реальным газам при низких давлениях и высоких температурах. Получил уравнение, связывающее между собой температуры кипения и плавления веществ и давление (уравнение Клапейрона - Клаузиуса; последний обосновал это уравнение в 1851). Умер Клапейрон в Париже 28 января 1864. ЛИТЕРАТУРА Искольдский И.И. Бенуа Клапейрон. Успехи химии, т. 14, 1945 Гельфер Я.И. История и методология термодинамики и статистической физики. М., 1981
Полезные сервисы
клапейрон эмиль
Энциклопедический словарь
КЛАПЕЙРОН Эмиль - КЛАПЕЙРО́Н (Clapeyron) Бенуа Поль Эмиль (1799-1864), французский физик и инженер. В 1820-1830 гг. работал в России, член-корреспондент Петербургской АН (1830). Ввел в термодинамику индикаторные диаграммы, вывел т. н. уравнения Клапейрона и Клапейрона-Клаузиуса.
* * *
КЛАПЕЙРО́Н (Clapeyron) Эмиль (полное имя Бенуа Поль Эмиль) (26 февраля 1799, Париж, Франция - 28 января 1864, там же), французский физик и инженер, член Парижской АН (1848).
Образование. Первые публикации
О семье известно мало. Можно предположить, что его родители не были состоятельными людьми (в архиве сохранилась запись об отсутствии у них недвижимого имущества).
Окончив в 1816 лицей, Клапейрон поступил в Политехническую школу, в 1818 закончил ее, получил диплом военного инженера и поступил на должность инженера-ученика во Французский Горный корпус. Одновременно он начал посещать занятия в Минной школе.
Не ограничиваясь исполнением своих служебных обязанностей, Клапейрон отправился вместе со своим другом Габриэлем Ламе в поездку по Гарцу, где в то время проводилась добыча ряда полезных ископаемых и широко использовалась новейшая техника, в частности, горнорудная. Итогом этой поездки явились первые печатные труды Клапейрона, один из которых был посвящен зубчатым колесам, а другой - описанию парохода. Уже в этих первых публикациях проявился присущий и всем последующим работам Клапейрона интерес как к науке, так и к технике.
Работа в России
После возвращения друзей в Париж произошло знаменательное событие: они познакомились с русским генералом и дипломатом П. П. Базеном, благодаря которому они вскоре получили приглашение на работу в Россию, в Петербургский институт инженеров путей сообщения. В 1821 они, приняв приглашение, прибывают в Петербург.
Клапейрону поручили заведование кафедрами механики и химии. Он сразу же приступил к модернизации читавшихся курсов: добавил новые разделы (паровые машины, ветряные мельницы и др.). Уже на этом, первом, этапе педагогической деятельности Клапейрона проявилось его исключительно полезное стремление уделять большое внимание как инженерно-прикладным, так и теоретическим вопросам. Этому правилу он неукоснительно следовал в тех лекциях по механике и астрономии, а также по химии, которые он читал в 1827-1828 гг. Годом позже он вместе с Ламе добавил к прежним курсы: «Новые открытия и усовершенствования в художествах, относящиеся до предметов, преподаваемых в институте» и курс инженерной графики.
Энергичные и инициативные французы начали добиваться организации публичных лекций, но это удалось только через два года и потребовало значительных усилий.
Работа Клапейрона не ограничивалась преподаванием. Он продолжал как научные исследования, так и инженерную деятельность по строительству мостов, устройству каналов и шлюзов, углублению русла рек. Важной была и работа Клапейрона в качестве эксперта: его первые в России испытания бетона и исследования известей привели его к заключению об их высоком качестве, а изучение железных руд - в их безусловной многоцелевой пригодности, в частности, для изготовления мостовых цепей.
Петербургский период работы Клапейрона был ознаменован и появлением более десяти его печатных работ, из которых наиболее значительные - «Об устройстве сводов», «О построении веревочных многогранников» и «О приложении статики к решению задач, входящих в теорию наименьших расстояний».
Многогранная полезная деятельность Клапейрона была отмечена его избранием членом-корреспондентом Петербургской академии наук (1830).
Но в 1831 и Клапейрон, и Ламе после срочной и непривычно длительной для профессоров командировки в Вытегру, скорее напоминавшей ссылку, по не вполне понятной (вероятнее всего, политической) причине поспешно и неожиданно, сославшись на состояние здоровья, подали заявление об отставке и покинули Россию.
Школа мостов и дорог
По возвращении во Францию Клапейрон продолжил свою инженерную деятельность, в основном, по строительству мостов (через Сену, Гарону и др.) и железных дорог. Так, он руководил постройкой дороги Париж-Сен-Жермен, Бордо-Байонна.
Накопленный за годы пребывания в России богатый опыт Клапейрон использовал и в преподавании. Можно особо отметить подготовленный им оригинальный курс «Паровые машины». Эта его деятельность не осталась незамеченной. В 1844 он был назначен профессором Школы мостов и дорог, а 1848 был избран членом Парижской академии наук. В Академии он принимал участие в работе многих комитетов, в том числе комитета, разрабатывавшего основы проекта строительства Суэцкого канала.
Два великих уравнения
Довольно долгое время научные заслуги Клапейрона недооценивались: его труды в лучшем случае рассматривались как популяризация или даже перефразировка - на новом, графическом языке - работы Сади Карно (см. КАРНО Сади). Клапейрон действительно развивал идеи Карно, изложенные в его знаменитом (но почти не оцененном современниками) «Размышлении о движущей силе огня и о машинах, способных развивать эту силу» и облекал их в более совершенную математическую и графическую форму (даже входящий во все учебники вариант рассмотрения цикла Карно - две изотермы и две адиабаты - был предложен Клапейроном). Исследуя цикл Карно, Клайпейрон вывел уравнение состояния идеального газа (см. КЛАПЕЙРОНА УРАВНЕНИЕ). Мнение о «вторичности» работ Клапейрона отчасти связано и с тем, что он в своих трудах не выделял, в чем состоит его оригинальный вклад, и даже название его труда было почти дословно таким же, что и у Карно.
Именно благодаря работам Клапейрона эти идеи Карно и получили признание и должную оценку, но он и сам внес в науку большой вклад. Помимо упомянутого уравнения Клапейрона-Менделеева он разработал уравнение Клапейрона-Клаузиуса (см. КЛАПЕЙРОНА-КЛАУЗИУСА УРАВНЕНИЕ), связывающее температуру плавления вещества с давлением.
После кончины Клапейрона в память об этом выдающемся ученом и инженере его именем была названа одна из улиц Парижа.
Полезные сервисы
клапейрона
Большой энциклопедический словарь
КЛАПЕЙРОНА - КЛАУЗИУСА уравнение - зависимость между давлением p и температурой T однокомпонентной системы, состоящей из двух равновесно сосуществующих фаз (напр., жидкости и пара); определяет кривую фазового перехода первого рода (парообразования, плавления и др.). Клапейрона - Клаузиуса уравнение предложено Б. П. Э. Клапейроном (1834) и усовершенствовано Р. Ю. Э. Клаузиусом (1850).
Полезные сервисы
клапейрона уравнение
Энциклопедический словарь
Клапейро́на уравне́ние (Клапейрона-Менделеева уравнение), найденная Б. П. Э. Клапейроном (1834) зависимость между физическими величинами, определяющими состояние идеального газа (давлением р, его объёмом V и абсолютной температурой Т): pV = ВТ, где коэффициент B зависит от массы газа M и его молекулярной массы. Для 1 моля идеального газа (Д. И. Менделеев, 1874) pV = RT, где R - 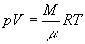 .
.
* * *
КЛАПЕЙРОНА УРАВНЕНИЕ - КЛАПЕЙРО́НА УРАВНЕ́НИЕ, уравнение состояния идеального газа (см. ИДЕАЛЬНЫЙ ГАЗ), выведенное П. Э Клапейроном (см. КЛАПЕЙРОН Эмиль) в 1834, объединившим закон Бойля-Мариотта (см. БОЙЛЯ-МАРИОТТА ЗАКОН) и закон Гей-Люссака (см. ГЕЙ-ЛЮССАКА ЗАКОНЫ).
Представляет собой зависимость между параметрами идеального газа (см. ИДЕАЛЬНЫЙ ГАЗ) (давлением p, объемом V и абсолютной температурой T) определяющими его состояние:
pV=BT.
Коэффициент пропорциональности В зависит от массы газа М и его молярной массы, то есть различается для разных газов.
В 1874 Д. И. Менделеев (см. МЕНДЕЛЕЕВ Дмитрий Иванович) на основе уравнения Клайперона вывел уравнение для 1 моля идеального газа, получившее название уравнения Клапейрона - Менделеева (см. КЛАПЕЙРОНА-МЕНДЕЛЕЕВА УРАВНЕНИЕ).
Большой энциклопедический словарь
КЛАПЕЙРОНА уравнение (Клапейрона - Менделеева уравнение) - найденная Б. П. Э. Клапейроном (1834) зависимость между физическими величинами, определяющими состояние идеального газа (давлением p, его объемом V и абсолютной температурой T): pV=BT, где B=M/? (М - масса газа, ? - его молекулярная масса, R - газовая постоянная). Для 1 моля идеального газа (Д. И. Менделеев, 1874) pV = RT.
Иллюстрированный энциклопедический словарь
КЛАПЕЙРОНА УРАВНЕНИЕ (Клапейрона-Менделеева уравнение), зависимость между давлением p, абсолютной температурой T и объемом V идеального газа массы M: pV=BT, где B=M/m (m - масса молекулы газа в атомных единицах массы). Установлена французским ученым Б.П.Э. Клапейроном в 1834. Для 1 моля газа получена Д.И. Менделеевым: pV=RT, где R - универсальная газовая постоянная. Клапейрона уравнение применимо к реальным газам при низких давлениях и высоких температурах (например, к атмосферному воздуху).
Полезные сервисы
клапейрона-клаузиуса уравнение
Энциклопедический словарь
Клапейро́на-Кла́узиуса уравне́ние - Клапейро́на-Кла́узиуса уравне́ние, зависимость между давлением р и температурой Т однокомпонентной системы, состоящей из двух равновесно сосуществующих фаз (например, жидкости и пара); определяет кривую фазового перехода первого рода (парообразования, плавления и др.). Клапейрона-Клаузиуса уравнение предложено Б. П. Э. Клапейроном (1834) и усовершенствовано Р. Ю. Э. Клаузиусом (1850).
* * *
КЛАПЕЙРОНА-КЛАУЗИУСА УРАВНЕНИЕ - КЛАПЕЙРО́НА-КЛА́УЗИУСА УРАВНЕ́НИЕ, зависимость между давлением p и температурой T однокомпонентной системы, состоящей из двух равновесно сосуществующих фаз (напр., жидкости и пара); определяет кривую фазового перехода первого рода (см. ФАЗОВЫЕ ПЕРЕХОДЫ ПЕРВОГО РОДА) (парообразования, плавления и др.). Клапейрона - Клаузиуса уравнение предложено Б. П. Э. Клапейроном (см. КЛАПЕЙРОН Эмиль) (1834) и усовершенствовано Р. Ю. Э. Клаузиусом (см. КЛАУЗИУС Рудольф Юлиус Эмануэль) (1850).
Полезные сервисы
клапейрона-менделеева уравнение
Энциклопедический словарь
КЛАПЕЙРОНА-МЕНДЕЛЕЕВА УРАВНЕНИЕ - КЛАПЕЙРО́НА-МЕНДЕЛЕЕ́ВА УРАВНЕ́НИЕ, уравнение состояния (см. УРАВНЕНИЕ СОСТОЯНИЯ) для идеального газа (см. ИДЕАЛЬНЫЙ ГАЗ), отнесенное к 1 молю (см. МОЛЬ) газа.
В 1874 Д. И. Менделеев (см. МЕНДЕЛЕЕВ Дмитрий Иванович) на основе уравнения Клапейрона (см. КЛАПЕЙРОНА УРАВНЕНИЕ), объединив его с законом Авогадро (см. АВОГАДРО ЗАКОН), используя молярный объем Vm и отнеся его к 1 молю, вывел уравнение состояния для 1 моля идеального газа:
pV = RT, где R - универсальная газовая постоянная (см. ГАЗОВАЯ ПОСТОЯННАЯ), R = 8,31 Дж/(моль.К)
Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа.
Для произвольной массы газа М, молярная масса которого m:
pV = (М/m).RT.
или pV = NАkT, где
NА - число Авогадро (см. АВОГАДРО ПОСТОЯННАЯ), k - постоянная Больцмана (см. БОЛЬЦМАНА ПОСТОЯННАЯ).
Уравнение Клапейрона-Менделеева представляет собой уравнение состояния идеального газа, которое объединяет закон Бойля - Мариотта (см. БОЙЛЯ-МАРИОТТА ЗАКОН), закон Гей-Люссака (см. ГЕЙ-ЛЮССАКА ЗАКОНЫ) и закон Авогадро.
Уравнение Клапейрона-Менделеева - наиболее простое уравнение состояния, применяемое с определенной степенью точности к реальным газам при низких давлениях и высоких температурах, например, к атмосферному воздуху, когда свойства газов близки к идеальному газу.