ж.
1. Разрушение твёрдых тел под воздействием различных физико-химических процессов.
2. перен.
Негативные изменения в политической, экономической, нравственной жизни общества и человека.
ж.
1. Разрушение твёрдых тел под воздействием различных физико-химических процессов.
2. перен.
Негативные изменения в политической, экономической, нравственной жизни общества и человека.
КОРРО́ЗИЯ, коррозии, мн. нет, жен. (лат. corrosio).
1. Разрушение горных пород под влиянием воды (геол.).
2. Разъедание металлов кислотами (хим.). Ржавчина есть простейший вид коррозии.
КОРРО́ЗИЯ, -и, жен. (спец.). Разрушение, разъедание твёрдых тел, вызванное химическими и электрохимическими процессами. К. металлов, дерева, камня.
| прил. коррозийный, -ая, -ое и коррозионный, -ая, -ое.
КОРРО́ЗИЯ -и; ж. [от лат. corrosio - разъедание]
1. Разрушение металлов и некоторых других твёрдых тел, вызываемое химическими и электрохимическими процессами; результат этих процессов. К. железа. / О разрушительных процессах, касающихся внутреннего мира человека. К. души. К. нравственных ценностей.
2. Геол. Изменение горных пород под влиянием воздуха и воды. К. почв.
◁ Коррози́йный, -ая, -ое. К-ые пятна. Коррозио́нный, -ая, -ое. К-ые процессы. К-ая стойкость металла.
* * *
коррозия - I
(от позднелат. corrosio - разъедание), разрушение твердых тел, вызванное химическими и электрохимическими процессами, развивающимися на поверхности тела при его взаимодействии с внешней средой. Особенный ущерб народному хозяйству приносит коррозия металлов. Распространённый вид - ржавление железа (см. также Ржавчина). В результате коррозии ежегодно теряется около 10% общего количества выплавляемых чёрных металлов. Может быть уменьшена или практически устранена нанесением защитных покрытий, например лакокрасочных; введением в среду ингибиторов, например хроматов, нитритов, арсенитов; применением коррозионностойких материалов. Коррозионному разрушению подвержены также бетон, строительный камень, дерево, другие материалы; коррозию полимеров называют деструкцией.
II
(геол.), 1) растворение горных пород на поверхности Земли под влиянием химического воздействия воды (например, явление карста);
2) разъедание, частичное растворение и оплавление магмой ранее выделившихся минералов или захваченных обломков пород.
КОРРОЗИЯ - в геологии -..1) растворение горных пород на поверхности Земли под влиянием химического воздействия воды (напр., явление карста);..2) разъедание, частичное растворение и оплавление магмой ранее выделившихся минералов или захваченных обломков пород.
-----------------------------------
КОРРОЗИЯ (от позднелат. corrosio - разъедание) - разрушение твердых тел, вызванное химическими и электрохимическими процессами, развивающимися на поверхности тела при его взаимодействии с внешней средой. Особенный ущерб народному хозяйству приносит коррозия металлов. Распространенный вид - ржавление железа (см. также Ржавчина). В результате коррозии ежегодно теряется ок. 10% общего количества выплавляемых черных металлов. Может быть уменьшена или практически устранена нанесением защитных покрытий, напр. лакокрасочных; введением в среду ингибиторов, напр. хроматов, нитритов, арсенитов; применением коррозионностойких материалов. Коррозионному разрушению подвержены также бетон, строительный камень, дерево, другие материалы; коррозия полимеров называется деструкцией.
-и, ж.
1. Разрушение металлов и некоторых других твердых тел, вызываемое химическими и электрохимическими процессами, а также результат этих процессов.
Коррозия железа.
2. геол.
Изменение горных пород под влиянием воздуха и воды.
[От лат. corrosio - разъедание]
КОРРОЗИЯ, физико-химическое взаимодействие металлического материала и окружающей среды, которое приводит к понижению выносливости и прочности материала, вплоть до его разрушения. При коррозии железа и сталей во влажной атмосфере обычно образуются оксиды железа в виде ржавчины. Нормальная эксплуатация оборудования, коммуникаций, транспортных средств и т.п. часто возможна лишь при замедлении коррозии при помощи различных средств (например, лакокрасочных покрытий). В промышленно развитых странах убытки от коррозии (как безвозвратные потери металла, так и косвенные убытки, связанные с авариями, простоями оборудования) достигают 4% национального дохода.
корро́зия, корро́зии, корро́зий, корро́зиям, корро́зию, корро́зией, корро́зиею, корро́зиями, корро́зиях
сущ., кол-во синонимов: 10
биокоррозия (1)
изменение (73)
макрокоррозия (1)
микрокоррозия (1)
питтинг (3)
разрушение (71)
разъедание (11)
ржавление (3)
электрокоррозия (1)
↑ вследствие (чего - л), химическая реакция
коррозия - химическое разрушение материалов.
корродировать.
ржавость. | ржавчина. ржа.
ржавление. ржаветь. заржаветь. проржаветь.
ржавый.
корро́зия
(лат. corrosio разъедание)
1) тех. разрушение металлов вследствие хим. или электрохимического взаимодействия их с внешней средой;
2) геол. разрушение (растворение) горных пород под влиянием хим. воздействия воды и образование карстовых форм рельефа (см. карст).
КОРРОЗИЯ и, ж. corrosion f., нем. Korrosion <нем. corrodere разъедать.
1. техн. Разрушение металлов вследствие химического или электрохимического взаимодействия их с внешней средой. СИС 1985. Ржавчина есть простейший вид коррозии. Уш. 1934. Коррозия металлов. БАС-1.
2. геол. Разрушение (растворение) горных пород пол влиянием химического воздействия воды и образования карстовых форм рельефа. СИС 1985. Коррозия почвы. БАС-1. Коррозийный ая, ое. Коррозийные явления. БАС-1. Коррозионный ая, ое. Коррозионная стойкость металла. БАС-1. - Лекс. Южаков 1902: коррозия; Уш. 1934: корро/зия; Ож. 1952: коррози/йный; САН 1914: коррозио/нный.
КОРРОЗИЯ (в геологии) - КОРРО́ЗИЯ, в геологии
1) растворение горных пород на поверхности Земли под влиянием химического воздействия воды (напр., явление карста (см. КАРСТ (явление природы)));
2) разъедание, частичное растворение и оплавление магмой (см. МАГМА) ранее выделившихся минералов или захваченных обломков пород.
КОРРОЗИЯ (разрушение твердых тел) - КОРРО́ЗИЯ (от позднелат. corrosio - разъедание), разрушение твердых тел, вызванное химическими и электрохимическими процессами, развивающимися на поверхности тела при его взаимодействии с внешней средой. Особенный ущерб народному хозяйству приносит коррозия металлов. Распространенный вид - ржавление железа (см. также Ржавчина (см. РЖАВЧИНА)). В результате коррозии ежегодно теряется ок. 10% общего количества выплавляемых черных металлов. Может быть уменьшена или практически устранена нанесением защитных покрытий, напр. лакокрасочных; введением в среду ингибиторов, напр. хроматов, нитритов, арсенитов; применением коррозионностойких материалов (см. КОРРОЗИОННОСТОЙКИЕ МАТЕРИАЛЫ). Коррозионному разрушению подвержены также бетон, строительный камень, дерево, другие материалы; коррозия полимеров называется деструкцией.
КОРРОЗИЯ МЕТАЛЛОВ - самопроизвольное физико-химическое разрушение и превращение полезного металла в бесполезные химические соединения. Большинство компонентов окружающей среды, будь то жидкости или газы, способствуют коррозии металлов; постоянные природные воздействия вызывают ржавление стальных конструкций, порчу корпусов автомобилей, образование питтингов (ямок травления) на хромированных покрытиях и т.д. В этих примерах поверхность металла видимым образом разрушается, но понятие коррозии включает случаи внутреннего разрушительного воздействия, например на границе между кристаллами металла. Эта так называемая структурная (межкристаллитная) коррозия протекает внешне незаметно, но может приводить к авариям и даже несчастным случаям. Зачастую неожиданные повреждения металлических деталей связаны с напряжениями, в частности, связанными с коррозионной усталостью металла. Не всегда коррозия имеет деструктивный характер. Например, зеленая патина, часто наблюдаемая на бронзовых скульптурах, является оксидом меди, который эффективно защищает металл под оксидной пленкой от дальнейшей атмосферной коррозии. Этим объясняется прекрасное состояние многих старинных бронзовых и медных монет. Борьба с коррозией проводится методами защиты, разработанными на основе хорошо известных научных принципов, однако она остается одной из самых серьезных и сложных задач современной техники. Ок. 20% общего количества металлов ежегодно теряется из-за коррозии, и огромные средства тратятся на защиту от коррозии.
Электрохимическая природа коррозии. М. Фарадеем (1830-1840) была установлена связь между химическими реакциями и электрическим током, что явилось основой электрохимической теории коррозии. Однако детальное понимание коррозионных процессов пришло только в начале 20 в. Электрохимия как наука возникла в 18 в. благодаря изобретению А.Вольта (1799) первого гальванического элемента (вольтов столб), с помощью которого был получен непрерывный ток за счет преобразования химической энергии в электрическую. Гальванический элемент состоит из одной электрохимической ячейки, в которой два различных металла (электроды) частично погружены в водный раствор (электролит), способный проводить электричество. Электроды вне электролита соединяются электрическим проводником (металлической проволочкой). Один электрод ("анод") растворяется (корродирует) в электролите, образуя ионы металла, которые переходят в раствор, в то время как ионы водорода накапливаются на другом электроде ("катоде"). Поток положительных ионов в электролите компенсируется посредством прохождения тока электронов (электрического тока) от анода к катоду во внешней цепи.
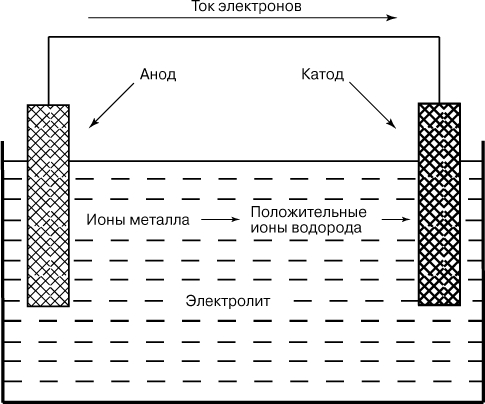
СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА иллюстрирует принцип естественного процесса коррозии металла.
Ионы металла, переходя в раствор, реагируют с компонентами раствора, давая продукты коррозии. Эти продукты зачастую растворимы и не препятствуют дальнейшей коррозии металлического анода. Так, если две смежные области, например на поверхности стали, хотя бы слабо отличаются друг от друга по составу или структуре, то в подходящей (например, влажной) среде на этом месте образуется коррозионная ячейка. Одна область является анодом по отношению к другой, и именно она будет корродировать. Таким образом, все малые локальные неоднородности металла образуют анодно-катодные микроячейки, по этой причине металлическая поверхность содержит многочисленные участки, потенциально подверженные коррозии. Если сталь опустить в обычную воду или почти любую водосодержащую жидкость, то уже готов подходящий электролит. Даже в умеренно влажной атмосфере на поверхности металла будет оседать конденсат влаги, приводящий к возникновению электрохимической ячейки. Как уже отмечалось, электрохимическая ячейка состоит из электродов, погруженных в электролит (т.е. из двух полуячеек). Потенциал (электродвижущая сила, ЭДС) электрохимической ячейки равен разности потенциалов электродов обеих полуячеек. Потенциалы электродов измеряются относительно водородного электрода сравнения. Измеренные электродные потенциалы металлов сведены в ряд напряжений, в котором благородные металлы (золото, платина, серебро и др.) находятся на правом конце ряда и имеют положительное значение потенциала. Обычные, неблагородные, металлы (магний, алюминий и т.д.) имеют сильно отрицательные потенциалы и располагаются ближе к началу ряда слева от водорода. Положение металла в ряду напряжений указывает на его устойчивость к коррозии, которая возрастает от начала ряда к его концу, т.е. слева направо.
См. также ЭЛЕКТРОХИМИЯ; ЭЛЕКТРОЛИТЫ.
Поляризация. Движение положительных (водородных) ионов в электролите по направлению к катоду с последующим разрядом приводит к образованию молекулярного водорода на катоде, что изменяет потенциал данного электрода: устанавливается обратный по знаку (стационарный) потенциал, который уменьшает общее напряжение ячейки. Ток в ячейке очень быстро спадает до чрезвычайно малых величин; в этом случае говорят, что ячейка "поляризована". Это состояние предполагает уменьшение или даже прекращение коррозии. Однако взаимодействие растворенного в электролите кислорода с водородом может свести на нет подобный эффект, поэтому кислород называют "деполяризатором". Эффект поляризации иногда проявляется в уменьшении скорости коррозии в стоячих водах вследствие недостатка кислорода, хотя такие случаи нетипичны, поскольку эффекты конвекции в жидкой среде обычно достаточны для подвода растворенного кислорода к поверхности катода. Неравномерное распределение деполяризатора (как правило, это кислород) над поверхностью металла тоже может вызывать коррозию, поскольку при этом образуется кислородная концентрационная ячейка, в которой коррозия происходит таким же образом, как в любой электрохимической ячейке.
Пассивность и другие анодные эффекты. Термин "пассивность" (пассивирование) был первоначально использован по отношению к коррозионной стойкости железа, погруженного в концентрированный раствор азотной кислоты. Однако это более общее явление, так как в определенных условиях многие металлы находятся в пассивном состоянии. Феномен пассивности был объяснен в 1836 Фарадеем, который показал, что ее причиной является чрезвычайно тонкая оксидная пленка, образующаяся в результате химических реакций на поверхности металла. Такая пленка может восстанавливаться (изменяться химически), и металл вновь становится активным при контакте с металлом, имеющим более отрицательный потенциал, например, железо в соседстве с цинком. При этом образуется гальваническая пара, в которой пассивный металл является катодом. Водород, выделяющийся на катоде, восстанавливает его защитную оксидную пленку. Оксидные пленки на алюминии защищают его от коррозии, и потому анодированный алюминий, получающийся в результате анодного окислительного процесса, используется как в декоративных целях, так и в быту. В широком химическом смысле все анодные процессы, протекающие на металле, являются окислительными, однако термин "анодное окисление" подразумевает целенаправленное образование значительного количества твердого оксида. Пленка определенной толщины образуется на алюминии, являющемся анодом в ячейке, электролитом которой служит серная или фосфорная кислота. Во многих патентах описаны различные модификации этого процесса. Первоначально анодированная поверхность имеет пористую структуру и может быть окрашена в любой желаемый цвет. Введение в электролит бихромата калия дает яркий оранжево-желтый оттенок, в то время как гексацианоферрат(II) калия, перманганат свинца и сульфид кобальта окрашивают пленки в голубой, красно-коричневый и черный цвета соответственно. Во многих случаях применяются водорастворимые органические красители, и это придает металлический глянец окрашенной поверхности. Образующийся слой необходимо закрепить, для чего достаточно обработать поверхность кипящей водой, хотя используются и кипящие растворы ацетатов никеля или кобальта.
Структурная (межкристаллитная) коррозия. Различные сплавы, в частности алюминиевые, увеличивают свою твердость и прочность при старении; процесс ускоряют, подвергая сплав термообработке. При этом образуются субмикроскопические частицы, которые располагаются вдоль пограничных слоев микрокристаллов (в межкристаллитном пространстве) сплава. В определенных условиях область, непосредственно примыкающая к границе, становится анодом по отношению к внутренней части кристалла, и в коррозионной среде границы между кристаллитами будут преимущественно подвержены коррозии, причем коррозионные трещины глубоко внедряются в структуру металла. Эта "структурная коррозия" серьезно влияет на механические свойства. Ее можно предотвратить либо с помощью правильно подобранных режимов термообработки, либо защитой металла непроницаемым для коррозии покрытием. Плакирование - холодное покрытие одного металла другим: высокопрочный сплав прокатывается между тонкими полосками чистого алюминия и уплотняется. Металл, входящий в подобную композицию, становится коррозионностойким, при этом само покрытие слабо сказывается на механических свойствах.
См. также МЕТАЛЛОПОКРЫТИЯ.
Предотвращение коррозии. При электрохимической коррозии образующиеся продукты часто растворяются (переходят в раствор) и не препятствуют дальнейшему разрушению металла; в некоторых случаях в раствор можно добавить химическое соединение (ингибитор), которое реагирует с первичными продуктами коррозии с образованием нерастворимых и обладающих протекторными свойствами соединений, которые осаждаются на аноде или на катоде. Например, железо легко корродирует в разбавленном растворе обычной соли (NaCl), однако при добавлении сульфата цинка в раствор образуется малорастворимый гидроксид цинка на катоде, а при добавлении фосфата натрия - нерастворимый фосфат железа на аноде (примеры катодных и анодных ингибиторов соответственно). Такие методы защиты можно применять только в тех случаях, когда конструкция целиком или частично погружена в жидкую коррозионную среду. Для уменьшения скорости коррозии часто используют катодную защиту. В этом методе на систему накладывается электрическое напряжение таким образом, чтобы вся защищаемая конструкция была катодом. Это осуществляется подключением конструкции к одному полюсу выпрямителя или генератора постоянного тока, в то время как к другому полюсу подключается внешний химически инертный анод, такой, как графит. Например, в случае защиты от коррозии трубопроводов нерастворимый анод зарывается в землю вблизи от них. В некоторых случаях для этих целей используются дополнительные защитные аноды, например, подвешенные внутри емкостей для хранения воды, причем вода в емкости выполняет роль электролита. В других методах катодной защиты обеспечивается достаточный ток, протекающий от какого-либо иного источника через конструкцию, которая полностью становится катодом и содержит возможные локальные аноды и катоды при одном и том же потенциале. Для этого к защищаемому металлу подсоединяют металл с более отрицательным потенциалом, который в образуемой гальванической паре играет роль протекторного анода и разрушается первым. Протекторные аноды из цинка применялись уже с 1825, когда знаменитый английский химик Х.Дэви предложил использовать их для защиты медной обшивки деревянных корпусов кораблей. Аноды на основе магниевых сплавов широко используются для защиты корпусов современных кораблей от коррозии в морской воде. Протекторные аноды чаще применяются по сравнению с анодами, связанными с внешними источниками тока, поскольку они не требуют энергозатрат. Окрашивание поверхности также используется для защиты от коррозии, особенно если конструкция не полностью погружена в жидкость. Металлические покрытия можно наносить путем напыления металлов или при помощи гальванотехники (например, хромирование, цинкование, никелирование).
Типы специфической коррозии. Коррозия в напряженном состоянии представляет собой разрушение металла под влиянием комбинированного действия статической нагрузки и коррозии. Основной механизм - первоначальное образование коррозионных питтингов и трещин с последующим разрушением конструкции, вызванным концентрациями напряжения в этих трещинах. Детали механизма коррозии сложны и не всегда понятны, они могут быть связаны с остаточными напряжениями. Чистые металлы, а также латунь не склонны к коррозии в напряженном состоянии. В случае сплавов появляются трещины в межкристаллитном пространстве, которое является анодом по отношению к внутренним участкам зерен; это увеличивает вероятность коррозионного воздействия вдоль межкристаллитных границ и облегчает последующий процесс растрескивания по ним. Коррозионная усталость также является следствием совместного действия механического напряжения и коррозии. Однако циклические нагрузки опаснее статических. Усталостное растрескивание часто наступает и в отсутствие коррозии, но разрушительный эффект коррозионных трещин, которые создают места концентрации напряжения, очевиден. Вероятно, все так называемые усталостные механизмы включают коррозию, так как невозможно полностью исключить поверхностную коррозию. Коррозия под действием жидких металлов - особая форма коррозии, которая не включает электрохимический механизм. Жидкие металлы имеют большое значение в системах охлаждения, в частности, ядерных реакторов. В качестве охладителей используются жидкие калий и натрий и их сплавы, а также жидкие свинец, висмут и свинцово-висмутовые сплавы. Большинство конструкционных металлов и сплавов при контакте с подобной жидкой средой в той или иной степени подвергаются деструкции, при этом механизм коррозии в каждом случае может быть различным. Во-первых, материал контейнера или труб в системе теплопередачи может в небольшой степени растворяться в жидком металле, а так как растворимость обычно изменяется с температурой, растворенный металл может осаждаться из раствора в охлажденной части системы, забивая при этом каналы и клапаны. Во-вторых, возможно межкристаллитное проникновение жидкого металла, если существует его селективная реакция с легирующими добавками конструкционного материала. Здесь, как и в случае электрохимической межкристаллитной коррозии, механические свойства ухудшаются без видимых проявлений и без изменения массы конструкции; правда, такие случаи разрушительного воздействия встречаются редко. В-третьих, жидкий и твердый металлы могут взаимодействовать с образованием поверхностного сплава, который в некоторых случаях служит диффузионным барьером по отношению к дальнейшему воздействию. Эрозионная коррозия (ударная, кавитационная коррозия) относится к механическому воздействию жидкого металла, текущего в турбулентном режиме. В экстремальных случаях это приводит к кавитации и эрозионному разрушению конструкции.
См. также КАВИТАЦИЯ. Коррозионные эффекты радиации интенсивно исследуются в связи с развитием атомной энергетики, однако в открытой печати мало информации по этому вопросу. Общеупотребительный термин "радиационное повреждение" относится ко всем изменениям механической, физической или химической природы твердых материалов, которые обусловлены воздействием радиации следующих типов: ионизирующее излучение (рентгеновское или g), легкие заряженные частицы (электроны), тяжелые заряженные частицы (a-частицы) и тяжелые незаряженные частицы (нейтроны). Известно, что бомбардировка металла тяжелыми частицами высоких энергий приводит к возникновению нарушений на атомном уровне, которые при соответствующих обстоятельствах могут быть местами возникновения электрохимических реакций. Однако более важное изменение происходит не в самом металле, а в его окружении. Такие непрямые эффекты возникают в результате действия ионизирующего излучения (например, g-лучей), которое не изменяет свойства металла, но в водных растворах вызывает образование высокореакционных свободных радикалов и пероксида водорода, а подобные соединения способствуют возрастанию скорости коррозии. Кроме того, такой ингибитор коррозии, как дихромат натрия, будет восстанавливаться и терять свою эффективность. Под действием ионизирующего излучения оксидные пленки также ионизируются и теряют свои коррозионнозащитные свойства. Все вышеперечисленные особенности сильно зависят от конкретных условий, связанных с коррозией.
Окисление металлов. Большинство металлов взаимодействует с кислородом воздуха с образованием стабильных оксидов металла. Скорость, с которой происходит окисление, сильно зависит от температуры, и при нормальной температуре на металлической поверхности образуется только тонкая пленка оксида (на меди, например, это заметно по потемнению поверхности). При более высоких температурах процесс окисления протекает быстрее. Благородные металлы представляют исключение из этого правила, так как обладают малым сродством к кислороду. Предполагается, что золото вообще не окисляется при нагревании на воздухе или в кислороде, а слабое окисление платины при температурах до 450° С прекращается при нагревании до более высоких температур. Обычные же конструкционные металлы окисляются с образованием четырех типов оксидных соединений: летучих, плотных, защитных или непористых. Небольшое число тугоплавких металлов, таких, как вольфрам и молибден, становятся хрупкими при высоких температурах и образуют летучие оксиды, поэтому защитный оксидный слой не образуется и при высокой температуре металлы следует защищать инертной атмосферой (инертные газы). Сверхлегкие металлы образуют, как правило, слишком плотные оксиды, которые пористы и не защищают металлы от дальнейшего окисления. По этой причине магний окисляется очень легко. Защитные оксидные слои образуются у многих металлов, но обычно они обладают умеренной защитной способностью. Оксидная пленка на алюминии, например, полностью покрывает металл, однако при напряжениях сжатия развиваются трещины, по-видимому, за счет изменений температуры и влажности. Защитный эффект оксидных слоев ограничивается относительно низкими температурами. Многие "тяжелые металлы" (например, медь, железо, никель) образуют непористые оксиды, которые, хотя и не растрескиваются, не всегда защищают основной металл. Теоретически эти оксиды представляют большой интерес и активно исследуются. Они содержат менее стехиометрического количества металла; отсутствующие атомы металла образуют дырки в решетке оксида. Вследствие этого атомы могут диффундировать сквозь решетку, и толщина оксидного слоя постоянно увеличивается.
Применение сплавов. Так как все известные конструкционные металлы склонны к окислению, элементы конструкции, которые находятся при высоких температурах в окислительной среде, следует изготовлять из сплавов, которые в качестве легирующего элемента содержат металл, стойкий к действию окислителя. Этим требованиям отвечает хром - достаточно дешевый металл (применяемый в виде феррохрома), который присутствует в составе почти всех высокотемпературных сплавов, отвечающих требованиям устойчивости к окислению. Поэтому все нержавеющие стали, легированные хромом, имеют хорошую устойчивость к окислению и находят широкое применение в домашнем хозяйстве и промышленности. Сплав нихром, который повсеместно применяется в качестве проволоки для спиралей электрических печей, содержит 80% никеля и 20% хрома и вполне стоек к окислению при температурах до 1000° С. Не меньше, чем устойчивость к окислению, важны механические свойства, и часто оказывается, что определенные элементы сплавов (такие, как хром) придают сплаву и высокотемпературную прочность, и устойчивость к окислению, так что проблема высокотемпературного окисления не вносила серьезных затруднений до тех пор, пока не стали использовать (в газотурбинных двигателях) в качестве топлива мазут, содержащий ванадий или натрий. Эти загрязнения вместе с серой в топливе дают продукты сгорания, обладающие чрезвычайно сильным коррозионным действием. Попытки решить эту проблему завершились разработкой добавок, которые при сгорании образуют безопасные летучие соединения с ванадием и натрием. Фреттинг-коррозия не включает в себя электрохимическую коррозию или прямое окисление в газовой фазе, а является в основном механическим эффектом. Это повреждение сочленных металлических поверхностей в результате истирания при их малых многократных относительных смещениях; наблюдается в виде царапин, язв, раковин; сопровождается заклиниванием и снижает устойчивость к коррозионной усталости, т.к. образующиеся царапины служат исходными точками для развития коррозионной усталости. Типичные примеры - повреждения в пазах крепления лопаток турбин при вибрации, истирание рабочих колес компрессора, изнашивание зубьев шестеренок, резьбовых соединений и т.д. При малых многократных смещениях защитные оксидные пленки разрушаются, истираются в порошок и увеличивается скорость коррозии. Фреттинг-коррозия стали легко идентифицируется по наличию красно-коричневых частиц оксида. Борьбу с фреттинг-коррозией ведут путем совершенствования конструкций, применения защитных покрытий, эластомерных прокладок, смазок.
См. также
МЕТАЛЛОВ ТЕРМИЧЕСКАЯ ОБРАБОТКА.
ЛИТЕРАТУРА
Кеше Г. Коррозия металлов. М., 1984 Колотыркин Я.М. Металл и коррозия. М., 1985 Люблинский Е.Я. Что нужно знать о коррозии. Л., 1986 Фомин Г.С. Коррозия и защита от коррозии. Энциклопедия международных стандартов. М., 1994