Окисли́тельно-восстанови́тельные реа́кции - сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ, например:
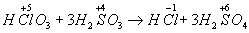 .
.
Вещество, в котором понижается степень окисления атома, то есть он приобретает электроны (здесь Cl в HClO3), называется окислителем; если повышается степень окисления, то есть атом отдаёт электроны (S в Н2SO3), вещество называется восстановителем. Понижение степени окисления атома в молекуле называется восстановлением, повышение - окислением.
* * *
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ - ОКИСЛИ́ТЕЛЬНО-ВОССТАНОВИ́ТЕЛЬНЫЕ РЕА́КЦИИ (реакции окисления-восстановления), химические реакции, сопровождающиеся изменением степени окисления (см. СТЕПЕНЬ ОКИСЛЕНИЯ) атомов, входящих в состав реагирующих веществ. Первоначально окислением назывались только реакции веществ с O2, а восстановлением - реакции, в результате которых вещество теряло атом кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций распространилось и на реакции без участия кислорода.
В неорганической химии окислительно-востановительные реакции формально рассматриваются как перемещение электронов от атома одного реагента к атому другого, например: HCl+5O3 + 3H2 S+4O3® HCl + 3H2 S+6O4. Вещество, в котором степень окисления атома понижается за счет приобретения электронов, называется окислителем (здесь HClO3), а вещество, в котором степень окисления атомов повышается за счет отдачи электронов - восстановителем (здесь H2SO3). При этом, окислитель восстанавливается, а восстановитель окисляется.
В органической химии окисление обычно рассматривают как процесс, в результате которого из-за перехода электрона от органического соединения к окислителю восрастает число или кратность кислородсодержащих (C-O, N-O, S-O) или уменьшается число водородсодержащих (C-H, N-H, S-H) связей. При восстановлении органических соединений в результате приобретения электронов происходят обратные процессы.