СЕГНЕТОЭЛЕКТРИЧЕСТВО - электрический аналог ферромагнетизма. Подобно тому как в ферромагнитных веществах при помещении их в магнитное поле проявляется остаточная магнитная поляризация (момент), в сегнетоэлектрических диэлектриках, помещенных в электрическое поле, возникает остаточная электрическая поляризация.
См. также
МАГНИТЫ И МАГНИТНЫЕ СВОЙСТВА ВЕЩЕСТВА. Микроскопической причиной сегнетоэлектричества является наличие внутри вещества атомных (или молекулярных) диполей. Эти диполи ориентируются внешним электрическим полем и остаются ориентированными после снятия поля; переключение направления поля на противоположное приводит к обратной ориентации диполей. Принципиальное отличие сегнетоэлектричества от ферромагнетизма состоит в том, что свободные электрические заряды могут экранировать электрические поля, создаваемые электрическими диполями, а это затрудняет прямое наблюдение статической поляризации. Поляризацию обычно измеряют по так называемой петле гистерезиса. Образец помещают между пластинами конденсатора, на которые подается переменное напряжение E. На экране осциллографа регистрируется кривая зависимости заряда, возникающего на пластинах, а тем самым и электрической поляризации (поскольку заряд, отнесенный к единице площади поверхности пластин, является мерой вектора электрической поляризации P), от напряжения (поля) E. Петля гистерезиса, представленная на рис. 1, характеризуется двумя величинами: остаточной поляризацией P (любого знака), имеющейся даже при нулевом поле E, и коэрцитивным полем Ec, при котором вектор поляризации изменяет направление на обратное. Площадь петли гистерезиса равна работе электрических сил, затрачиваемой в пределах одного цикла перехода сегнетоэлектрика между двумя эквивалентными состояниями поляризации противоположного знака.
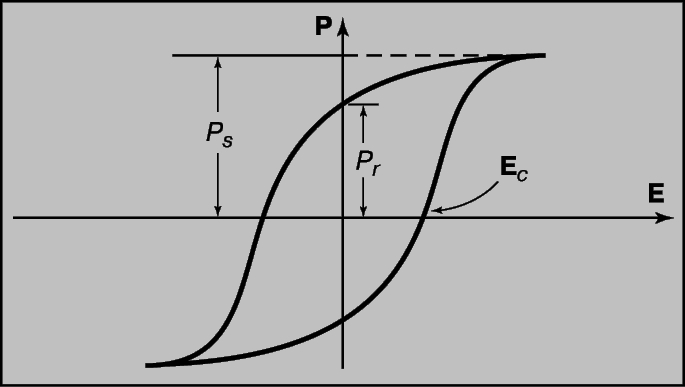
Рис.
1. ПЕТЛЯ ГИСТЕРЕЗИСА ДЛЯ СЕГНЕТОЭЛЕКТРИКА, демонстрирующая характерную связь между вектором поляризации P и электрическим полем E; Ec - коэрцитивное поле, при котором вектор поляризации меняет направление на обратное.
Хотя образование петли гистерезиса является свидетельством наличия сегнетоэлектричества, во многих сегнетоэлектрических веществах она возникает лишь при определенных условиях, а иногда и вообще не наблюдается. Подобные трудности характерны для электропроводящих веществ, материалов с высокими диэлектрическими потерями и очень большими коэрцитивными полями. В этих случаях для выявления сегнетоэлектричества используются другие эффекты, в частности пироэлектрический эффект (зависимость вектора поляризации от температуры), зависимость диэлектрической проницаемости от температуры, наличие доменной структуры (см. ниже), особенности кристаллической структуры и динамики решетки. См. также КРИСТАЛЛЫ И КРИСТАЛЛОГРАФИЯ. Первым веществом, в котором было обнаружено сегнетоэлектричество, была сегнетова соль KNaC4H4O6*4H2O. Аналогия между диэлектрическими свойствами этого вещества и ферромагнитными свойствами железа была установлена Дж.Валашеком (США) в 1920. Ему же удалось определить и температуру Кюри Tc как температуру перехода, при которой в сегнетовой соли возникает упорядоченная поляризация. Выше этой температуры дипольное упорядочение, а вместе с ним и сегнетоэлектричество, отсутствуют. Ряд сегнетоэлектрических кристаллов был впервые получен в 1935 в Цюрихе Г.Бушем и П.Шеррером. В качестве исходного был взят кристалл дигидрофосфата калия KH2PO4. Изоморфные с ним кристаллы, в которые вместо фосфора и водорода входят мышьяк и дейтерий, тоже обнаруживали сегнетоэлектрические свойства. Соединения аммония же (например, NH4H2PO4) не становились сегнетоэлектрическими ниже температуры Кюри, и спустя 20 лет было установлено, что они являются антисегнетоэлектриками. Это означает, что чередующиеся диполи таких кристаллов ориентируются антипараллельно друг другу (подобно магнитным моментам в антиферромагнетике). До 1943 считалось, что содержание водорода в известных сегнетоэлектриках является непременным условием сегнетоэлектричества. Л.Онсагер и Дж.Слэтер в 1939 предположили, что в кристалле КН2РО4 носителями сегнетоэлектрических свойств являются ионы водорода, смещенные из положения равновесия и упорядочивающиеся при температуре ниже Тс. Однако после открытия в 1945 Б.М.Вулом и И.М.Гольдманом сегнетоэлектричества в титанате бария BaTiO3 стало ясно, что наличие или отсутствие атомов водорода несущественно для сегнетоэлектричества. Выяснилось также, что явление сегнетоэлектричества распространено значительно шире, чем было принято считать ранее; в частности, оно возможно и в сравнительно простых кристаллических структурах. Вслед за титанатом бария в короткий срок было открыто много других сегнетоэлектриков, и в настоящее время их известно более 340. Кристаллическая структура BaTiO3 изображена на рис. 2. Она достаточно проста для исследования методом рентгеноструктурного анализа и дала первую детальную картину атомных смещений, сопутствующих установлению сегнетоэлектричества. Выше температуры Кюри Тс (135° С) кристалл имеет объемно-центрированную кубическую решетку. При температуре, равной Тс, ион титана скачком смещается вдоль одной из осей куба (рис. 3), в результате чего возникает тетрагональная структура. Соседние ионы титана смещаются в том же направлении, что и приводит к появлению макроскопической поляризации, т.е. сегнетоэлектричеству. При температурах ниже комнатной по мере того, как ионы Ti смещаются вдоль других осей куба, происходят два дальнейших фазовых перехода в орторомбическую и ромбоэдрическую структуры. Было выявлено много соединений, обладающих подобной простой структурой перовскита или близкой к ней, и найдены важные технические применения. Температура Кюри и другие сегнетоэлектрические характеристики существенно зависят от состава таких соединений.
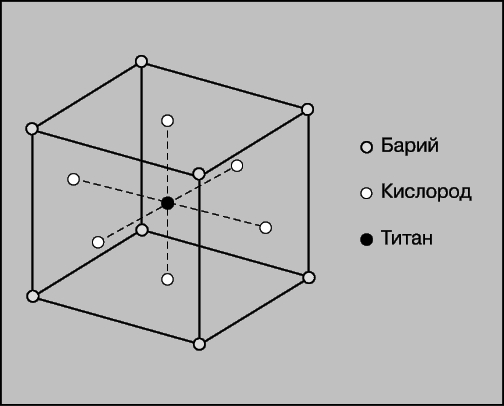
Рис. 2. КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА ТИТАНАТА БАРИЯ, элементарная ячейка. При поляризации кристалла ионы титана и кислорода смещаются из своих позиций.
В кубической структуре шесть главных направлений вдоль ребер куба эквивалентны друг другу, а потому понятие тетрагонального искажения в равной мере пригодно по отношению к любому из них. В только что выращенном кристалле отдельные области, "домены", имеют разные направления поляризации. Эти домены часто выявляются в поляризованном свете, поскольку оптические свойства домена обладают той же симметрией, что и локальная кристаллическая структура. Ширина границ между доменами ("доменных стенок"), как правило, не превышает нескольких элементарных ячеек. Если к многодоменному кристаллу приложить электрическое поле (превышающее Ec), то домены, ориентированные вдоль поля, будут расти (вследствие смещения доменной стенки) за счет ориентированных против поля. В итоге весь кристалл превращается в один домен с однородными оптическими свойствами. Обращение вектора поляризации тоже сопровождается смещением доменной стенки. Поскольку многие сегнетоэлектрические соединения обладают сходными структурами, можно образовать твердые растворы из двух или более таких веществ. Подобные растворы часто отличаются по своим свойствам от их ингредиентов; в частности, точка Кюри оказывается размытой, так что сегнетоэлектрический переход происходит постепенно в широком диапазоне температур и диэлектрическая проницаемость в этом диапазоне обнаруживает сложное поведение релаксационного характера. Такие переходы обычно называют диффузными, и соответствующие микроскопические процессы весьма интенсивно исследуются. Другие структуры, например композиционные материалы на основе сегнетоэлектриков и полимеров или стекол, часто сохраняют ценные качества своих ингредиентов. Примером могут служить гибкие сегнетоэлектрики, сегнетоэлектрики с большой сжимаемостью, а также многослойные структуры с большой электрической емкостью (способностью к накоплению заряда). Подобные композиционные материалы возможны по той причине, что из многих сегнетоэлектриков (например, BaTiO3 и цирконата-титаната свинца PZT) можно без труда изготовить поликристаллические керамики, а будучи отлиты в сложные формы, они обычно в значительной мере сохраняют сегнетоэлектрические свойства массивного материала. Сегнетоэлектрические свойства обнаруживают не только твердые кристаллические вещества. Некоторые жидкие кристаллы и полимерные материалы тоже являются сегнетоэлектриками. В смектических жидких кристаллах молекулярная структура такова, что киральные центры (молекулярные диполи) соседних молекул благодаря стерическим взаимодействиям между молекулами ориентированы почти параллельно. Внешнее электрическое поле изменяет направление этих диполей на обратное за счет молекулярных вращений. В полимере поливинилиденфториде PVF2 молекулярные диполи, присоединенные к полимерному скелету, могут быть ориентированы в электрическом поле с образованием устойчивой решетки, обнаруживающей макроскопическую поляризацию. Такие материалы весьма перспективны для многих видов применения. См. также
ЖИДКОСТЕЙ ТЕОРИЯ. Первые теории сегнетоэлектричества относились лишь к небольшому числу известных тогда конкретных кристаллических структур. Теория Слэтера (1950), основанная на гипотезе дальнодействующих дипольных сил, была успешно применена к описанию BaTiO3. Феноменологические теоретические модели, развитые А.Девонширом и В.Л.Гинзбургом, оказались вполне пригодными для описания поведения сегнетоэлектрической и несегнетоэлектрической фаз, а также для интерпретации теплового, упругого и электрического поведения материалов вблизи сегнетоэлектрического фазового перехода. В 1960 Ф.Андерсон и В.Кохран установили, что эта теория может быть построена на основе понятий динамики решетки. В частности, они ввели термин "мягкие моды" для движений ионов всех атомов, принимающих участие в переходах типа смещения. С 1960-х годов такой подход стал доминирующим в теории сегнетоэлектричества и использовался для описания всех типов сегнетоэлектрической неустойчивости.
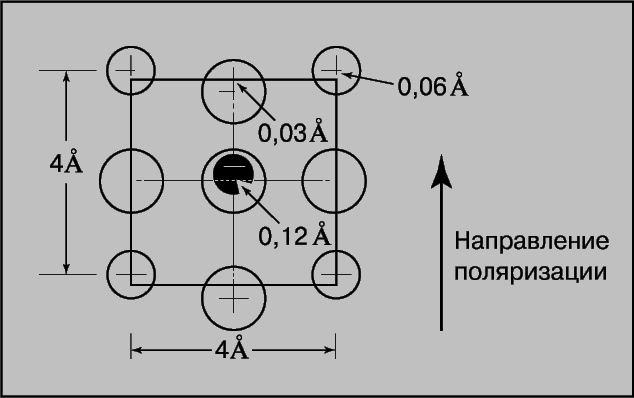
Рис. 3. КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА ТИТАНАТА БАРИЯ (проекция на грань куба). Смещение атомов титана и кислорода из нормальных положений преувеличено для иллюстрации ионной деформации, ведущей к сегнетоэлектричеству. Смещения указаны в ангстремах.
Применения. Сегнетоэлектрические материалы широко изучались в перспективе разнообразных применений. Достаточно привести лишь несколько примеров. Большая диэлектрическая проницаемость вблизи Тс (например, в BaTiO3) представляет интерес с точки зрения применения в многослойных конденсаторах. Ниобат лития (LiNbO3), обладающий большими электрооптическими коэффициентами, - наилучший материал для интегральных оптических модуляторов и дефлекторов. Тонкие пленки из цирконата-титаната свинца и лантана (PLZT) активно изучаются с целью создания энергозависимых микроэлектронных ЗУ с применением кремниевой технологии. (Бистабильная поляризация - идеальная основа для двоичных ячеек памяти.) Кристалл КН2РО4 широко применяется для удвоения оптической частоты лазера. Из триглицинсульфата (TGS) изготавливаются фотоприемники для инфракрасной области спектра. Сегнетоэлектрическая керамика и полимеры используются в качестве пьезоэлектрических преобразователей, гидрофонов и измерительных преобразователей давления. Успехи в этих и других технических приложениях будут определяться достижениями в области обработки материалов и выращивания кристаллов сегнетоэлектриков высокого качества.
См. также ФИЗИКА ТВЕРДОГО ТЕЛА.
ЛИТЕРАТУРА
Струков Б.А., Леванюк А.П. Физические основы сегнетоэлектрических явлений в кристаллах. М., 1995