Очень точные весы, показывающее верно вес даже очень малых количеств.
химические войска
Энциклопедический словарь
Хими́ческие войска́ - специальные войска для обеспечения действий войск (сил) в операции (бою) в условиях радиоактивного, химического и биологического заражения. Состоят из подразделений и частей радиационной и химической разведки, специальной обработки и др.
* * *
ХИМИЧЕСКИЕ ВОЙСКА - ХИМИ́ЧЕСКИЕ ВОЙСКА́, специальные войска для обеспечения действий войск (сил) в операции (бою) в условиях радиоактивного, химического и биологического заражения. Состоят из подразделений и частей радиационной и химической разведки, специальной обработки и др.
Большой энциклопедический словарь
ХИМИЧЕСКИЕ ВОЙСКА - специальные войска для обеспечения действий войск (сил) в операции (бою) в условиях радиоактивного, химического и биологического заражения. Состоят из подразделений и частей радиационной и химической разведки, специальной обработки и др.
Полезные сервисы
химические волокна
химические знаки
Энциклопедический словарь
Хими́ческие зна́ки - см. Знаки химические.
* * *
ХИМИЧЕСКИЕ ЗНАКИ - ХИМИ́ЧЕСКИЕ ЗНА́КИ, см. Знаки химические (см. ЗНАКИ ХИМИЧЕСКИЕ).
Большой энциклопедический словарь
ХИМИЧЕСКИЕ ЗНАКИ - см. Знаки химические.
Словарь иностранных слов
ХИМИЧЕСКИЕ ЗНАКИ - см. ХИМИЧЕСКИЕ ФОРМУЛЫ.
Полезные сервисы
химические источники света
Энциклопедический словарь
Хими́ческие исто́чники све́та (хемилюминесцентные источники света), устройства, генерирующие свет при протекании химической реакции (например, каталитические реакции некоторых эфиров щавелевой кислоты с пероксидом водорода в присутствии люминофора). Используют для сигнализации, при проведении аварийно-спасательных работ и др.
Полезные сервисы
химические источники тока
Энциклопедический словарь
Хими́ческие исто́чники то́ка - устройства, вырабатывающие электрическую энергию за счёт окислительно-восстановительной реакции, протекающей на электродах. Различают химические источники тока однократного действия - гальванические элементы, многократного - аккумуляторы и с непрерывной подачей реагентов на электроды - топливные элементы. Применяются в электрических, электронных и радиоустройствах, измерительных приборах, на транспортных средствах, в бытовой технике, научно-исследовательской аппаратуре и др. Производство исчисляется миллиардами штук в год.
Полезные сервисы
химические лучи
химические реакции
Энциклопедия Кольера
Равновесие. Вещества вступают в химические реакции потому, что при этом уменьшается энергия системы, т.е. электронная конфигурация продуктов реакции оказывается энергетически более выгодной, чем конфигурация исходных реагентов. (Правда, есть еще один фактор - энтропийный;
см. также ТЕРМОДИНАМИКА.)
При большой разности энергий (т.е. большом различии в стабильности исходных реагентов и продуктов) реакция происходит мгновенно. Например, если кислород и водород смешать в определенном соотношении и смесь поджечь, то газы прореагируют мгновенно без остатка с образованием воды:
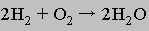
Молекула воды стабильнее, чем смесь водорода и кислорода, поскольку прочность двух связей О-Н больше, чем суммарная прочность связей Н-Н и О-О. Прочность связи определяется той энергией, которая выделяется при ее образовании.
См. также
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. Если разность энергий исходных реагентов и конечных продуктов химической реакции невелика, то в реакционной смеси присутствуют в заметных количествах и те, и другие, причем по прошествии определенного времени между ними устанавливается равновесие. В качестве примера можно привести растворение уксусной кислоты в воде:
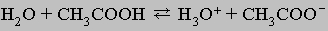
(Атомы водорода в группе СН3 соединены с атомом углерода прочными ковалентными связями и не являются кислотными.) Полной ионизации уксусной кислоты в этой реакции не происходит: когда примерно 1% ее молекул диссоциирует на ионы, скорость соединения последних с образованием исходных молекул становится равной скорости диссоциации и концентрация частиц в растворе перестает меняться. Устанавливается т.н. динамическое равновесие. Положение равновесия можно изменить (сдвинуть), добавляя или удаляя любое из веществ, участвующих в реакции. При этом равновесие сдвигается таким образом, чтобы эффект изменения концентрации был минимальным (принцип Ле Шателье).
Таким образом, добавление воды вызывает дополнительную ионизацию уксусной кислоты (поскольку при ионизации некоторое количество воды связывается в H3O+), а добавление ацетат-иона (СН3СОО-) дает обратный эффект. Каждая равновесная реакция характеризуется т.н. константой равновесия - величиной, равной отношению произведения концентраций продуктов к произведению концентраций исходных реагентов; при этом каждая из концентраций берется в степени, равной числу молекул данного типа, участвующих в реакции. Константа равновесия, как правило, не зависит от концентрации, но изменяется с температурой.
Кинетика. Скорости химических реакций сильно различаются. Например, смесь водорода и кислорода после того, как ее подожгут, буквально взрывается, а превращение алмаза в химически более устойчивую кристаллическую форму углерода, графит, происходит так медленно, что не завершается и за миллиарды лет. Скорость химических реакций определяется их механизмом. Многие реакции в действительности гораздо сложнее, чем это кажется из их суммарного уравнения. Так, оказалось, что разложение озона с образованием кислорода протекает в два этапа. На первом этапе диссоциирует одна молекула озона, при этом быстро достигается равновесие:
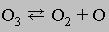
Второй этап гораздо более медленный, он и определяет скорость реакции:
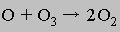
Сложение этих двух уравнений приводит к суммарному уравнению
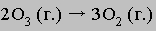
Не исключено, что впоследствии будут предложены другие механизмы, удовлетворяющие экспериментальным данным о скорости этой реакции. Наименьшая энергия, которой должны обладать взаимодействующие частицы для того, чтобы между ними началась химическая реакция, называется энергией активации. Как правило, чем она ниже, тем быстрее протекает реакция. Для протекания реакции большое значение имеет также энтропийный фактор.
Типы реакций. Реакции можно классифицировать, используя несколько схем, и каждая из них по-своему удобна. Здесь реакции разделены на три типа: ионные, в ходе которых ионы удаляются из зоны реакции путем образования нерастворимого, газообразного или ковалентно связанного продукта; окислительно-восстановительные, в которых происходит перемещение электронов; реакции (в том числе реакции между кислотой Льюиса и основанием Льюиса), сопровождающиеся перераспределением обобществленных электронов.
Ионные реакции. Простые ионные реакции без переноса электронов происходят, когда один из продуктов нерастворим (газ или твердое вещество) или является ковалентно связанным веществом, остающимся в растворе. Ионную реакцию, продукт которой - нерастворимое твердое вещество, можно представить в виде
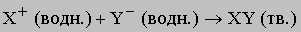
Сами ионы в ходе реакции не претерпели никаких изменений, но теперь они прочно удерживаются в кристаллической решетке. Для предсказания хода таких реакций важно знать растворимость участвующих в них веществ. Например, хлорид серебра плохо растворяется в воде, и можно сделать вывод, что реакция
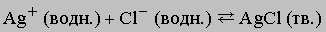
хотя и обратима, но равновесие сильно сдвинуто вправо. (Эту реакцию используют для обнаружения ионов хлора или серебра в растворе, а также для их количественного определения.
См. также ХИМИЯ АНАЛИТИЧЕСКАЯ.)
Ионы серебра могут находиться в составе любого из растворимых соединений: в виде нитрата, сульфата, ацетата и т.д.; ионы хлора могут быть компонентами таких солей, как соли натрия, калия, бария или алюминия. Таким образом, приведенное выше уравнение можно рассматривать как обобщенное представление реакции обменного разложения, когда два реагента разлагаются и обмениваются своими составляющими. Например, это могут быть такие реакции:
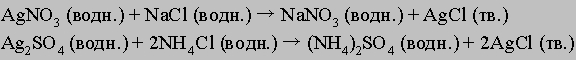
При образовании газообразного продукта вещество тоже выводится из зоны реакции. Этот тип ионной реакции можно представить в следующем виде:
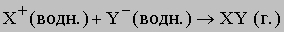
В данном случае ионы перестают существовать - из них образуются молекулы. В качестве примера можно привести растворение карбоната в кислом растворе. Вместе с образующимся газообразным диоксидом углерода из реакционной смеси уходят углерод и кислород:
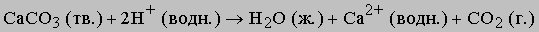
Реакции, в которых образуется ковалентно связанный (недиссоциирующий) продукт, можно представить следующим образом:
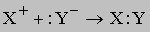
К этому типу относятся реакции нейтрализации. Когда соединение, которое диссоциирует с образованием ионов водорода (кислота), взаимодействует с основанием (источником гидроксильных ионов), образуется вода. В молекуле воды все атомы соединены ковалентными связями, поэтому реакция идет практически до конца (ее константа равновесия равна 10-14). Реакцию нейтрализации можно записать в виде
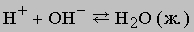
Приведем примеры реакций нейтрализации с участием сильной (HCl) и слабой (CH3COOH) кислот:
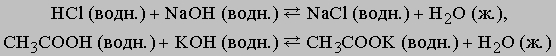
Сильные кислоты практически полностью диссоциируют в воде, высвобождая ионы водорода, слабые диссоциируют незначительно. Плохо диссоциируют и слабые основания. Ниже перечислены наиболее распространенные кислоты и основания. Отметим, что некоторые соединения обладают как кислотными, так и основными свойствами. Их называют амфотерными.
Слабые основания, представленные в таблице, не содержат ионов ОН-. Эти ионы образуются при взаимодействии с водой:
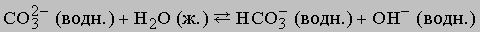
Поэтому раствор карбоната щелочной. Более общее определение кислот и оснований, которое используется и в случае неводных систем, например газов, было дано американским физикохимиком Г.Льюисом. Взаимодействие между льюисовыми кислотами и основаниями - это реакция между донором электронной пары, за счет которой образуется ковалентная связь (основание Льюиса), и акцептором этой пары (кислота Льюиса). В качестве примера можно привести следующие реакции:
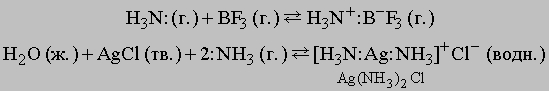
Окислительно-восстановительные реакции. Эти реакции сопровождаются переносом электронов между ионами, атомами или соединениями и могут быть представлены следующим образом:
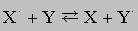
О соединении, которое отдает электроны, говорят, что оно окисляется; его называют восстановителем. Соединение, принимающее электроны, восстанавливается и является окислителем. Наиболее распространенные примеры окисления - реакции с участием элементного кислорода, например ржавление железа или горение любых горючих веществ. Уравнение горения магния имеет вид
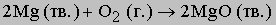
Примером окислительно-восстановительной реакции, протекающей без участия кислорода, является взаимодействие металлического натрия с газообразным хлором:
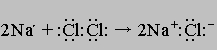
Этот способ написания уравнения показывает, что оба элемента по окончании реакции приобретают электронную конфигурацию инертного газа (на их внешних электронных оболочках - по 8 электронов). Направление этой реакции можно изменить на противоположное, приложив электрическое напряжение. Если пару электродов (графитовых стержней) погрузить в расплав хлорида натрия и соединить с источником постоянного тока, на отрицательном электроде произойдет реакция Na+ + e-> Na, а на положительном - 2Cl-> Cl2 + 2e- (здесь е- электрон). Этот процесс называют электролизом. (Устройство для проведения электролиза - электролитическая ячейка.)
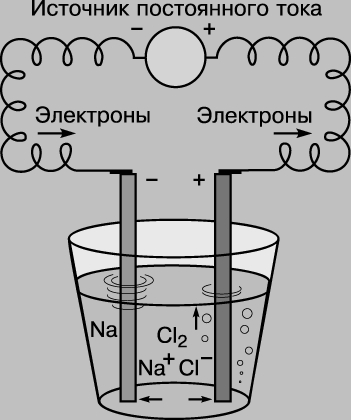
ЭЛЕКТРОЛИЗ РАСПЛАВА ХЛОРИДА НАТРИЯ, при котором ионы натрия Na+ собираются на катоде (отрицательном полюсе), а хлорид-ионы Cl- на аноде (положительном полюсе).
Процесс электролиза применяется для перезарядки свинцовых аккумуляторов и нанесения металлических покрытий (например, серебрение).
См. также
МЕТАЛЛОПОКРЫТИЯ. Окислительно-восстановительные реакции удобно представлять в виде суммы двух полуреакций, аналогичных тем, которые использовались для иллюстрации перемещения электронов между ионами натрия и хлора. Каждая полуреакция характеризуется электродным окислительно-восстановительным потенциалом, величиной которого определяется легкость передачи электронов. Этот потенциал зависит не только от природы соединения, но также от его концентрации, концентрации других веществ, вступающих в реакцию, и от температуры. Численные значения этих потенциалов обычно приводятся для конкретных условий: для растворенных веществ это эффективная концентрация 1 М; для газов - давление 1 атм (или парциальное давление 1 атм для каждого из газов, участвующих в реакции); для плохо растворимых твердых веществ и жидкостей - сами чистые твердые вещества и жидкости. В табл. 2 приведены значения стандартных потенциалов для некоторых распространенных полуреакций, представленных в виде реакций восстановления. Отметим, что для каждой полуреакции восстановленная форма вещества записывается в правой части уравнения, а окисленная - в левой. Паре ион водорода/газообразный водород приписан нулевой потенциал, потенциалы всех остальных пар измеряются по отношению к нему. Таким образом, пара с положительным потенциалом содержит лучший, чем ион водорода, окислитель, а пара, имеющая отрицательный потенциал, - лучший, чем газообразный водород, восстановитель. Величина окислительной или восстановительной способности вещества прямо пропорциональна стандартному потенциалу.
Таблицу 2 можно использовать для предсказания хода многих реакций. Нужно только помнить, что если полуреакцию записывают в противоположном направлении, чем это сделано в таблице, то ее потенциал следует брать с противоположным знаком. Обычно реакции идут до конца, если сумма потенциалов двух полуреакций (потенциал ячейки) положительна и превышает примерно 0,1 В. Если потенциал ячейки находится в интервале от +0,1 до -0,1 В, то между реагирующими веществами устанавливается равновесие, причем в реакционном объеме все они присутствуют в заметных количествах. Если же потенциал ячейки ниже -0,1 В, то реакция, по существу, не идет. Однако если полоску цинка погрузить в раствор, содержащий ион меди, будет протекать реакция
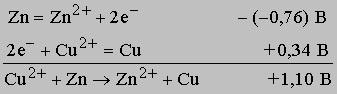
Поскольку потенциал представляет собой большую положительную величину, реакция идет до конца. Если же полоску меди поместить в раствор, содержащий ион цинка, то реакция Cu + Zn2+ -> Cu2+ + Zn не произойдет из-за высокого отрицательного потенциала ячейки (-1,10 В). Если смешать растворы, содержащие бихромат-ион и ион марганца(II), то между реагентами и продуктами установится равновесие, при этом оба иона и продукты реакции - оксид марганца(II) и ион хрома(III) - будут присутствовать в достаточно большой концентрации, поскольку потенциал этой реакции при стандартных условиях составляет лишь 0,1 В.
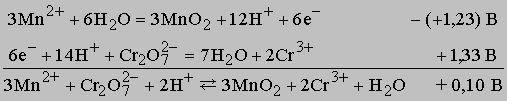
Отметим, что правая и левая части уравнения первой полуреакции умножены на три, чтобы получить число электронов, необходимое для второй полуреакции. Величина потенциала от этого не изменяется. В обеих частях суммарного уравнения должно быть одинаково не только число атомов каждого типа, но и суммарный электрический заряд (в данном случае он равен +6). В отличие от электролитической ячейки, во внешнюю цепь которой включен источник тока, гальванический элемент сам вырабатывает электричество. Гальваническими элементами являются, например, свинцовый автомобильный аккумулятор и батарейка для карманного фонарика. Напряжение, которое дает элемент, определяется потенциалами протекающих в нем полуреакций. Реакции с перераспределением обобществленных электронов. Приведем несколько примеров таких реакций:
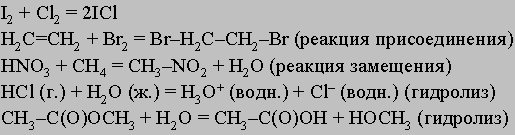
Более подробное обсуждение реакций с участием неорганических и органических соединений можно найти в статье
Иллюстрированный энциклопедический словарь
ХИМИЧЕСКИЕ РЕАКЦИИ, превращение одних веществ (реагентов) в другие (продукты), отличные по химическому составу и (или) строению; сопровождаются разрывом одних и образованием других химических связей. Протекают при смешении реагентов самопроизвольно, при участии катализаторов или при каком-либо энергетическом воздействии. Могут сопровождаться выделением тепла, испусканием света, изменением агрегатного состояния веществ и т.п. Изображаются с помощью химических уравнений, которые определяют количественные соотношения между реагентами и продуктами (стехиометрию реакции) и выражают закон сохранения массы. Направление, скорость и возможность осуществления химической реакции изучают методами химической кинетики и химической термодинамики. Химические реакции лежат в основе многих природных и технологических процессов.
Полезные сервисы
химические связи, формулы и уравнения
Энциклопедия Кольера
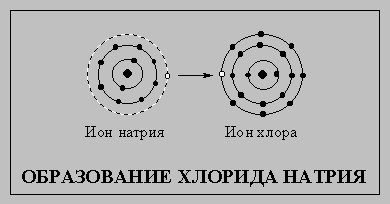
Элементы, не обладающие стабильной электронной конфигурацией инертных газов, стремятся приобрести ее, вступая в химические реакции. Атомы, которым до стабильной конфигурации не хватает незначительного числа электронов или, напротив, у которых имеется небольшой их избыток, обычно образуют электрически заряженные частицы - ионы. Положительно заряженные ионы (образующиеся при потере электронов) называют катионами, отрицательно заряженные ионы (образующиеся при приобретении электронов) - анионами. Заряд ионов редко превышает 3, т.е. атомы редко теряют или приобретают более трех электронов. Атом натрия (см. схему), соединяясь с атомом хлора, теряет один наружный электрон и превращается в катион, а атом хлора приобретает этот электрон и становится анионом. Их внешние электронные оболочки становятся заполненными и содержат по восемь электронов. Катион и анион притягиваются, образуя хлорид натрия.
Электроны внешней оболочки, участвующие в образовании химических связей, называют валентными. (Валентность элемента равна числу связей, которые он способен образовать.) Некоторые элементы и их валентные электроны перечислены в приведенной выше таблице. В ней также указаны атомные номера элементов и наиболее распространенные ионы. Элементы, имеющие одинаковую электронную конфигурацию внешних оболочек и обладающие сходными физическими и химическими свойствами, объединены в периодической системе элементов в группы от I до VIII, причем номер группы совпадает с числом валентных электронов. Периодическая система элементов помогает понять, чем объясняется сходство элементов, принадлежащих данной группе, и почему эти элементы все-таки отличаются друг от друга. Открытие периодического закона и публикация периодической системы русским химиком Д.И.Менделеевым в 1869 явились важнейшим этапом в систематизации свойств известных и предсказании еще неоткрытых химических элементов.
См. также ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ.
Ионная связь. Противоположно заряженные ионы притягиваются друг к другу и сближаются, но лишь до определенного предела. Когда расстояние между ионами становится слишком мало, их электронные облака начинают отталкиваться, и дальнейшее сближение становится невозможно. Таким образом, есть определенное расстояние, на котором ионная пара наиболее стабильна. Его называют длиной ионной связи. Пространственное расположение заряженных частиц в веществе, имеющем ионный характер состояния, строго упорядоченно. В качестве примера ионных соединений можно привести обычную поваренную соль NaCl, в которой ион натрия Na+ связан с ионом хлора Cl-, или хлорид кальция CaCl2 с соотношением между ионами кальция Са2+ и хлорид-ионами Cl- 1:2. Как NaCl, так и CaCl2 электрически нейтральны.
Ковалентная связь. Другой распространенный тип связи - ковалентная связь - возникает, когда два атома обобществляют одну (или более) пару электронов. При образовании ковалентной связи атомы удерживаются вместе электростатическим притяжением ядер к общей электронной паре, в отличие от ионной связи, в основе которой лежит электростатическое притяжение между самими ионами. Ковалентные связи обычно образуются в тех случаях, когда ядра атомов притягивают электроны примерно с одинаковой силой. Такая связь существует, например, в молекуле хлора (см. схему). Есть удобное правило для определения типа связи между атомами двух элементов: если один элемент находится в левой части периодической таблицы, а другой - в правой, то связь между ними будет ионной (см. элементы, перечисленные в приведенной выше таблице).

Если валентные электроны обозначить точками, то различие между двумя типами связи станет более наглядным:

Соединения типа LiF, BeO или BeF2 ионные. Соединения, молекулы которых состоят из элементов - соседей по периодической таблице, как правило, ковалентные (CO2, CF4, NO2, N2, O2, F2). Правда, некоторые металлы образуют как ионные, так и ковалентные соединения. Два атома могут иметь две или даже три общие электронные пары, образуя двойную или тройную связь:

Полярная связь. Между чисто ковалентной (Cl2) и чисто ионной (LiF) связями есть еще одна, промежуточная. Она образуется, когда разные атомы притягивают общую электронную пару с неодинаковой силой. Способность атома оттягивать на себя электроны, участвующие в образовании химической связи, называется электроотрицательностью. Между атомами с существенно разной электроотрицательностью образуется чисто ионная связь; по мере уменьшения различий в электроотрицательности связь приобретает ковалентную "компоненту" и, наконец, становится чисто ковалентной. Электроотрицательность атомов хлора в молекуле Cl2 одинакова, поэтому связь между ними ковалентная. Связь Н-О в молекуле воды имеет в некоторой степени ионный характер, поскольку кислород более электроотрицателен, чем водород, и оттягивает на себя электронную пару. Такие связи называют полярными, причем полярность связи возрастает по мере увеличения ее ионного характера.
Степень окисления. Полярность связи Н-О иллюстрирует концепцию окисления (полной или частичной отдачи электронов), весьма полезную для наглядной иллюстрации картины распределения обобществленных электронов для механизма некоторых химических реакций. Атом кислорода сильнее притягивает общую электронную пару, поэтому можно сказать, что он как бы приобретает один лишний электрон за счет атома водорода. Обычно атом кислорода образует две связи, как в молекуле Н2О, следовательно, притягивает к себе два электрона и обладает степенью окисления -2. Поскольку атом водорода как бы теряет один электрон, его степень окисления +1. Степень окисления кислорода отличается от -2 в соединениях, называемых пероксидами, например в пероксиде водорода Н2О2. Здесь каждый атом кислорода делит один электрон с другим атомом и принимает от атома водорода один электрон. Поэтому степень окисления кислорода в пероксиде водорода -1. Степень окисления отдельного атома или молекулы (Mg, Cl2, O2) равна нулю. В нейтральном соединении сумма степеней окисления всех атомов равна нулю, в заряженном - суммарному заряду. Эти правила позволяют вычислить степень окисления атома в каждом конкретном соединении. В молекуле SO2 два атома кислорода в сумме дают степень окисления -4, а поскольку суммарная степень окисления молекулы должна равняться нулю, то степень окисления S равна +4. В анионе SO42- степень окисления серы +6, а в H2S она равна -2. Более электроотрицательному элементу приписывают знак минус.
Формулы. Поскольку количества атомов в молекуле относятся между собой как небольшие целые числа, состав молекулы можно представить, используя символы химических элементов и цифры, показывающие число атомов каждого элемента. Так, молекула воды, которая состоит из двух атомов водорода и одного атома кислорода, имеет формулу Н2О; пероксид водорода, в молекуле которого по два атома каждого элемента, - Н2О2. Формула оксида углерода - СО, диоксида - СО2, поскольку в молекулах этих соединений содержатся соответственно один атом углерода и один атом кислорода или один атом углерода и два атома кислорода. Формула FeSO4 отвечает сульфату железа(II); в молекуле этого соединения по одному атому железа и серы и четыре атома кислорода. Совокупность атомов, образующих определенную группу, обычно характеризуют одним словом. Например, SO42- это сульфатная группа, она входит в состав таких соединений, как сульфат алюминия Al2(SO4)3 и сульфат железа(III) Fe2(SO4)3. Другой пример - нитратная группа NO3-, входящая в состав нитрата аммония NH4NO3.
Ионы изображают, добавляя к символу элемента или группы знак "+" или "-". Например, Na+ - это ион натрия, Cl- хлорид-ион, SO42- сульфат-ион, Fe2+ - ион железа(II), Fe3+ - ион железа(III). Последние два иона получены из атома железа удалением двух и трех электронов соответственно. Структурные формулы наглядно показывают, из каких атомов состоят молекулы и какими связями они соединены; общие электронные пары или ковалентные связи обозначают черточками. В качестве примера рассмотрим этиловый спирт. Его обычная химическая формула С2Н5ОН. Такую же формулу имеет другое соединение - диметиловый эфир, и различие между этими соединениями можно увидеть, только записав их структурные формулы:
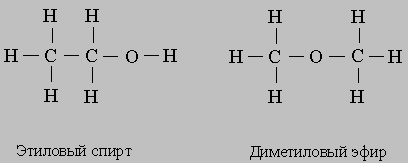
Конечно, такие формулы занимают больше места, чем обычные (CH3 -CH2 -OH и СН3 -О-СН3 или С2Н5ОН и СН3ОСН3). Поэтому в структурных формулах циклических соединений углерода химические символы часто опускают, изображая только кольцо из связей между атомами углерода. Ниже представлены полная структурная формула бензола (слева) и бензольное кольцо (справа):
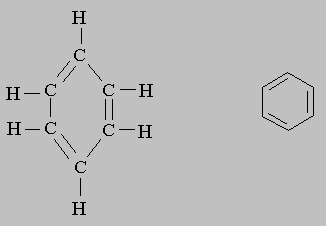
Уравнения. Химические реакции можно представить в виде уравнений; при этом химические формулы реагентов находятся в левой части, продуктов реакции - в правой, а между ними стоит знак равенства (=), однонаправленная ((r)) или двунаправленная (") стрелка или двойные стрелки ( или ). Знак равенства означает, что из данных веществ образуются другие, а двунаправленная стрелка или двойные стрелки указывают, что реакция может протекать в обоих направлениях и между реагентами и продуктами устанавливается динамическое равновесие. Одинарная стрелка иногда заменяет знак равенства, но чаще означает, что реакция идет только в одном направлении. Таким образом, уравнение 2Cl Cl2 говорит о том, что два атома хлора, соединяясь, образуют молекулу и реакция может протекать в обратном направлении. На эту реакцию, как и на многие другие, влияют условия, в которых ее проводят, например температура. В реакции 2Cl Cl2 молекула хлора образуется при комнатной температуре, а атомарный хлор - при более высокой. Иногда эти условия указывают над стрелкой. Так, вместо приведенной выше реакции можно записать:

Если реакционную смесь нагревают, то над стрелкой иногда ставят греческую букву дельта, D. Физическое состояние реагентов и продуктов реакции указывают буквами г., ж., тв., водн., что означает соответственно газ, жидкость, твердое тело, водный раствор. Таким образом, уравнение
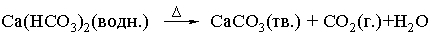
показывает, что при нагревании водного раствора бикарбоната кальция образуются твердый осадок карбоната кальция, газообразный диоксид углерода и вода (в виде паров или жидкости в зависимости от температуры).
См. также ХИМИЧЕСКИЕ УРАВНЕНИЯ. Сбалансированные уравнения. Реакцию между серной кислотой и гидроксидом натрия с образованием сульфата натрия и воды можно записать в виде NaOH + H2SO4 = H2O + Na2SO4. В действительности это уравнение не точное, поскольку число атомов одного и того же элемента в обоих частях равенства должно быть одинаковым, здесь же в левой части один атом натрия, а справа - два. Чтобы уравнять число атомов Na, перед NaOH нужно поставить коэффициент 2; аналогичным образом следует уравнять число атомов водорода и кислорода. В результате уравнение примет вид
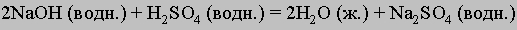
Подобные процедуры необходимо проводить до того, как уравнение будет использоваться для каких-либо вычислений.
Ионные уравнения. Многие вещества в растворе диссоциируют на ионы, которые могут вступать в химические реакции. В качестве примера рассмотрим приведенную выше реакцию между растворенными в воде гидроксидом натрия и серной кислотой. Реакция, записанная в ионной форме, будет иметь вид
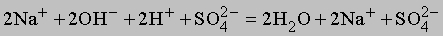
Ионизация воды здесь не показана. Отметим, что число ионов натрия и сульфат-ионов не изменяется, взаимодействуют только гидроксильные ионы и ионы водорода, поэтому суммарную реакцию можно записать в виде
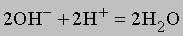
или еще проще
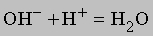
Массовые соотношения. Зная химическую формулу соединения и атомные массы, можно найти соотношения между массами элементов, входящих в состав соединения. Рассмотрим соединение Fe2O3 - оксид железа(III), обычную ржавчину. Найдем в периодической таблице атомные массы элементов и сложим их:
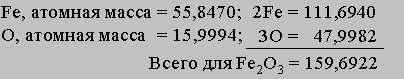
Доля железа в оксиде железа(III) составляет 111,6940/159,6922 = 0,6994, или 69,94%. 159,6922 - это мол. масса оксида железа(III).
См. также МОЛЕКУЛЯРНАЯ МАССА. Распространив этот принцип на химические уравнения, можно рассчитать, какое количество каждого из реагентов необходимо взять для того, чтобы по завершении реакции ни один из них не остался неизрасходованным, а также оценить, сколько разных продуктов образуется в ходе реакции. Так, в реакции окисления железа
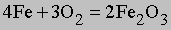
4*55,8470 = 223,3880 г железа взаимодействуют с 6Ч15,9994 = 95,9964 г кислорода, образуя 319,3844 г оксида железа(III). Зная количество железа, всегда можно рассчитать массу образовавшегося из него оксида.
Объемы газов и химические реакции. При постоянных давлении и температуре объемы реагирующих друг с другом газов, а также объемы газообразных продуктов реакции относятся как небольшие целые числа (закон Гей-Люссака). Эти отношения равны коэффициентам соответствующего химического уравнения. Рассмотрим, например, горение метана СН4, основного компонента природного газа. Как следует из уравнения реакции СН4 + 2О2 = СО2 + 2Н2О, для поддержания горения одного объема метана требуются два объема кислорода, а в результате образуются один объем диоксида углерода и два объема воды. Все объемы, конечно, приведены к одинаковым температуре и давлению.
Полезные сервисы
химические средства защиты растений
химические транспортные реакции
Энциклопедический словарь
Хими́ческие тра́нспортные реа́кции - обратимые химические реакции, сопровождающиеся переносом исходного твёрдого или жидкого вещества из одной температурной зоны в другую в результате образования и разложения промежуточных газообразных соединений. Применяют для очистки цветных, редких и рассеянных металлов, при получении полупроводников, монокристаллов, эпитаксиальных и монокристаллических плёнок и др.
* * *
ХИМИЧЕСКИЕ ТРАНСПОРТНЫЕ РЕАКЦИИ - ХИМИ́ЧЕСКИЕ ТРА́НСПОРТНЫЕ РЕА́КЦИИ, обратимые химические реакции, сопровождающиеся переносом исходного твердого или жидкого вещества из одной температурной зоны в другую в результате образования и разложения промежуточных газообразных соединений. Применяют для очистки цветных, редких и рассеянных металлов, при получении полупроводников, монокристаллов, эпитаксиальных и монокристаллических пленок и др.
Большой энциклопедический словарь
ХИМИЧЕСКИЕ ТРАНСПОРТНЫЕ РЕАКЦИИ - обратимые химические реакции, сопровождающиеся переносом исходного твердого или жидкого вещества из одной температурной зоны в другую в результате образования и разложения промежуточных газообразных соединений. Применяют для очистки цветных, редких и рассеянных металлов, при получении полупроводников, монокристаллов, эпитаксиальных и монокристаллических пленок и др.
Полезные сервисы
химические уравнения
Энциклопедический словарь
ХИМИЧЕСКИЕ УРАВНЕНИЯ - ХИМИ́ЧЕСКИЕ УРАВНЕ́НИЯ, см. Уравнения химические (см. УРАВНЕНИЯ ХИМИЧЕСКИЕ).
Большой энциклопедический словарь
ХИМИЧЕСКИЕ УРАВНЕНИЯ - см. Уравнения химические.
Полезные сервисы
химические формулы
Словарь иностранных слов
ХИМИЧЕСКИЕ ФОРМУЛЫ - условно принятые знаки для обозначения состава химических соединений. Элементы простых тел обозначаются первыми буквами латинского названия элемента (напр. O - oxygenium, кислород, H - hydrogenium, водород, Fe - ferrum, железо). Для изображения состава химических соединений формулами ставятся рядом знаки образующих их элементов (напр. CO - окись углерода или угарный газ).
Полезные сервисы
химические явления пищеварения
Практический толковый словарь
Они являются результатом последовательного действия различных желудочных соков на пищу.
слюна, желудочный сок, пепсин, лабфермент, слизистая оболочка желудка