Э́рбий (лат. Erbium), химический элемент III группы периодической системы, относится к лантаноидам. О названии см. Иттрий. Металл, плотность 9,062 г/см3, tпл 1522°C. Компонент магнитных сплавов с железом, кобальтом, никелем.
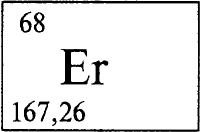
* * *
ЭРБИЙ - Э́РБИЙ (лат. Erbium), Er (читается «эрбий»), химический элемент с атомным номером 68, атомная масса 167,26. Является смесью шести стабильных нуклидов: 162Er (содержание в природной смеси 0,14% по массе), 164Er (1,61%), 166Er (33,6%), 167Er (22,95%), 168Er (26,8%) и 170Er (14,9%). Конфигурация трех внешних электронных слоев 4s2p6d10f125s2p66s 2. Образует соединения в степенях окисления +3 (валентность III) и, редко, +1 (валентность I). Лантаноид (см. ЛАНТАНОИДЫ). Расположен в группе IIIB в 6 периоде периодической системы.
Радиус нейтрального атома Er 0,175 нм, радиус иона Er 3+- 0,103 нм (координационное число 6) и 0,120 нм (координационное число 9). Энергии последовательной ионизации атома 6,10, 11,93, 22,74, 42,65 и 65,1 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,11.
История открытия
Впервые эрбий был выделен в 1843 шведским химиком К. Г. Мосандером (см. МОСАНДЕР Карл Густав) из минерала иттербита, найденного около селения Иттербю. Последующие исследования показали, что в выделенной из минерала «эрбиевой земле», кроме эрбия, содержались также тулий, гольмий (см. ГОЛЬМИЙ) и диспрозий (см. ДИСПРОЗИЙ) .
Нахождение в природе
Содержание Er в земной коре 3,3·10-3%. Входит в состав таких минералов, как ксенотим (см. КСЕНОТИМ), бастнезит (см. БАСТНЕЗИТ), монацит (см. МОНАЦИТ), эвксенит, лопарит. (см. ЛОПАРИТ)
Получение
При выделении концентрируется с тяжелыми лантаноидами. Дальнейшее разделение проводят методами ионной хроматографии (см. ХРОМАТОГРАФИЯ) или экстракции (см. ЭКСТРАКЦИЯ ЖИДКОСТНАЯ). Металлический эрбий получают электролизом расплава хлорида (фторида) эрбия ErCl3 (ErF3).
Физические и химические свойства
Эрбий - белый металл. Гексагональная решетка с параметрами а = 0,35588 нм и с = 0,55874 нм. Температура плавления 1522°C, температура кипения 2510°C, плотность 9,062 кг/дм3.
Устойчив на воздухе. При нагревании реагирует с кислородом (см. КИСЛОРОД), галогенами (см. ГАЛОГЕНЫ) и другими неметаллами. Оксид эрбия Er2O3 получают прокаливанием нитрата, сульфата, оксалата и других солей эрбия при температуре 800-1000°C. Обладает основными свойствами, ему отвечает основание Er(ОН)3 средней силы.
Эрбий взаимодействует с минеральными кислотами, образуя соли эрбия(III). Ионы Er3+ окрашивают раствор в розовый цвет. К растворимым в воде солям эрбия относятся хлорид, нитрат, ацетат и сульфат, плохо растворимым - оксалат, фторид, карбонат и фосфат.
При взаимодействии Er с тригалогенидами эрбия образуются соединения ErHal с кластерами Er7Hal10, Er6Hal7 и другими.
Применение
Применяют как активатор люминофоров, для изготовления магнитных материалов.