м.
см. галогены
галоге́н, галоге́ны, галоге́на, галоге́нов, галоге́ну, галоге́нам, галоге́ном, галоге́нами, галоге́не, галоге́нах
- Химический элемент, дающий соли при соединении с металлами.
- И фтор, и бром, и йод.
- Название этого химического понятия произошло с греческого «рождающий соль».
Галогенангидри́ды - производные кислот, в молекулах которых группы ОН замещены на атомы галогена. Примеры - сульфурилхлорид SO2Cl2 (галогенангидриды серной кислоты), ацетилхлорид CH3COCl (галогенангидриды уксусной кислоты). Галогенангидриды (обычно хлорангидриды) применяют в промышленности для ацилирования.
* * *
ГАЛОГЕНАНГИДРИДЫ - ГАЛОГЕНАНГИДРИ́ДЫ, производные кислот, в молекулах которых ОН-группы замещены на атомы галогена. Примеры - хлористый сульфурил SO2Cl2 (галогенангидрид серной кислоты), ацетилхлорид CH3COCl (галогенангидрид уксусной кислоты). Галогенангидриды (обычно хлорангидриды) применяют в промышленности для ацилирования.
ГАЛОГЕНАНГИДРИДЫ - производные кислот, в молекулах которых ОН-группы замещены на атомы галогена. Примеры - хлористый сульфурил SO2Cl2 (галогенангидрид серной кислоты), ацетилхлорид CH3COCl (галогенангидрид уксусной кислоты). Галогенангидриды (обычно хлорангидриды) применяют в промышленности для ацилирования.
Галогене́з (от греч. háls - соль и ...генез), совокупность процессов формирования отложений легкорастворимых солей путём испарения рассолов в поверхностных бассейнах аридной (засушливой) зоны. Различают карбонатный (содовый), сульфатный и хлоридный галогенезы, по генезису питающих вод - континентальный и морской.
* * *
ГАЛОГЕНЕЗ - ГАЛОГЕНЕ́З (от греч. hals - соль и «генез»), совокупность процессов формирования отложений легкорастворимых солей путем испарения рассолов (см. РАССОЛЫ) в поверхностных бассейнах аридной (засушливой) зоны. Различают карбонатный (содовый), сульфатный и хлоридный галогенез, по генезису питающих вод - континентальный и морской.
ГАЛОГЕНЕЗ (от греч. hals - соль и ...генез) - совокупность процессов формирования отложений легкорастворимых солей путем испарения рассолов в поверхностных бассейнах аридной (засушливой) зоны. Различают карбонатный (содовый), сульфатный и хлоридный галогенез, по генезису питающих вод - континентальный и морской.
- Совокупность процессов формирования отложений легкорастворимых солей путём испарения рассолов в поверхностных бассейнах аридной (засушливой) зоны.
Галогени́ды - химические соединения галогенов с другими элементами (фториды, хлориды, бромиды, иодиды).
* * *
ГАЛОГЕНИДЫ - ГАЛОГЕНИ́ДЫ, химические соединения галогенов с другими элементами (фториды (см. ФТОРИДЫ), хлориды (см. ХЛОРИДЫ), бромиды (см. БРОМИДЫ), иодиды (см. ИОДИДЫ) ).
ГАЛОГЕНИДЫ - химические соединения галогенов с другими элементами (фториды, хлориды, бромиды, иодиды).
галогени́ды
(гр. eidos вид) соединения галогенов с другими элементами (см. бромиды, йодиды, фториды, хлориды), встречаются в природе в виде минералов; имеют большое практическое значение.
Галогени́ды приро́дные - класс минералов, солеобразные соединения, производные галогеноводородных кислот HF, HCl, HBr и HI. Выделяют 2 подкласса: фториды (свыше 20 минеральных видов) и хлориды, бромиды, иодиды (свыше 30). Встречаются в основном в гидротермальных (фториды) и в соляных (хлориды и пр.) месторождениях, реже в зоне окисления сульфидных месторождений. Сырьё химической и металлургической промышленности.
* * *
ГАЛОГЕНИДЫ ПРИРОДНЫЕ - ГАЛОГЕНИ́ДЫ ПРИРО́ДНЫЕ, класс минералов, солеобразные соединения, производные галогеноводородных кислот HF, HCl, HBr и HI. Выделяют 2 подкласса: фториды (см. ФТОРИДЫ ПРИРОДНЫЕ) (св. 20 минеральных видов) и хлориды (см. ХЛОРИДЫ ПРИРОДНЫЕ), бромиды (см. БРОМИДЫ ПРИРОДНЫЕ), иодиды (см. ИОДИДЫ ПРИРОДНЫЕ) (св. 30). Встречаются в основном в гидротермальных (см. ГИДРОТЕРМАЛЬНЫЕ МЕСТОРОЖДЕНИЯ) (фториды) и в соляных (хлориды и пр.) месторождениях, реже в зоне окисления сульфидных месторождений. Сырье химической и металлургической промышленности.
ГАЛОГЕНИДЫ ПРИРОДНЫЕ - класс минералов, солеобразные соединения, производные галогеноводородных кислот HF, HCl, HBr и HI. Выделяют 2 подкласса: фториды (св. 20 минеральных видов) и хлориды, бромиды, иодиды (св. 30). Встречаются в основном в гидротермических (фториды) и в соляных (хлориды и пр.) месторождениях, реже в зоне окисления сульфидных месторождений. Сырье химической и металлургической промышленности.
Галогени́рование - органических соединений, введение в эти соединения атомов галогенов. Широко (особенно хлорирование и фторирование) применяется для получения растворителей, хладонов, полимеров, красителей и др.
* * *
ГАЛОГЕНИРОВАНИЕ - ГАЛОГЕНИ́РОВАНИЕ (галоидирование), введение галогена (см. ГАЛОГЕНЫ) в молекулу органических соединений. Механизм замещения или присоединения атома водорода на атом галогена в алифатическом (см. АЛИФАТИЧЕСКИЕ СОЕДИНЕНИЯ) ряду - свободно-радикальный. В ароматических соединениях (см. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ) замещение происходит по ионному, а присоединение - по электофильному или радикальному механизму. Замещение гидроксильной группы (-ОН) на атом галогена осуществляется под действием концентрированных галогенсодержащих кислот (HHal), а также PBr3, POCl3, SOCl2. Замена кислорода в карбонильной группе в результате взаимодействия с PCl5приводит к гемдигалогенидам. Галогенирование (особенно хлорирование (см. ХЛОРИРОВАНИЕ) и фторирование (см. ФТОРИРОВАНИЕ)) широко применяется для получения растворителей (см. РАСТВОРИТЕЛИ), хладонов (см. ХЛАДОНЫ), полимеров (см. ПОЛИМЕРЫ) и красителей.
ГАЛОГЕНИРОВАНИЕ органических соединений - введение в эти соединения атомов галогенов. Широко (особенно хлорирование и фторирование) применяется для получения растворителей, хладонов, полимеров, красителей и др.
Галоге́нная ла́мпа - лампа накаливания, в состав газовой смеси которой кроме инертного газа входят галогены (обычно иод или бром). При одинаковых с обычной лампой накаливания мощности и сроке службы имеет меньшие размеры, большую световую отдачу и лучшую стабильность светового потока.
* * *
ГАЛОГЕННАЯ ЛАМПА - ГАЛОГЕ́ННАЯ ЛА́МПА, лампа накаливания, в состав газовой смеси которой кроме инертного газа входят галогены (обычно иод или бром). При одинаковых с обычной лампой накаливания мощности и сроке службы имеет меньшие размеры, большую световую отдачу и лучшую стабильность светового потока.
ГАЛОГЕННАЯ ЛАМПА - лампа накаливания, в состав газовой смеси которой кроме инертного газа входят галогены (обычно иод или бром). При одинаковых с обычной лампой накаливания мощности и сроке службы имеет меньшие размеры, большую световую отдачу и лучшую стабильность светового потока.

Галогенные лампы.
ГАЛОГЕННАЯ ЛАМПА, лампа накаливания, в состав газовой смеси которой кроме инертного газа входят галогены (обычно бром или иод). По сравнению с обычными лампами обладают более высокой световой отдачей и длительным сроком службы. Широко применяются в прожекторах, автомобильных и самолетных фарах, кинопроекторах и др.
Галоге́нные поро́ды - хемогенные осадочные горные породы (каменная соль, гипс и др.), образующиеся путём кристаллизации из насыщенных растворов на дне усыхающих морских бассейнов, лагун и солёных озёр. Наиболее значительное накопление галогенных пород приурочено к отложениям пермской системы.
* * *
ГАЛОГЕННЫЕ ПОРОДЫ - ГАЛОГЕ́ННЫЕ ПОРО́ДЫ, хемогенные (см. ХЕМОГЕННЫЕ ПОРОДЫ) осадочные горные породы (каменная соль (см. КАМЕННАЯ СОЛЬ), гипс (см. ГИПС) и др.), образующиеся путем кристаллизации из насыщенных растворов на дне усыхающих морских бассейнов, лагун (см. ЛАГУНА) и соленых озер (см. СОЛЕНОЕ ОЗЕРО). Наиболее значительное накопление галогенных пород приурочено к отложениям пермской системы (см. ПЕРМСКАЯ СИСТЕМА (ПЕРИОД)) .
ГАЛОГЕННЫЕ ПОРОДЫ - хемогенные осадочные горные породы (каменная соль, гипс и др.), образующиеся путем кристаллизации из насыщенных растворов на дне усыхающих морских бассейнов, лагун и соленых озер. Наиболее значительное накопление галогенных пород приурочено к отложениям пермской системы.
прил.
1. соотн. с сущ. галоген, связанный с ним
2. Свойственный галогену, характерный для него.
3. Содержащий галоген.
галоге́нный, галоге́нная, галоге́нное, галоге́нные, галоге́нного, галоге́нной, галоге́нных, галоге́нному, галоге́нным, галоге́нную, галоге́нною, галоге́нными, галоге́нном, галоге́нен, галоге́нна, галоге́нно, галоге́нны, галоге́ннее, погалоге́ннее, галоге́нней, погалоге́нней
Галогеноводоро́ды - химические соединения галогенов с водородом (фторводород, хлороводород, бромоводород, иодоводород).
* * *
ГАЛОГЕНОВОДОРОДЫ - ГАЛОГЕНОВОДОРО́ДЫ, химические соединения галогенов с водородом (фтористый водород, хлористый водород, бромистый водород, иодистый водород).
ГАЛОГЕНОВОДОРОДЫ - химические соединения галогенов с водородом (фтористый водород, хлористый водород, бромистый водород, иодистый водород).
Галогенопроизво́дные углеводоро́дов (галогенсодержащие углеводороды), углеводороды, в молекулах которых один или несколько атомов водорода замещены на атомы галогена. Сырьё в промышленном органическом синтезе, растворители, хладоны.
* * *
ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ - ГАЛОГЕНОПРОИЗВО́ДНЫЕ УГЛЕВОДОРО́ДОВ (галогенсодержащие углеводороды), углеводороды, в молекулах которых один или несколько атомов водорода замещены на атомы галогена. Сырье в промышленном органическом синтезе, растворители, хладоны.
ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ (галогенсодержащие углеводороды) - углеводороды, в молекулах которых один или несколько атомов водорода замещены на атомы галогена. Сырье в промышленном органическом синтезе, растворители, хладоны.
мн.
Группа сходных по свойствам химических элементов (фтор, хлор, бром, йод и астат), образующих соли при соединении с металлами и широко используемые в практике.
ГАЛОГЕ́НЫ -ов; мн. (ед. галоге́н, -а; м.). [от греч. hals - соль и genesis - род, происхождение]. Группа химических элементов (фтор, хлор, бром, йод и др.), образующих соли при соединении с металлами.
◁ Галоге́нный, -ая, -ое. Г-ые соединения. Г-ая лампа (лампа накаливания, в состав газовой смеси которой кроме инертного газа входят галогены).
* * *
галоге́ны (устар. галоиды), химические элементы фтор F, хлор Cl, бром Br, иод I и астат At, составляющие главную подгруппу VII группы периодической системы химических элементов. Название от греч. háls - соль и ...genēs - рождающий (при соединении с металлами образуют соли). Молекулы галогенов двухатомны (F2, Cl2 и др.).
* * *
ГАЛОГЕНЫ - ГАЛОГЕ́НЫ (устар. выражение галоиды), химические элементы фтор (см. ФТОР) F, хлор (см. ХЛОР) Cl, бром (см. БРОМ) Br, иод (см. ИОД) I и астат (см. АСТАТ) At, составляющие главную подгруппу VII группы периодической системы Менделеева. Названы от греческих hals - соль и genes - рождающий (при соединении с металлами образуют соли). Молекулы галогенов двухатомны (F2, Cl2 и др.).
ГАЛОГЕНЫ (устар. выражение галоиды) - химические элементы фтор F, хлор Cl, бром Br, иод I и астат At, составляющие главную подгруппу VII группы периодической системы Менделеева. Названы от греческих hals - соль и genes - рождающий (при соединении с металлами образуют соли). Молекулы галогенов двухатомны (F2, Cl2 и др.).
-ов, мн. (ед. галоге́н, -а, м.).
Группа химических элементов (фтор, хлор, бром, йод и др.), дающих при соединении с металлами соли.
[От греч. ‛άλς, ‛αλός - соль и γένος - род, происхождение]
ПОДГРУППА VIIA. ГАЛОГЕНЫ
ФТОР, ХЛОР, БРОМ, ИОД, АСТАТ
Галогены и особенно фтор, хлор и бром имеют большое значение для промышленности и лабораторной практики как в свободном состоянии, так и в виде различных органических и неорганических соединений. Фтор бледножелтый высокореакционноспособный газ, вызывающий раздражение дыхательных путей и коррозию материалов. Хлор тоже едкий, химически агрессивный газ темного зеленовато-желтого цвета менее реакционноспособен по сравнению со фтором. Он широко используется в малых концентрациях для дезинфекции воды (хлорирование), а в больших концентрациях ядовит и вызывает сильное раздражение дыхательных путей (газообразный хлор применяли как химическое оружие в Первой мировой войне). Бром тяжелая красно-коричневая жидкость при обычных условиях, но легко испаряется, превращаясь в едкий газ. Иод темнофиолетовое твердое вещество, легко сублимирующееся. Астат радиоактивный элемент, единственный галоген, не имеющий стабильного изотопа.
В семействе этих элементов по сравнению с другими А-подгруппами наиболее выражены неметаллические свойства. Даже тяжелый иод типичный неметалл. Первый член семейства, фтор, проявляет "сверхнеметаллические" свойства. Все галогены акцепторы электронов, и у них сильно выражена тенденция к завершению октета электронов путем принятия одного электрона. Реакционная способность галогенов уменьшается с ростом атомного номера, и в целом свойства галогенов изменяются в соответствии с их положением в периодической таблице. В табл. 8а приведены некоторые физические свойства, позволяющие понять отличия и закономерность изменения свойств в ряду галогенов. Фтор проявляет во многом необычные свойства. Например, установлено, что сродство к электрону у фтора не так высоко, как у хлора, а это свойство должно указывать на способность принимать электрон, т.е. на химическую активность. Фтор же ввиду очень малого радиуса и близости валентной оболочки к ядру должен обладать наивысшим сродством к электрону. Это несоответствие, по крайней мере отчасти, объясняется необычно малой энергией связи FF по сравнению с этой величиной для ClCl (см. энтальпию диссоциации в табл. 8а). Для фтора она равна 159 кДж/моль, а для хлора 243 кДж/моль. Из-за малого ковалентного радиуса фтора близость неподеленных электронных пар в структуре :F:F: определяет легкость разрыва этой связи. Действительно, фтор химически более активен, чем хлор, благодаря легкости образования атомарного фтора. Величина энергии гидратации (см. табл. 8а) указывает на высокую реакционную способность фторид-иона: ион Fгидратируется с большим энергетическим эффектом, чем другие галогены. Маленький радиус и соответственно более высокая зарядовая плотность объясняют большую энергию гидратации. Многие необычные свойства фтора и фторид-иона становятся понятными при учете размера и заряда иона.
Получение. Большое промышленное значение галогенов предъявляет определенные требования к методам их производства. С учетом разнообразия и сложности методов получения существенное значение имеют расход и стоимость электроэнергии, сырья и потребности в побочных продуктах.
Фтор. Из-за химической агрессивности фторид- и хлорид-ионов эти элементы получают электролитическим путем. Фтор получают из флюорита: CaF2 при обработке серной кислотой образует HF (плавиковая кислота); из HF и KF синтезируют KHF2, который и подвергают электролитическому окислению в электролизере с раздельными анодным и катодным пространствами, со стальным катодом и угольным анодом; на аноде выделяется фтор F2, а на катоде побочный продукт водород, который следует изолировать от фтора во избежание взрыва. Для синтеза таких важных соединений, как полифторуглеводороды, в электролизере выделяющимся фтором фторируют органические соединения, благодаря чему не требуются изоляция и накапливание фтора в отдельных емкостях.
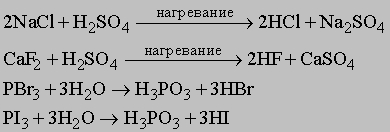
Хлор производят в основном из рассола NaCl в электролизерах с отделенным анодным пространством для предотвращения реакции хлора с другими продуктами электролиза: NaOH и H2; таким образом, в результате электролиза получается три важных промышленных продукта хлор, водород и щелочь. Для осуществления этого процесса используют различные модификации электролизеров. Хлор получается и как побочный продукт при электролитическом производстве магния из MgCl2. Большая часть хлора используется для синтеза HCl по реакции с природным газом, а HCl расходуется для получения MgCl2 из MgO. Хлор образуется и в металлургии натрия из NaCl, однако метод электролиза из рассола дешевле. В лабораториях промышленно развитых стран производят многие тысячи тонн хлора по реакции 4HCl + MnO2 = MnCl2 + 2H2O + Cl2.
Бром получают из скважин с рассолом, которые содержат больше бромид-ионов, чем морская вода, являющаяся вторым по значимости источником брома. Бромид-ион легче превращается в бром, чем фторид- и хлорид-ионы в аналогичных реакциях. Поэтому для получения брома используют, в частности, хлор в качестве окислителя, так как активность галогенов в группе убывает сверху вниз и каждый ранее стоящий галоген вытесняет последующий. В производстве брома рассолы или морскую воду предварительно подкисляют серной кислотой, а затем обрабатывают хлором по реакции
2Br+ Cl2 -> Br2 + 2Cl
Бром выделяют из раствора выпариванием или продувкой с последующим его поглощением разными реагентами в зависимости от дальнейшего применения. Например, при реакции с нагретым раствором карбоната натрия получают кристаллические NaBr и NaBrO3; при подкислении смеси кристаллов бром регенерируется, обеспечивая не прямой, но удобный метод накопления (хранения) этой коррозионно-активной с неприятным запахом ядовитой жидкости. Бром можно также поглощать раствором SO2, в котором образуется HBr. Из этого раствора бром легко выделить, пропуская хлор (например, с целью проведения реакции брома с этиленом C2H4 для получения дибромэтилена C2H4Br2, который используется как антидетонатор бензинов). Мировое производство брома составляет свыше 300 000 т/год.
Иод получают из золы морских водорослей, обрабатывая ее смесью MnO2 + H2SO4, и очищают возгонкой. Иодиды в значительных количествах содержатся в подземных буровых водах. Иод получают окислением иодид-иона (например, нитрит-ионом NO2или хлором). Иод можно также осаждать в виде AgI, из которого серебро регенерируют взаимодействием с железом, при этом образуется FeI2. Из FeI2 иод вытесняют хлором. Чилийская селитра, в которой содержится примесь NaIO3, перерабатывают для получения иода. Иодид-ион важный компонент пищи человека, так как он необходим для образования иодсодержащего гормона тироксина, контролирующего рост и другие функции организма.
Реакционная способность и соединения. Все галогены реагируют с металлами непосредственно, образуя соли, ионный характер которых зависит и от галогена, и от металла. Так, фториды металлов, особенно металлов подгрупп IA и IIA, являются ионными соединениями. Степень ионности связи убывает с увеличением атомной массы галогена и уменьшением реакционной способности металла. Галогениды с ионным типом связи кристаллизуются в трехмерных кристаллических решетках. Например, NaCl (столовая соль) имеет кубическую решетку. С увеличением ковалентности связи возрастает доля слоистых структур (как у CdCl2, CuCl2, CuBr2, PbCl2, PdCl2, FeCl2 и др.). В газообразном состоянии ковалентные галогениды часто образуют димеры, например Al2Cl6 (димер AlCl3). С неметаллами галогены образуют соединения с почти чисто ковалентной связью, например галогениды углерода, фосфора и серы (CCl4 и др.). Максимальные степени окисления неметаллы и металлы проявляют в реакциях со фтором, например SF6, PF5, CuF3, CoF3. Попытки получить иодиды аналогичного состава не удаются из-за большого атомного радиуса иода (стерический фактор) и из-за сильной тенденции элементов в высокой степени окисления к окислению Iдо I2. Кроме прямого синтеза галогениды можно получать и другими методами. Оксиды металлов в присутствии углерода реагируют с галогенами с образованием галогенидов (например, Cr2O3 превращается в CrCl3). Из CrCl3Ч6H2O дегидратацией нельзя получить CrCl3, а лишь основной хлорид (или гидроксохлорид). Галогениды получаются также при обработке оксидов парами HX, например:
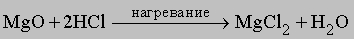
Хорошим хлорирующим агентом является CCl4, например для превращения BeO в BeCl2. Для фторирования хлоридов часто применяют SbF3 (см. выше SO2ClF).
Полигалогениды. Галогены реагируют со многими галогенидами металлов с образованием полигалогенидов соединений, содержащих крупные анионные частицы Xn1. Например:
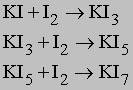
Первая реакция дает удобный метод получения высококонцентрированного раствора I2 путем добавления иода к концентрированному раствору KI. Полииодиды сохраняют свойства I2. Возможно также получение смешанных полигалогенидов: RbI + Br2 -> RbIBr2 RbIСl2 + Cl2 -> RbICl4
Растворимость. Галогены обладают некоторой растворимостью в воде, однако, как и следовало ожидать, из-за ковалентного характера связи XX и малого заряда растворимость их невелика. Фтор настолько активен, что оттягивает электронную пару от кислорода воды, при этом выделяется свободный O2 и образуются OF2 и HF. Хлор менее активен, но в реакции с водой получается некоторое количество HOCl и HCl. Гидраты хлора (например, Cl2*8H2O) могут быть выделены из раствора при охлаждении.
Иод проявляет необычные свойства при растворении в различных растворителях. При растворении небольших количеств иода в воде, спиртах, кетонах и других кислородсодержащих растворителях образуется раствор коричневого цвета (1%-ный раствор I2 в спирте обычный медицинский антисептик). Раствор иода в CCl4 или других бескислородных растворителях имеет фиолетовую окраску. Можно полагать, что в таком растворителе молекулы иода ведут себя подобно их состоянию в газовой фазе, которая имеет такую же окраску. В кислородсодержащих растворителях происходит оттягивание электронной пары кислорода на валентные орбитали иода.
Оксиды. Галогены образуют оксиды. Никакой систематической закономерности или периодичности в свойствах этих оксидов не наблюдается. Сходство и различия, а также основные способы получения оксидов галогенов указаны в табл. 8б.
Оксокислоты галогенов. При образовании оксокислот более четко проявляется систематичность галогенов. Галогены образуют галогеноватистые кислоты HOX, галогенистые кислоты HOXO, галогеноватые кислоты HOXO2 и галогеновые кислоты HOXO3, где X галоген. Но только хлор образует кислоты всех указанных составов, а фтор вообще не образует оксокислот, бром не образует HBrO4. Составы кислот и основные способы их получения указаны в табл. 8в.
Все кислоты галогенов неустойчивы, однако чистая HOClO3 наиболее стабильна (в отсутствие любых восстановителей). Все оксокислоты являются сильными окислителями, но скорость окисления необязательно зависит от степени окисления галогена. Так, HOCl (ClI) быстрый и эффективный окислитель, а разбавленная HOClO3 (ClVII) нет. В целом, чем выше степень окисления галогена в оксокислоте, тем сильнее кислота, поэтому HClO4 (ClVII) наиболее сильная из известных оксокислот в водном растворе. Ион ClO4, образующийся при диссоциации кислоты в воде, наиболее слабый из отрицательных ионов донор электронной пары. Гипохлориты Na и Ca находят промышленное применение при отбеливании и водоочистке. Межгалогенные соединения соединения различных галогенов друг с другом. Галоген с большим радиусом всегда имеет в таком соединении положительную степень окисления (подвергается окислению), а с меньшим радиусом более отрицательную (подвергается восстановлению). Этот факт вытекает из общей тенденции изменения активности в ряду галогенов. В табл. 8г приведены составы известных межгалогенных соединений (А галоген с более положительной степенью окисления).
Межгалогенные соединения образуются прямым синтезом из элементов. Необычная для иода степень окисления 7 реализуется в соединении IF7, а другие галогены не могут координировать 7 атомов фтора. Прикладное значение имеют BrF3 и ClF3 жидкие вещества, химически аналогичные фтору, но более удобные при фторировании. При этом более эффективен BrF3. Поскольку трифториды сильные окислители и находятся в жидком состоянии, их используют как окислители ракетного топлива.
Водородные соединения. Галогены реагируют с водородом, образуя HX, причем со фтором и хлором реакция протекает со взрывом при небольшой активации ее. Медленнее идет взаимодействие c Br2 и I2. Для протекания реакции с водородом достаточно активировать небольшую долю реагентов с помощью освещения или нагревания. Активированные частицы взаимодействуют с неактивированными, образуя HX и новые активированные частицы, которые продолжают процесс, а реакция двух активированных частиц по главной реакции заканчивается образованием продукта. Например, образование HCl из H2 и Cl2:

Более удобные методы получения галоиодоводородов, чем прямой синтез, дают, например, следующие реакции:
В газообразном состоянии HX являются ковалентными соединениями, однако в водном растворе они (за исключением HF) становятся сильными кислотами. Объясняется это тем, что молекулы воды эффективно оттягивают водород от галогена. Все кислоты хорошо растворимы в воде благодаря гидратации: HX + H2O -> H3O+ + X
HF более склонен к комплексообразованию, чем другие галогеноводороды. Заряды на H и F так велики, а эти атомы так малы, что происходит образование HX-ассоциатов типа полимеров состава (HF)x, где x і 3. В таком растворе диссоциация под действием молекулы воды идет не более чем на несколько процентов от общего количества ионов водорода. В отличие от других галогеноводородов фтороводород активно реагирует с SiO2 и силикатами, выделяя газообразный SiF4. Поэтому водный раствор HF (плавиковая кислота) используют в травлении стекла и хранят не в стеклянной, а в парафиновой или полиэтиленовой посуде. Чистый HF кипит чуть ниже комнатной температуры (19,52° С), поэтому его хранят в виде жидкости в стальных цилиндрах. Водный раствор HCl называют соляной кислотой. Насыщенный раствор, содержащий 36% (масс.) HCl, широко используют в химической промышленности и лабораториях (см. также ВОДОРОД).
Астат. Этот химический элемент семейства галогенов имеет символ At и атомный номер 85, он существует только в следовых количествах в некоторых минералах. Еще в 1869 Д.И.Менделеев предсказал его существование и возможность открытия в будущем. Астат был открыт Д.Корсоном, К.Маккензи и Э.Сегре в 1940. Известно более 20 изотопов, из которых наиболее долгоживущие 210At и 211At. По некоторым данным, при бомбардировке 20983Bi ядрами гелия образуется изотоп астат-211; сообщалось, что астат растворим в ковалентных растворителях, может образовывать At, как и другие галогены, и, вероятно, возможно получение иона AtO4. (Эти данные удалось получить на растворах с концентрацией 1010 моль/л.)