м.
Химический элемент, удушливый газ зелёного цвета, употребляющийся в технике, санитарии и т.п. как отравляющее или обеззараживающее средство.
м.
Химический элемент, удушливый газ зелёного цвета, употребляющийся в технике, санитарии и т.п. как отравляющее или обеззараживающее средство.
ХЛОР, хлора, мн. нет, муж. (от греч. chloros - зеленый) (хим.). Химический элемент, удушливый газ, употр. в технике, в санитарии как обеззараживающее и в военном деле как отравляющее вещество.
ХЛОР, -а, муж. Химический элемент, газ жёлто-зелёного цвета с резким запахом.
| прил. хлористый, -ая, -ое и хлорный, -ая, -ое. Хлористый кальций. Хлористый аммоний. Хлорная известь (зернистый белый порошок, употр. в технике и санитарии).
ХЛОР - муж., греч. одно из химических начал, основ, в поваренной соли. Хлоральгидрат, получается при действии хлора на безводный спирт, кристаллизованное вешество; употр. как усыпляющее средство (Наумов). Хлоровый газ. Хлорные соли. - кислота, высшая, четвертая степень окисленья. Хлористая кислота, вторая степень; хлорноватая, первая. Хлороводородный и хлористоводородный, состоящий из хлора и водорода. Хлорит, зеленоватое ископаемое, частью похожее на слюду. Хлоритовый сланец. Хлорофан муж. ископаемое, видоизмененье плавика. Хлороформ, жидкость, добываемая действием хлориновой извести на спирту (Наумов).
ХЛОР, -а, м
Химический элемент, удушливый газ желто-зеленого цвета с резким запахом (используется в производстве для синтеза неорганических и органических продуктов, для обеззараживания воды, отбелки тканей и целлюлозы), как отравляющее средство.
Обеззараживание воды хлором (хлорирование) на насосных станциях практически уничтожает микроорганизмы, содержащиеся в заборных питьевых водоемах.
ХЛОР -а; м. [от греч. chlōros - бледно-зелёный] Химический элемент (Cl), удушливый газ зеленовато-жёлтого цвета с резким запахом (используется как отравляющее и обеззараживающее средство). Соединения хлора. Отравление хлором.
◁ Хло́рный (см.).
* * *
хлор (лат. Chlorum), химический элемент VII группы периодической системы, относится к галогенам. Название от греческого chlōros - жёлто-зелёный. Свободный хлор состоит из двухатомных молекул (Cl2); газ жёлто-зелёного цвета с резким запахом; плотность 3,214 г/л; tпл -101°C; tкип -33,97°C; при обычной температуре легко сжижается под давлением 0,6 МПа. Химически очень активен (окислитель). Главные минералы - галит (каменная соль), сильвин, бишофит; морская вода содержит хлориды натрия, калия, магния и других элементов. Применяют в производстве хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%), для отбеливания целлюлозы и тканей (5-15%), для санитарных нужд и обеззараживания (хлорирования) воды. Токсичен.
* * *
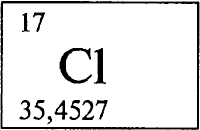
ХЛОР - ХЛОР (лат. Сhlorum), Cl (читается «хлор»), химический элемент с атомным номером 17, атомная масса 35,453. В свободном виде - желто-зеленый тяжелый газ с резким удушливым запахом (отсюда название: греч. chloros - желто-зеленый).
Природный хлор представляет смесь двух нуклидов (см. НУКЛИД) с массовыми числами 35 (в смеси 75,77% по массе) и 37 (24,23%). Конфигурация внешнего электронного слоя 3s2p5. В соединениях проявляет главным образом степени окисления -1, +1, +3, +5 и +7 (валентности I, III, V и VII). Расположен в третьем периоде в группе VIIА периодической системы элементов Менделеева, относится к галогенам (см. ГАЛОГЕНЫ).
Радиус нейтрального атома хлора 0,099 нм, ионные радиусы равны, соответственно (в скобках указаны значения координационного числа): Cl- 0,167 нм (6), Cl5+ 0,026 нм (3) и Clr7+ 0,022 нм (3) и 0,041 нм (6). Энергии последовательной ионизации нейтрального атома хлора равны, соответственно, 12,97, 23,80, 35,9, 53,5, 67,8, 96,7 и 114,3 эВ. Сродство к электрону 3,614 эВ. По шкале Полинга электроотрицательность хлора 3,16.
История открытия
Важнейшее химическое соединение хлора - поваренная соль (химическая формула NaCl, химическое название хлорид натрия) - было известно человеку с древнейших времен. Имеются свидетельства того, что добыча поваренной соли осуществлялась еще 3-4 тысячи лет до нашей эры в Ливии. Возможно, что, используя поваренную соль для различных манипуляций, алхимики сталкивались и с газообразным хлором. Для растворения «царя металлов» - золота - они использовали «царскую водку» - смесь соляной и азотной кислот, при взаимодействии которых выделяется хлор.
Впервые газ хлор получил и подробно описал шведский химик К. Шееле (см. ШЕЕЛЕ Карл Вильгельм) в 1774 году. Он нагревал соляную кислоту с минералом пиролюзитом (см. ПИРОЛЮЗИТ) MnO2 и наблюдал выделение желто-зеленого газа с резким запахом. Так как в те времена господствовала теория флогистона (см. ФЛОГИСТОН), новый газ Шееле рассматривал как «дефлогистонированную соляную кислоту», т. е. как окись (оксид) соляной кислоты. А.Лавуазье (см. ЛАВУАЗЬЕ Антуан Лоран) рассматривал газ как оксид элемента «мурия» (соляную кислоту называли муриевой, от лат. muria - рассол). Такую же точку зрения сначала разделял английский ученый Г. Дэви (см. ДЭВИ Гемфри), который потратил много времени на то, чтобы разложить «окись мурия» на простые вещества. Это ему не удалось, и к 1811 году Дэви пришел к выводу, что данный газ - это простое вещество, и ему отвечает химический элемент. Дэви первым предложил в соответствие с желто-зеленой окраской газа назвать его chlorine (хлорин). Название «хлор» элементу дал в 1812 французский химик Ж. Л. Гей-Люссак (см. ГЕЙ-ЛЮССАК Жозеф Луи); оно принято во всех странах, кроме Великобритании и США, где сохранилось название, введенное Дэви. Высказывалось мнение о том, что данный элемент следует назвать «галоген» (т. е. рождающий соли), но оно со временем стало общим названием всех элементов группы VIIA.
Нахождение в природе
Содержание хлора в земной коре составляет 0,013% по массе, в заметной концентрации он в виде иона Cl- присутствует в морской воде (в среднем около 18,8 г/л). Химически хлор высоко активен и поэтому в свободном виде в природе не встречается. Он входит в состав таких минералов, образующих большие залежи, как поваренная, или каменная, соль (галит (см. ГАЛИТ)) NaCl, карналлит (см. КАРНАЛЛИТ) KCl·MgCl2·6H21O, сильвин (см. СИЛЬВИН) КСl, сильвинит (Na, K)Cl, каинит (см. КАИНИТ) КСl·MgSO4·3Н2О, бишофит (см. БИШОФИТ) MgCl2·6H2O и многих других. Хлор можно обнаружить в самых разных породах, в почве.
Получение
Для получения газообразного хлора используют электролиз крепкого водного раствора NaCl (иногда используют KCl). Электролиз проводят с использованием катионообменной мембраны, разделяющей катодное и анодное пространства. При этом за счет процесса
2NaCl + 2H2O = 2NaOH + H2 + Cl2
получают сразу три ценных химических продукта: на аноде - хлор, на катоде - водород (см. ВОДОРОД) , и в электролизере накапливается щелочь (1,13 тонны NaOH на каждую тонну полученного хлора). Производство хлора электролизом требует больших затрат электроэнергии: на получение1 т хлора расходуется от 2,3 до 3,7 МВт.
Для получения хлора в лаборатории используют реакцию концентрированной соляной кислоты с каким-либо сильным окислителем (перманганатом калия KMnO4, дихроматом калия K2Cr2O7, хлоратом калия KClO3, хлорной известью CaClOCl, оксидом марганца (IV) MnO2). Наиболее удобно использовать для этих целей перманганат калия: в этом случае реакция протекает без нагревания:
2KMnO4 + 16HCl = 2KСl + 2MnCl2+ 5Cl2+ 8H2O.
При необходимости хлор в сжиженном (под давлением) виде транспортируют в железнодорожных цистернах или в стальных баллонах. Баллоны с хлором имеют специальную маркировку, но даже при ее отсутствии хлорный баллон легко отличить от баллонов с другими неядовитыми газами. Дно хлорных баллонов имеет форму полушария, и баллон с жидким хлором невозможно без опоры поставить вертикально.
Физические и химические свойства
При обычных условиях хлор - желто-зеленый газ, плотность газа при 25°C 3,214 г/дм3 (примерно в 2,5 раза больше плотности воздуха). Температура плавления твердого хлора -100,98°C, температура кипения -33,97°C. Стандартный электродный потенциал Сl2/Сl- в водном растворе равен +1,3583 В.
В свободном состоянии существует в виде двухатомных молекул Сl2. Межъядерное расстояние в этой молекуле 0,1987 нм. Сродство к электрону молекулы Сl2 2,45 эВ, потенциал ионизации 11,48 эВ. Энергия диссоциации молекул Сl2 на атомы сравнительно невелика и составляет 239,23 кДж/моль.
Хлор немного растворим в воде. При температуре 0°C растворимость составляет 1,44 масс.%, при 20°C - 0,711°C масс.%, при 60°C - 0,323 масс. %. Раствор хлора в воде называют хлорной водой. В хлорной воде устанавливается равновесие:
Сl2 + H2O H+ = Сl- + HOСl.
Для того, чтобы сместить это равновесие влево, т. е. понизить растворимость хлора в воде, в воду следует добавить или хлорид натрия NaCl, или какую-либо нелетучую сильную кислоту (например, серную).
Хлор хорошо растворим во многих неполярных жидкостях. Жидкий хлор сам служит растворителем таких веществ, как ВСl3, SiCl4, TiCl4.
Из-за низкой энергии диссоциации молекул Сl2 на атомы и высокого сродства атома хлора к электрону химически хлор высоко активен. Он вступает в непосредственное взаимодействие с большинством металлов (в том числе, например, с золотом) и многими неметаллами. Так, без нагревания хлор реагирует с щелочными (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ) и щелочноземельными металлами (см. ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ), с сурьмой:
2Sb + 3Cl2 = 2SbCl3
При нагревании хлор реагирует с алюминием:
3Сl2 + 2Аl = 2А1Сl3
и железом:
2Fe + 3Cl2 = 2FeCl3.
С водородом H2 хлор реагирует или при поджигании (хлор спокойно горит в атмосфере водорода), или при облучении смеси хлора и водорода ультрафиолетовым светом. При этом возникает газ хлороводород НСl:
Н2 + Сl2 = 2НСl.
Раствор хлороводорода в воде называют соляной (см. СОЛЯНАЯ КИСЛОТА) (хлороводородной) кислотой. Максимальная массовая концентрация соляной кислоты около 38%. Соли соляной кислоты - хлориды (см. ХЛОРИДЫ) , например, хлорид аммония NH4Cl, хлорид кальция СаСl2, хлорид бария ВаСl2 и другие. Многие хлориды хорошо растворимы в воде. Практически нерастворим в воде и в кислых водных растворах хлорид серебра AgCl. Качественная реакция на присутствие хлорид-ионов в растворе - образование с ионами Ag+ белого осадка AgСl, практически нерастворимого в азотнокислой среде:
СаСl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl.
При комнатной температуре хлор реагирует с серой (образуется так называемая однохлористая сера S2Cl2) и фтором (образуются соединения ClF и СlF3). При нагревании хлор взаимодействует с фосфором (образуются, в зависимости от условий проведения реакции, соединения РСl3 или РСl5), мышьяком, бором и другими неметаллами. Непосредственно хлор не реагирует с кислородом, азотом, углеродом (многочисленные соединения хлора с этими элементами получают косвенными путями) и инертными газами (в последнее время ученые нашли способы активирования подобных реакций и их осуществления «напрямую»). С другими галогенами хлор образует межгалогенные соединения, например, очень сильные окислители - фториды ClF, ClF3, ClF5 . Окислительная способность хлора выше, чем брома, поэтому хлор вытесняет бромид-ион из растворов бромидов, например:
Cl2 + 2NaBr = Br2 + 2NaCl
Хлор вступает в реакции замещения со многими органическими соединениями, например, с метаном СН4 и бензолом С6Н6:
СН4+ Сl2 = СН3Сl + НСl или С6Н6 + Сl2 = С6Н5Сl + НСl.
Молекула хлора способна присоединятся по кратным связям (двойным и тройным) к органическим соединениям, например, к этилену С2Н4:
С2Н4 + Сl2 = СН2СlСН2Сl.
Хлор вступает во взаимодействие с водными растворами щелочей. Если реакция протекает при комнатной температуре, то образуются хлорид (например, хлорид калия КCl) и гипохлорит (см. ГИПОХЛОРИТЫ) (например, гипохлорит калия КClО):
Cl2 + 2КОН = КClО + КСl +Н2О.
При взаимодействии хлора с горячим (температура около 70-80°C) раствором щелочи образуется соответствующий хлорид и хлорат (см. ХЛОРАТЫ) , например:
3Сl2+ 6КОН= 5КСl + КСlО3+ 3Н2О.
При взаимодействии хлора с влажной кашицей из гидроксида кальция Са(ОН)2 образуется хлорная известь (см. ХЛОРНАЯ ИЗВЕСТЬ) («хлорка») СаСlОСl.
Степени окисления хлора +1 отвечает слабая малоустойчивая хлорноватистая кислота (см. ХЛОРНОВАТИСТАЯ КИСЛОТА) НСlО. Ее соли - гипохлориты, например, NaClO - гипохлорит натрия. Гипохлориты - сильнейшие окислители, широко используются как отбеливающие и дезинфицирующие агенты. При взаимодействии гипохлоритов, в частности, хлорной извести, с углекислым газом СО2 образуется среди других продуктов летучая хлорноватистая кислота (см. ХЛОРНОВАТИСТАЯ КИСЛОТА) , которая может разлагаться с выделением оксида хлора (I) Сl2О:
2НСlО = Сl2О + Н2О.
Именно запах этого газа Сl2О - характерный запах «хлорки».
Степени окисления хлора +3 отвечает малоустойчивая кислота средней силы НСlО2. Эту кислоту называют хлористой, ее соли - хлориты (см. ХЛОРИТЫ (соли)) , например, NaClO2 - хлорит натрия.
Степени окисления хлора +4 соответствует только одно соединение - диоксид хлора СlО2.
Степени окисления хлора +5 отвечает сильная, устойчивая только в водных растворах при концентрации ниже 40%, хлорноватая кислота (см. ХЛОРНОВАТИСТАЯ КИСЛОТА) НСlО3. Ее соли - хлораты, например, хлорат калия КСlО3.
Степени окисления хлора +6 соответствует только одно соединение - триоксид хлора СlО3 (существует в виде димера Сl2О6).
Степени окисления хлора +7 отвечает очень сильная и довольно устойчивая хлорная кислота (см. ХЛОРНАЯ КИСЛОТА) НСlО4. Ее соли - перхлораты (см. ПЕРХЛОРАТЫ) , например, перхлорат аммония NH4ClO4 или перхлорат калия КСlО4. Следует отметить, что перхлораты тяжелых щелочных металлов - калия, и особенно рубидия и цезия мало растворимы в воде. Оксид, соответствующий степени окисления хлора +7 - Сl2О7.
Среди соединений, содержащих хлор в положительных степенях окисления, наиболее сильными окислительными свойствами обладают гипохлориты. Для перхлоратов окислительные свойства нехарактерны.
Применение
Хлор - один из важнейших продуктов химической промышленности. Его мировое производство составляет десятки миллионов тонн в год. Хлор используют для получения дезинфицирующих и отбеливающих средств (гипохлорита натрия, хлорной извести и других), соляной кислоты, хлоридов многих металлов и неметаллов, многих пластмасс (поливинилхлорида (см. ПОЛИВИНИЛХЛОРИД) и других), хлорсодержащих растворителей (дихлорэтана СН2СlСН2Сl, четыреххлористого углерода ССl4 и др.), для вскрытия руд, разделения и очистки металлов и т.д. Хлор применяют для обеззараживания воды (хлорирования (см. ХЛОРИРОВАНИЕ) ) и для многих других целей.
Биологическая роль
Хлор относится к важнейшим биогенным элементам (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ) и входит в состав всех живых организмов. Некоторые растения, так называемые галофиты, не только способны расти на сильно засоленных почвах, но и накапливают в больших количествах хлориды. Известны микроорганизмы (галобактерии и др.) и животные, обитающие в условиях высокой солености среды. Хлор - один из основных элементов водно-солевого обмена животных и человека, определяющих физико-химические процессы в тканях организма. Он участвует в поддержании кислотно-щелочного равновесия в тканях, осморегуляции (см. ОСМОРЕГУЛЯЦИЯ) (хлор - основное осмотически активное вещество крови, лимфы и др. жидкостей тела), находясь, в основном, вне клеток. У растений хлор принимает участие в окислительных реакциях и фотосинтезе.
Мышечная ткань человека содержит 0,20-0,52% хлора, костная - 0,09%; в крови - 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Особенности работы с хлором
Хлор - ядовитый удушливый газ, при попадании в легкие вызывает ожог легочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л. Хлор был одним из первых химических отравляющих веществ (см. ОТРАВЛЯЮЩИЕ ВЕЩЕСТВА) , использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3. ПДК хлора в воздухе рабочих помещений 1 мг/м3, в воздухе населенных пунктов 0,03 мг/м3.
ХЛОР (лат. Chlorum) - Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453, относится к галогенам. Название от греч. chloros - желто-зеленый. Газ желто-зеленого цвета с резким запахом; плотность 3,214 г/л; tпл ?101 .С; tкип ?33,97 .С; при обычной температуре легко сжижается под давлением 0,6 МПа. Химически очень активен (окислитель). Главные минералы - галит (каменная соль), сильвин, бишофит; морская вода содержит хлориды натрия, калия, магния и др. элементов. Применяют в производстве хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%), для отбелки целлюлозы и тканей (5-15%), для санитарных нужд и обеззараживания (хлорирования) воды. Токсичен.
-а, м.
Химический элемент, удушливый газ зеленовато-желтого цвета с резким запахом (используется в производстве для синтеза неорганических и органических продуктов, а также для обеззараживания воды, отбелки тканей и целлюлозы).
[От греч. χλωρός - зеленый]
Cl (chlorum),
химический элемент VII группы периодической системы элементов, член семейства галогенов (F, Cl, Br, I, At). Газообразный хлор выделил К.Шееле в 1774 по реакции соляной (хлороводородной) кислоты с пиролюзитом (MnO2), но не установил, что этот газ - именно элемент хлор. В 1785 К.Бертолле считал хлор кислородным соединением муриевого радикала, т.е., в современных терминах, оксосоляной кислотой. В 1808 Ж.Гей-Люссак, проведя синтез хлороводородной кислоты из 1 объема хлора и 1 объема водорода, сделал вывод, что хлор не содержит кислорода, и тем самым открыл поле для исследований Х.Дэви, который установил элементную природу хлора.
Распространенность в природе. В свободном виде хлор в природе не встречается, но существует множество природных хлорсодержащих соединений. Основным источником хлора является морская вода, содержащая хлорид натрия. Наиболее важные минералы хлора - это галит (или каменная соль) NaCl и хлораргирит AgCl.
Применение. Под давлением хлор превращается в жидкость, которую широко используют как отбеливатель, в частности в текстильной и бумажной промышленности, начиная с 1795. Хлор - слишком сильный окислитель для отбеливания шелка и шерсти, но эффективен для отбеливания хлопка, льна и древесной массы. Другое важное применение жидкого хлора - для очистки воды - впервые предпринято в 1895 для целей городского водоснабжения Нью-Йорка. Соединения хлора находят разнообразное применение. Хлороформ CHCl3 и хлорэтил C2H5Cl являются анестетиками, трихлорэтаналь (или хлораль) CCl3CHO применяют в медицине как наркотик, тетрахлорид углерода CCl4 используется для тушения огня, для сухой чистки, как и трихлорэтилен С2HCl3. Три хлорпроизводных - фосген COCl2 (удушающий газ), иприт (C2H4Cl)2S - кожнонарывная жидкость, хлорпикрин CCl3NO2 (слезоточивый газ) - являются боевыми отравляющими веществами. Фреон CF2Cl2 используется как хладагент в холодильной технике. Хлор применяют в производстве красок, резин, синтетического каучука, углеводородов, взрывчатых веществ и в химических синтезах. Хлор используют также для отбеливания губок и соломы.
Получение. Лабораторный метод получения хлора заключается в медленном прикапывании концентрированной соляной кислоты HCl через капельную воронку к KMnO4 или MnO2:
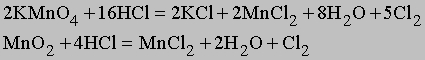
Жидкий хлор был получен М. Фарадеем в 1823 при нагревании гидрата хлора Cl2*8H2O, помещенного в один конец трубки. В результате конденсации в другом конце трубки, охлаждаемом смесью соли со льдом, собирался жидкий хлор. В промышленности хлор получают электролизом рассолов или расплавов NaCl в электролизерах с отделенным асбестовой диафрагмой анодным пространством, при этом хлор выделяется на аноде, а водород - на катоде.
Свойства. Хлор в нормальных условиях представляет собой желтовато-зеленый газ с неприятным запахом, раздражающе действующий на слизистые носа и горла. СВОЙСТВА ХЛОРА
Атомный номер 17 Атомная масса 35,453 Изотопы
стабильные 35, 37
нестабильные 33, 34, 36, 38, 39
Температура плавления, ° С -100,98 Температура кипения, ° С -34,6 Температура критическая, ° С 144 Давление критическое, атм 76,1 Содержание в земной коре, % (масс.) 0,314 Степени окисления -1, +1, +3, +4, +5, +7 Хлор непосредственно реагирует со всеми химическими элементами, кроме C, N, O и благородных газов, образуя хлориды. В смеси хлора с водородом на свету реакция протекает очень быстро, а при интенсивном освещении и отсутствии примесей возможен взрывной механизм реакции. Эта реакция, которую независимо друг от друга изучали Дж. Драйпер и Р. Бунзен в 1848, является одной из первых изученных фотохимических реакций. В среде хлора прекрасно сгорает сурьма, а также натрий и медная фольга, нагретые до красного каления. Хлор окисляет C, I, Br и S в их соединениях. При пропускании Cl2 через раствор иода выделяется свободный иод. Смоченный скипидаром хлопок вспыхивает в хлоре, образуя сажу и HCl. Хлор вступает в реакции замещения с углеводородами, например, с CH4 образует хлорметан CHCl3, дихлорметан CH2Cl2, трихлорметан (хлороформ) CHCl3 и тетрахлорметан (тетрахлорид углерода) CCl4. Хлор вступает в реакции сочетания с другими веществами, например, с CO на свету или при нагревании и образует фосген, с гашеной известью - хлорную известь CaOCl (отбеливатель), а с водой - гидрат хлора Cl2*8H2O.
Соединения хлора. Хлороводород (хлорид водорода) HCl в водном растворе был получен И.Глаубером в 1648 при взаимодействии поваренной соли и серной кислоты. Раствор HCl в воде называют хлороводородной или соляной кислотой. Эта кислота встречается в источниках рек Южной Америки, которые вытекают из вулканических районов Анд. Желудочный сок человека содержит 0,2-0,4% соляной кислоты. Хлороводород получают синтезом из Cl2 и H2 под действием света или тепла. HCl образуется также по реакции Cl2 c сероводородом или метаном и другими углеводородами. Наиболее простой способ заключается в постепенном добавлении серной кислоты к хлориду натрия (поваренной соли) при слабом нагревании: NaCl + H2SO4 = NaHSO4 + HCl. При использовании твердой соли и более сильном нагревании образуется сульфат натрия: NaCl + NaHSO4 = Na2SO4 + HCl. HCl - резко пахнущий бесцветный газ, который можно конденсировать в бесцветную жидкость, кипящую при -83,7° C и затвердевающую при -112° C. Газ в 1,26 тяжелее воздуха, очень хорошо растворим в воде (442 объема на 1 объем воды при 20° С). Концентрированная соляная кислота содержит 37% HCl (плотность 1,19 г/мл). 20,24%-ный раствор HCl имеет температуру кипения 110° С. Соляная кислота широко используется в лабораторной практике, для обработки поверхности металлов перед пайкой, для травления их, в крашении, ситценабивном деле, производстве клея, мыла, глюкозы и др. Смесь 3 объемов конц. HCl и 1 объема конц. HNO3 известна в лабораторной практике под названием царская водка; она растворяет золото и другие благородные металлы.
Оксиды. Хлор образует оксиды Cl2O, ClO2 и Cl2O7. Все оксиды хлора нестабильны, могут разлагаться со взрывом, являются сильными окислителями, вызывают возгорание органических соединений, например бумаги, дерева и сахара. Cl2O - желтовато-красный газ - образуется при пропускании Cl2 над оксидом ртути при низкой температуре. При растворении его в воде образуется хлорноватистая кислота HClO. ClO2 - темножелтый газ, в промышленности его получают действием хлора на сухой хлорит натрия NaClO2. ClO2 применяют в отбеливающих порошках, в производстве бумаги и текстиля. Cl2O7 - бесцветная маслянистая жидкость, более стабильна, чем другие оксиды, но при определенных условиях также может взрываться. Cl2O7 получают обезвоживанием HClO4 в присутствии P4O10.
Оксокислоты. Хлорноватистая кислота HClO слабая, ее соли гипохлориты являются окислителями и применяются для дезинфекции и для отбеливания. Раствор Дакина, содержащий гипохлорит натрия, применяли для обработки открытых ран во время Первой мировой войны. Хлористую кислоту HClO2 получают по реакции хлорита бария с серной кислотой. Кислота стабильна только в очень разбавленных растворах, а в безводном состоянии не получена. Хлорноватая кислота HClO3 максимальной концентрации 40 % получается при разложении гипохлорита или по реакции хлората бария с разбавленной серной кислотой, при концентрации выше 40% кислота разлагается. Сама кислота и ее соли хлораты - сильные окислители. При нагревании KClO3 (бертоллетова соль) разлагается с выделением кислорода. Поэтому соль используют для изготовления спичек, сигнальных огней и в фейерверках. Хлорную кислоту HClO4 получают осторожной перегонкой смеси ее натриевой соли (перхлората натрия) с конц. HCl при пониженном давлении, так как кислота кипит при 16° С (18 мм рт.ст.). Эта реакция взрывоопасна. Чистая хлорная кислота - летучая бесцветная жидкость, является сильнейшим окислителем, в ее концентрированных растворах возгораются бумага и дерево. Cl2O7 является ангидридом этой кислоты, а ее соли (перхлораты) - наиболее устойчивые из солей кислородных кислот хлора. Хлорная кислота находит применение в аналитической химии как окислитель, а смесь перхлората бария и перхлората магния - как осушитель. Перхлораты используют также в производстве спичек и взрывчатых веществ.
См. также
ХИМИЧЕСКОЕ И БИОЛОГИЧЕСКОЕ ОРУЖИЕ.
ЛИТЕРАТУРА
Фурман А.А. Неорганические хлориды. М., 1980 Фрумина Н.С. и др. Хлор. М., 1983
ХЛОР (Chlorum), Cl, химический элемент VII группы периодической системы, атомный номер 17, атомная масса 35,453; относится к галогенам; жёлто-зелёный газ, tкип - 33,97°C. Используется в производстве поливинилхлорида, хлоропренового каучука, растворителей, различных хлоридов, окислительно-отбеливающих средств, пестицидов, для очистки воды и других санитарных нужд. Раствор хлора в водной щёлочи (жавелевая вода) - отбеливающее средство. Хлор открыл в 1774 шведский химик К. Шееле, элементную природу хлора установил в 1809 английский учёный Г. Дэви. В 1-ю мировую войну хлор использовали как боевое отравляющее вещество.
мед. натрий (natrium) и хлор (chlorine)
Это основные держатели осмотического давления, которое предотвращает утечку воды из кровеносных сосудов в прилежащие ткани.
см. тж микроэлементы, натрия хлорид
Заимств. в XIX в. из новолат. яз., где chlorum < греч. chlōros «желтовато-зеленый». Газ назван по своему цвету.
(гк)
χλωρόζ зелёный
хлор газ зеленоватого цвета
хлорофилл зелёный пигмент фотосинтезирующих растений, содержащийся в основном в листьях (См. греч. корень филл)
Ср. лат. Chloris - зеленушки (род вьюрковых).
ХЛОР а, м. chlore m. | нем. Chlor н.-лат. chlorum <гр. chloros зеленовато-желтый. Остро пахнущий, ядовитый, желто-зеленый газ, - отравляющее и обеззараживающее средство. Соединения хлора. БАС-1. Крысин 1998. Кто ест чеснок, Кто курит хлором, И близок к смерти не один. 1830. Ознобишин Холера. // О. 1 273. А дома всех встретили такой вонючей хлористой известью.. и такой диетой, которая одна без хлора и холеры могла свести человека в постель. Герц. Былое. Хлорщик а, м. Сл. зан. 2002. - Лекс. САН 1847: хлор.
ХЛОР (греч. chloros - зеленовато-желтый). Химически простое, газообразное тело, зеленовато-желтого цвета, острого, раздражающего запаха, имеющее способность обесцвечивать растительные вещества.
- В атмосфере этого газа-галогена горит даже вода.
- Галоген.
- Им пахнет больничная сантехника.
- Газ, применённый в боях у Ипра.
- Его масса равна 35,5, а название его означает «жёлто-зелёный».
- Добавка к водопроводной воде.
- Элемент номер один для санитарии.
- Санитарный галоген.
- Галоген, очень активный окислитель.
- Химический элемент, Cl.
- Этот элемент занимает по распространённости третье место в морской воде - после кислорода и водорода.
- Его главные минералы: галит, сильвин и бишофит.
Хло́ра окси́ды - хло́ра окси́ды: гемиоксид Cl2O (жёлто-оранжевый газ), диоксид ClO2 (зеленовато-жёлтый газ), триоксид Cl2O6 (ярко-красная жидкость), хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 - отбеливатель целлюлозы, тканей, бумаги.
ХЛОРА ОКСИДЫ: гемиоксид Cl2O (желто-коричневый газ) - диоксид ClO2 (зеленовато-желтый газ), триоксид Cl2O6 (темно-коричневая жидкость), хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 - отбеливатель целлюлозы, тканей, бумаги.
ХЛОРА ОКСИДЫ: - ХЛО́РА ОКСИ́ДЫ: гемиоксид Cl2O (желто-коричневый газ), диоксид ClO2 (зеленовато-желтый газ), триоксид Cl2O6 (темно-коричневая жидкость), хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 - отбеливатель целлюлозы, тканей, бумаги.
ХЛОРАЛ, хлорала, мн. нет, муж. (хим.). Бесцветная маслянистая жидкость с резким запахом, изготовляемая путем пропускания хлора в спирт.
хлора́л, хлора́лы, хлора́ла, хлора́лов, хлора́лу, хлора́лам, хлора́лом, хлора́лами, хлора́ле, хлора́лах
ХЛОРАЛ а, м. chloral m. <н.-лат. chloralum < chlorum хлор + alhogol. Хлорал. Бесцветная маслянистая жидкость с резким запахом, изготовляемая путем пропусканием хлора в спирт. Уш. 1940. Наркотическое и болеутоляющее средство. БАС-1. Жидкость Хлораль-гидрат, получается при действии хлора на безводный спирт, кристаллизованное вещество; употребляется как усыпляющее средство. Даль. Был хлораль, посол Морфея: Но и тот мне изменил, Сон как прежде не лелея, Кубок чудный он разбил. П. А. Вяземский Моя легенда. Жгучий страх переполняет ее: ну, как опять проснется после мучительной бессонницы, после новой дозы "хлорала", этого ненавистного хлорала. дающего предвкусие мертвеного сна. Бобор. Лихие болести. // ОЗ 1876 10 1 295. Успокоительные капли, которые даются в предупреждение бессонницы. Прим. // РА 1879 1 134. - Через полчаса дайте ему ложку хлорала и затем каждые полчаса по ложке, пока уснет. Б. Маркевич Бездна. // РВ 1883 1 24. Путем опытов над живыми животными изучено действие многих алкалоидов и препаратов, как аконит, белладонна, кокаин, хлорал, эргот, морфий, салициловая кислота, строфант и др. РБ 1911 4 2 23. - Лекс. Толль 1864: хлораль; Брокг.: хлорал; СИС 1937: хлора/л; Уш. 1940: хлора/л; Ганшина: хлора/ль.
ХЛОРАЛГИДРАТ, хлоралгидрата, мн. нет, муж. (см. хлорал и гидрат) (мед.). Успокаивающее и снотворное средство.
хлора́лгидра́т, хлора́лгидра́ты, хлора́лгидра́та, хлора́лгидра́тов, хлора́лгидра́ту, хлора́лгидра́там, хлора́лгидра́том, хлора́лгидра́тами, хлора́лгидра́те, хлора́лгидра́тах
Хлора́ль - CCl3CHO, бесцветная жидкость с резким запахом, tкип 97,7°C. Получают хлорированием этилового спирта. Применяют в производстве пестицидов. Хлоральгидрат CCl3CH(OH)2, бесцветные кристаллы, tпл 51,4°C, используют в медицине как успокаивающее средство.
ХЛОРАЛЬГИДРАТ а, м. hydrat de chloral. Бесцветные прозрачные кристаллы горьковатого едкого вкуса - снотворное и противосудорожное средство. БАС-1. Ему начинало казаться. что в нем уже два Бубнова: один мертвый, а другой умирающий, пьяный, гнилой до корня волос. Он забылся, только приняв усиленную дозу хлоральгидрата. Мамин-Сиб. Хлеб. Он сделался морфинистом, а вскоре стал, кроме того, употреблять хлорал гидрат. ЖЖ 1899 13-14 339. - Лекс. Даль-2: хлораль-гидрат; Даль-3: хлора/ль-гидра/т; Брокг.: хлорал-гидрат; Уш. 1940: хлоралгидра/т.
хло́рами́н, хло́рами́ны, хло́рами́на, хло́рами́нов, хло́рами́ну, хло́рами́нам, хло́рами́ном, хло́рами́нами, хло́рами́не, хло́рами́нах
хлорамин
[см. хлор + амины] - органическое соединение, служащее дегазатором для ряда отравляющих веществ (иприт, люизит и др.); представляет собой белый кристаллический порошок; водный раствор хлорамина применяется для дезинфекции (в хирургии и др.)
Хлорами́ны Б и Т - ароматические соединения общей формулы ХС6Н4SO2N(Na)Cl·3Н2O (хлорамины - Н и СН3 соответственно). Бесцветные кристаллы, tпл 180-185°C (с разложением) и 175-180°C. Отбеливатели, дегазирующие и дезинфицирующие вещества (аналогичное применение имеют дихлорамины Б и Т ХС6Н4SO2NCl2).
* * *
ХЛОРАМИНЫ Б и Т - ХЛОРАМИ́НЫ Б и Т, ароматические соединения общей формулы ХС6Н4SO2NNaCl Ч 3H2О (Х - H и CH3 соответственно). Бесцветные кристаллы, tпл 180-185 oС (с разложением) и 175-180 oС. Отбеливатели, дегазирующие и дезинфицирующие вещества (аналогичное применение имеют дихлорамины Б и Т).
ХЛОРАМИНЫ Б и Т - ароматические соединения общей формулы ХС6Н4SO2NNaCl ? 3H2О (Х - H и CH3 соответственно). Бесцветные кристаллы, tпл 180-185 oС (с разложением) и 175-180 oС. Отбеливатели, дегазирующие и дезинфицирующие вещества (аналогичное применение имеют дихлорамины Б и Т).
Хлорамфенико́л - то же, что левомицетин.
* * *
ХЛОРАМФЕНИКОЛ - ХЛОРАМФЕНИКО́Л, то же, что левомицетин (см. ЛЕВОМИЦЕТИН).
ХЛОРАМФЕНИКОЛ - то же, что левомицетин.
- То же, что левомицетин.
- Антибиотик, образуемый микроорганизмом из группы актиномицетов или получаемый путём химического синтеза.
Хлорангидри́ды - см. Галогенангидриды.
* * *
ХЛОРАНГИДРИДЫ - ХЛОРАНГИДРИ́ДЫ, см. Галогенангидриды (см. ГАЛОГЕНАНГИДРИДЫ).
ХЛОРАНГИДРИДЫ - см. Галогенангидриды.
Хлораргири́т (кераргирит), минерал подкласса хлоридов, AgCl. Серые, бурые корочки, сплошные массы. Твёрдость 2,5; плотность 5,6 г/см2. Гипергенного происхождения. Руда серебра.
* * *
ХЛОРАРГИРИТ - ХЛОРАРГИРИ́Т (кераргирит), минерал подкласса хлоридов (см. ХЛОРИДЫ ПРИРОДНЫЕ) , AgCl. Серые, бурые корочки, сплошные массы. Твердость 2,5; плотность 5,6 г/см2. Гипергенного (см. ГИПЕРГЕННЫЕ МЕСТОРОЖДЕНИЯ) происхождения. Руда серебра.
ХЛОРАРГИРИТ (кераргирит) - минерал подкласса хлоридов, AgCl. Серые, бурые корочки, сплошные массы. Твердость 2,5; плотность 5,6 г/см². Гипергенного происхождения. Руда серебра.