сущ., кол-во синонимов: 1
ванадий (2)
Ванада́ты - металлов, соли ванадиевых кислот, не выделенных в свободном состоянии, например ванадаты натрия NaVO3. Ванадаты - промежуточные продукты в производстве ванадия. Компоненты стёкол, глазурей, лазерные материалы, кристаллофосфоры и др., реагенты в аналитической химии.
* * *
ВАНАДАТЫ - ВАНАДА́ТЫ металлов, соли ванадиевых кислот, не выделенных в свободном состоянии, напр. ванадат натрия NaVO3. Ванадаты - промежуточные продукты в производстве ванадия, компоненты стекол, глазурей, лазерные материалы, кристаллофосфоры и др. реагенты в аналитической химии. Применяют в аналитической химии.
ВАНАДАТЫ металлов - соли ванадиевых кислот, не выделенных в свободном состоянии, напр. ванадат натрия NaVO3. Ванадаты - промежуточные продукты в производстве ванадия, компоненты стекол, глазурей, лазерные материалы, кристаллофосфоры и др. реагенты в аналитической химии. Применяют в аналитической химии.
ванада́ты
- 1) соли ванадиевой кислоты;
2) группа минералов, солей ванадиевой кислоты; являются основным сырьем для производства ванадия.
Ванада́ты приро́дные - группа минералов, соли ортованадиевой кислоты Н3VO4. Около 50 минералов. Структуры островные, цепочечные, слоистые. Жёлтые, красные, буровато-красные порошки, налёты, реже кристаллы. Твердость 1-4; плотность 2,5-7 г/см3. Руды ванадия, иногда урана.
* * *
ВАНАДАТЫ ПРИРОДНЫЕ - ВАНАДА́ТЫ ПРИРО́ДНЫЕ, группа минералов, соли ортованадиевой кислоты H3(VO4). Ок. 50 минералов. Структуры островные, цепочечные, слоистые. Желтые, красные, буровато-красные порошки, налеты, реже кристаллы. Твердость 1-4; плотность 2,5-7 г/см3. Руды ванадия, иногда урана.
ВАНАДАТЫ ПРИРОДНЫЕ - группа минералов, соли ортованадиевой кислоты H3(VO4). Ок. 50 минералов. Структуры островные, цепочечные, слоистые. Желтые, красные, буровато-красные порошки, налеты, реже кристаллы. Твердость 1-4; плотность 2,5-7 г/см³. Руды ванадия, иногда урана.
ВАНАДЗОР - ВАНАДЗО́Р (до 1935 Караклис, в 1935-1992 Кировакан), город в Армении, на реке Ванадзор (отсюда название). Железнодорожная станция. Население 93,6 тыс человек (2004). Химическая, машиностроительная, пищевая, легкая промышленность. Педагогический институт. Театр. Горноклиматический курорт. Первоначальное название Каракалиса (возможно татарского происхождения) относится к 13 в. В 1826 были объединены селения Большой и Малый Караклис в единый город. Сильно пострадал в результате катастрофического землетрясения в декабре 1988.
- Третий по величине город Армении после Еревана и Гюмри.
- Административный центр Лорийской области Армении.
- Современное название города Кировакан в Армении.
Вана́диевые ру́ды - главные минералы: ванадинит, деклуазит, купродеклуазит, карнотит. Месторождения магматические, контактово-метасоматические, гидротермальные. Содержание V2O5 в руде от 0,1-1 до 29%; примеси Fe, Ti, U, Pb, Zn, Cu, Mo, Al, P. Главные добывающие зарубежные страны: ЮАР, США, Финляндия, Чили.
* * *
ВАНАДИЕВЫЕ РУДЫ - ВАНА́ДИЕВЫЕ РУ́ДЫ, главные минералы: ванадинит, деклуазит, купродеклуазит, карнотит (см. КАРНОТИТ). Месторождения магматические (см. МАГМАТИЧЕСКИЕ МЕСТОРОЖДЕНИЯ), контактово-метасоматические (см. КОНТАКТОВО-МЕТАСОМАТИЧЕСКОЕ МЕСТОРОЖДЕНИЕ), гидротермальные (см. ГИДРОТЕРМАЛЬНЫЕ МЕСТОРОЖДЕНИЯ) . Содержание V2O5 в руде от 0,1-1,0 до 29%; примеси Fe, Ti, U, Pb, Zn, Cu, Mo, Al, P. Главные добывающие зарубежные страны: ЮАР, США, Финляндия, Чили.
ВАНАДИЕВЫЕ РУДЫ - главные минералы: ванадинит, деклуазит, купродеклуазит, карнотит. Месторождения магматические, контактово-метасоматические, гидротермальные. Содержание V2O5 в руде от 0,1-1,0 до 29%; примеси Fe, Ti, U, Pb, Zn, Cu, Mo, Al, P. Главные добывающие зарубежные страны: ЮАР, США, Финляндия, Чили.
вана́диевый, вана́диевая, вана́диевое, вана́диевые, вана́диевого, вана́диевой, вана́диевых, вана́диевому, вана́диевым, вана́диевую, вана́диевою, вана́диевыми, вана́диевом, вана́диев, вана́диева, вана́диево, вана́диевы, вана́диевее, пована́диевее, вана́диевей, пована́диевей
м.
Химический элемент, твёрдый металл светло-серого цвета, применяемый при изготовлении высокосортной стали, титановых сплавов и т.п.
ВАНАДИЙ - или ванад муж. весьма редкий металл, похожий на серебро, и открытый в некоторых свинцовых рудах. Ванадокислый хим. содержащий ванадовую кислоту.
ВАНА́ДИЙ, -я, м
Химический элемент, твердый металл светло-серого цвета, используемый для изготовления ценных сортов стали.
Ванадий применяется при получении быстрорежущих сталей и инструментов из них.
ВАНА́ДИЙ -я; м. [лат. Vanadium из др.-сканд.] Химический элемент (V), твёрдый металл светло-серого цвета, используемый для изготовления ценных сортов стали. ● Назван так по имени древнескандинавской богини красоты Ванадис из-за красивого цвета своих солей.
◁ Вана́диевый, -ая, -ое. В-ые руды. В-ая сталь.
* * *
вана́дий (лат. Vanadium), химический элемент V группы периодической системы. Название от имени древнескандинавской богини красоты Ванадис. Серо-стальной твёрдый металл. Плотность 6,11 г/см3, tпл 1920°C. Устойчив к действию воды и многих кислот. В земной коре рассеян, часто сопутствует железу (железные руды - важный промышленный источник ванадия). Легирующий компонент конструкционных сталей и сплавов, применяемых в авиационной и космической технике, морском судостроении, компонент сверхпроводящих сплавов. Соединения ванадия используют в текстильной, лакокрасочной, стекольной промышленности.
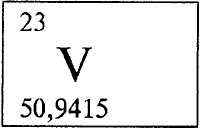
* * *
ВАНАДИЙ - ВАНА́ДИЙ (лат. Vanadium), V (читается «ванадий»), химический элемент с атомным номером 23, атомная масса 50,9415. Природный ванадий представляет собой смесь двух нуклидов (см. НУКЛИД): стабильного 51V (99,76% по массе) и слабо радиоактивного 52V (период полураспада более 3,9·1017 лет). Конфигурация двух внешних электронных слоев 3s2p6d34s2. В периодической системе Менделеева расположен в четвертом периоде в группе VВ. Ванадий образует соединения в степенях окисления от +2 до +5 (валентности от II до V).
Радиус нейтрального атома ванадия 0,134 нм, радиус ионов V2+ - 0,093 нм, V3+ - 0,078 нм, V4+ - 0,067-0,086 нм, V5+ - 0,050-0,068 нм. Энергии последовательной ионизации атома ванадия 6,74, 14,65, 29,31, 48,6 и 65,2 эВ. По шкале Полинга электроотрицательность ванадия 1,63.
В свободном виде - блестящий серебристо-серый металл.
История открытия
Ванадий открыт в 1801 мексиканским минералогом А. М. дель Рио как примесь в свинцовой руде из рудника в Зимапане. Новый элемент дель Рио назвал эритронием (от греческого erythros - красный) из-за красного цвета его соединений. Однако впоследствии он решил, что им обнаружен не новый элемент, а разновидность хрома, открытого четырьмя годами ранее и еще почти не изученного. В 1830 мексиканским минералом занялся немецкий химик Ф. Велер (см. ВЕЛЕР Фридрих), однако, отравившись фтористым водородом, он на несколько месяцев прекратил исследования. В том же году шведский химик Н. Сефстрем (см. СЕФСТРЕМ Нильс Габриель) обратил внимание на наличие в железной руде примеси, в которой наряду с известными элементами оказалось какое-то новое вещество. В результате анализа в лаборатории Й. Берцелиуса (см. БЕРЦЕЛИУС Йенс Якоб) было доказано, что открыт новый элемент. Этот элемент образует соединения с красивой окраской, отсюда и название элемента, связанное с именем скандинавской богини красоты Ванадис. В 1831 Велер доказал тождественность эритрония и ванадия, но за элементом сохранилось название, данное ему Сефстремом и Берцелиусом.
Нахождение в природе
В природе ванадий в свободном виде не встречается, относится к рассеянным элементам (см. РАССЕЯННЫЕ ЭЛЕМЕНТЫ). Содержание ванадия в земной коре 1,6·10-2 % по массе, в воде океанов 3,10-7 %. Важнейшие минералы: патронит V(S2)2, ванадинит Pb5(VO4)3Cl и некоторые другие. Основной источник получения ванадия - железные руды, содержащие ванадий как примесь.
Получение
В промышленности при получении ванадия из железных руд с его примесью сначала готовят концентрат, в котором содержание ванадия достигает 8-16%. Далее окислительной обработкой ванадий переводят в высшую степень окисления +5 и отделяют легко растворимый в воде ванадат натрия NaVO3. При подкислении раствора серной кислотой выпадает осадок, который после высушивания содержит более 90% ванадия.
Первичный концентрат восстанавливают в доменных печах и получают концентрат ванадия, который далее используют при выплавке сплава ванадия и железа - так называемого феррованадия (содержит от 35 до 70% ванадия). Металлический ванадий можно приготовить восстановлением хлорида ванадия водородом, кальцийтермическим восстановлением оксидов ванадия (V2O5 или V2O3), термической диссоциацией VI2 и другими методами.
Физические и химические свойства
Ванадий по внешнему виду похож на сталь, это достаточно твердый, но вместе с тем пластичный металл. Температура плавления 1920 °C, температура кипения около 3400 °C, плотность 6,11 г/см3. Кристаллическая решетка кубическая объемно центрированная, параметр а=0,3024 нм.
Химически ванадий довольно инертен. Он стоек к действию морской воды, разбавленных растворов соляной, азотной и серной кислот, щелочей. С кислородом ванадий образует несколько оксидов: VO, V2O3, V3O5, VO2, V2O5. Оранжевый V2O5 - кислотный оксид, темно-синий VO2 - амфотерный, остальные оксиды ванадия - основные. С галогенами ванадий образует галогениды составов VX2 (X = F, Cl, Br, I), VX3, VX4 (X = F, Cl, Br), VF5 и несколько оксогалогенидов (VOCl, VOCl2, VOF3 и др.).
Соединения ванадия в степенях окисления +2 и +3 - сильные восстановители, в степени окисления +5 проявляют свойства окислителей. Известны тугоплавкий карбид ванадия VC (tпл=2800 °С), нитрид ванадия VN, сульфид ванадия V2S5, силицид ванадия V3Si и другие соединения ванадия.
При взаимодействии V2O5 с основными оксидами образуются ванадаты (см. ВАНАДАТЫ) - соли ванадиевой кислоты вероятного состава H2[O(V2O5)2,5].
Применение
Ванадий в основном используется как легирующая добавка при получении износоустойчивых, жаропрочных и коррозионностойких сплавов (прежде всего, специальных сталей), как компонент при получении магнитов. Оксид ванадия V2O5 служит эффективным катализатором, например, при окислении сернистого газа SO2 в серный газ SO3 при производстве серной кислоты. Соединения ванадия находят разнообразное применение в различных отраслях промышленности (текстильной, стекольной, лакокрасочной и др.).
Биологическая роль
Ванадий постоянно присутствует в тканях всех организмов в ничтожных количествах. В растениях его содержание (0,1-0,2%) значительной выше, чем в животных (1·10-5-1·10-4 %). Некоторые морские организмы - мшанки, моллюски и, особенно, асцидии - способны концентрировать ванадий в значительных количествах (у асцидий ванадий находится в плазме крови или специальных клетках - ванадоцитах). По-видимому, ванадий участвует в некоторых окислительных процессах в тканях. Мышечная ткань человека содержит 2·10- 6 % ванадия, костная ткань - 0,35·10- 6 %, в крови - менее 2·10- 4 % мг/л. Всего в организме среднего человека (масса тела 70 кг) 0,11 мг ванадия. Ванадий и его соединения токсичны. Токсическая доза для человека 0,25 мг, летальная доза - 2-4 мг. Для V2O5 ПДК в воздухе 0,1-0,5 мг/м3.
ВАНАДИЙ (лат. Vanadium) - V, химический элемент V группы периодической системы, атомный номер 23, атомная масса 50,9415. Название от имени древнескандинавской богини красоты Ванадис. Серо-стальной твердый металл. Плотность 6,11 г/см³, tпл 1920 .C. Устойчив к действию воды и многих кислот. В земной коре рассеян, часто сопутствует железу (железные руды - важный промышленный источник ванадия). Легирующий компонент конструкционных сталей и сплавов, применяемых в авиационной и космической технике, морском судостроении, компонент сверхпроводящих сплавов. Соединения ванадия используют в текстильной, лакокрасочной, стекольной промышленности.
ВАНАДИЙ (Vanadium), V, химический элемент V группы периодической системы, атомный номер 23, атомная масса 50,9415; металл, tпл 1920°C. Используют для легирования стали и чугуна, как компонент жаропрочных, твердых и коррозионно-стойких сплавов, в качестве конструкционного материала для ядерных реакторов. Открыт шведским химиком Н. Сефстремом в 1830.
мед. ванадий (vanadium)
Микроэлемент.
- Важен для баланса натрия и калия в организме.
см. тж микроэлементы
ВАНАДИЙ (лат. vanadium). Хрупкий металл, белого цвета, открыт в 1830 г. и назван по имени скандинавского божества Ванадия.
- Этот химический элемент из-за красивого цвета своих солей получил своё название в честь скандинавской богини красоты.
- Химический элемент, V.
- Химический элемент, металл.
Вана́дия окси́д - V2O5, красные или жёлто-красные кристаллы; tпл 680°C. Плохо растворяется в воде. Катализатор при получении серной кислоты, компонент специальных стёкол, глазурей и люминофоров.
* * *
ВАНАДИЯ ОКСИД - ВАНА́ДИЯ ОКСИ́Д, V2O5, красные или желто-красные кристаллы; tпл 680 °C. Плохо растворяется в воде. Катализатор при получении серной кислоты, компонент специальных стекол, глазурей и люминофоров.
ВАНАДИЯ ОКСИД - V2O5, красные или желто-красные кристаллы; tпл 680 .C. Плохо растворяется в воде. Катализатор при получении серной кислоты, компонент специальных стекол, глазурей и люминофоров.
ПОДГРУППА VB. СЕМЕЙСТВО ВАНАДИЯ
ВАНАДИЙ, НИОБИЙ, ТАНТАЛ
Различие в химических и физических свойствах среди членов этого семейства переходных металлов ванадия V, ниобия Nb и тантала Ta несколько больше, чем отмеченное у элементов подгруппы IVB. Например, более тяжелые элементы Nb и Ta имеют одинаковый радиус, но последний элемент вдвое тяжелее (табл. 12), что приводит к резкому увеличению плотности Ta по сравнению с Nb. Все элементы подгрупп IVB и VB имеют высокие температуры плавления, что свойственно элементам, расположенным в середине периодов. Ниобий отличается необычностью электронного строения, так как имеет единственный электрон на внешней s-орбитали (4d45s1). Это можно объяснить сильным взаимодействием положительного заряда ядра с 5s-электронами, из-за чего один из них втягивается на 4d-орбиталь. Однако химическое поведение ниобия в норме соответствует электронной конфигурации 4d35s2, так что различие свойств Nb и Ta невелико. Между Nb и Ta больше сходства, чем между V и Nb, что понятно при идентичности радиусов. При обычной температуре все эти металлы инертны, благодаря чему применяются в сплавах для производства специального обрабатывающего инструмента и коррозионностойких емкостей. Все элементы подгруппы проявляют максимальную степень окисления V. Соединения с низшими степенями окисления (II и III) стабильнее у более легкого элемента ванадия, чем у более тяжелых Nb и Ta. Соединения ванадия(II) хорошие восстановители, они даже выделяют водород из воды. Различие в окислительной способности этих металлов проявляется в том, что сильные восстановители типа Zn и HCl восстанавливают VV до VII, NbV до NbIV, но не действуют на TaV. (Для элементов любого семейства, в котором существует поливалентность, легкие члены семейства всегда имеют стабильные высокие степени окисления, а тяжелые, как правило, легко переходят из состояния с высокой степенью окисления в более стабильное состояние с низкой степенью окисления.)
В степени окисления V элементы обычно образуют бесцветные соединения, а в низших степенях окисления ионы и соединения сильно окрашены. Окраска определяется подвижностью электронов нижних электронных слоев под действием света. Ионы в одинаковом состоянии часто имеют одинаковую окраску.
Структура соединений, образованных V, Nb и Ta, сильно зависит от степени окисления металла и типа электронных оболочек, участвующих в образовании связи. При образовании комплексных соединений металлы проявляют высокие координационные числа (число ассоциированных у металла групп). Так, Ta образует необычные фторокомплексные ионы [[TaF8]]3 и [[TaF7]]2.
Выделение из руд. Элементы V, Nb и Ta очень трудно получить в чистом виде из их руд и непросто восстановить из ионных состояний до свободного металла. Руду ванадинит Pb5(VO4)3Cl обрабатывают HCl до образования нерастворимого PbCl2 и растворимого ванадил(V)-иона VO2+. При добавлении к раствору NH4Cl выпадает осадок NH4VO3, который при прокаливании образует V2O5 исходное вещество для получения металла и многих соединений ванадия. Металлический ванадий получают восстановлением его оксида алюминием. Свободный металл может быть получен также из подкисленных хлороводородной кислотой растворов Na3VO4 или NaVO3 методом электролиза. Для использования в сплавах применяют неочищенный феррованадий FeV, получающийся прокаливанием V2O5 с железным ломом. Феррованадий имеет более низкую температуру плавления, чем чистый ванадий, и поэтому он предпочтительнее для легирования расплавов стали.
См. также
Ниобий и тантал выделяют из их руд сплавлением с содой или KHSO4 с последующей экстракцией водой с образованием водорастворимой фазы. Разделение двух химически сходных металлов может быть достигнуто обработкой раствора KF, который эффективно осаждает K2(TaF7), при этом большая часть ниобия остается в растворе в виде K2(NbOF5). Для разделения этих комплексов также применяется жидкостная экстракция.
Применение.Металлический тантал в отличие от ниобия находит разнообразное применение. Электролизом фторокомплекса K2TaF7 получают свободный тантал. Благодаря химической инертности, высокой коррозионной стойкости, а также хорошей теплопроводности его используют в производстве хирургических шин, винтов, пластин, тонких сеток и др., предназначенных для имплантации в живой организм. Трубы, приемники и другое химико-технологическое оборудование часто изготовляют из тантала для работы с коррозионно-активными парами и жидкостями. С помощью тантало-свинцово-сернокислотного выпрямителя получают пульсирующий ток. Кроме того, тантал применяют как добавку к стали и для получения сплава с вольфрамом, используемого в электровакуумной технике. Карбид TaC очень твердое вещество, используемое для изготовления специальных сверл и других режущих инструментов. Ванадий применятся как легирующий элемент в сталях.
Химические свойства. При низких температурах все эти металлы устойчивы к кислороду и большинству реагентов. Это отчасти удивительно, так как все они имеют положительные окислительные потенциалы. Однако на поверхности рассматриваемых металлов легко образуется пассивирующая пленка, что повышает инертность и затрудняет измерение потенциалов. Ванадий активнее ниобия и тантала. При нагревании все эти металлы взаимодействуют с кислородом HNO3 и NaOH. При действии NaOH на ванадий образуется NaVO3 и выделяется водород.
Реакции. Все члены этого семейства образуют пентаоксиды, слаборастворимые в воде и дающие слабокислую реакцию. Пентаоксид ванадия V2O5 наиболее важен как промышленный катализатор окисления SO2 в SO3 (контактный метод производства серной кислоты), окисления спиртов и гидрогенизации масел в жиры:
Красно-оранжевый оксид ванадия наиболее удобно получать термическим разложением ванадата аммония NH4VO3:
2NH4VO3 -> V2O5 + 2NH3 + H2O.
Амфотерный характер ванадия проявляется при растворении V2O5 в NaOH с образованием ортованадата Na3VO4. При добавлении NH4+ в раствор образуется метаванадат аммония NH4VO3, что необычно, так как ион аммония, как правило, не является восстановителем. При изменении кислотности ванадатных растворов протекают процессы конденсации или полимеризации оксоанионов с образованием соединений, называемых изополисолями и изополикислотами, например, [[V3O8]] триполиванадат(V), [[V4O9]]2 тетраполиванадат(V), [[V6O17]]4 гексаполиванадат(V). Пентаоксиды Nb и Ta образуются при прямом окислении. Они достаточно устойчивы к действию восстановителей (см. выше). Пентаоксид ванадия восстанавливается до VO2 при нагревании со щавелевой кислотой H2C2O4. Монооксид углерода и водород восстанавливают V2O5 до V2O3 и даже до VO. Все эти оксиды окрашены.
Галогениды. Все металлы подгруппы VB образуют пентагалогениды, но между ними существуют различия в свойствах. Пентафторид ванадия VF5 (белого цвета) единственный пентагалогенид ванадия, другие галогениды ванадия(V) неустойчивы из-за окислительной способности Vv. В табл. 12а указано, из чего могут быть синтезированы некоторые галогениды ванадия и ниобия.
Галогениды с низшей и высшей степенью окисления элемента образуются по реакциям диспропорционирования из галогенидов с промежуточной степенью окисления металла. Способы получения и свойства галогенидов тантала и ниобия аналогичны. Все галогениды подвергаются гидролизу с образованием оксогалогенидов по схеме VF5 + H2O = VOF3 + 2HF
При взаимодействии оксидов, например V2O5, с галогенами (Cl2 или Br2) также образуются оксогалогениды (VOCl3 или VOBr3).
Cульфиды. При взаимодействии V2O5 с CS2, очевидно, получается только V2S3, а не V2S5; трисульфид образуется также при действии сухого H2S на V2O3. Дисульфид тантала TaS2 образуется из Ta2O5 и CS2. VS образуется при гидрировании V2S3.
Нестехиометрические гидриды. При нагревании кусочков металла с водородом образуются гидриды нестехиометрического состава; хотя при этом и выделяется тепло, но сомнительно, что образуются истинные соединения. По результатам анализов отношение металл: водород составляет примерно 1:0,8.