ж.
Орган животных и человека, вырабатывающий и выделяющий особые вещества, необходимые для жизнедеятельности организма.
ж.
Орган животных и человека, вырабатывающий и выделяющий особые вещества, необходимые для жизнедеятельности организма.
ЖЕЛЕЗА́, железы, мн. железы, желез, железам, жен. (анат.). Орган, вырабатывающий вещества, необходимые для размножения или для питания организма или выделяющий наружу вредные для организма продукты (пот, мочу и др.). Слюнная железа. Желудочные железы. Железы внутренней секреции.
ЖЕЛЕЗА́, -ы, мн. железы, желёз, железам, жен. Орган, вырабатывающий и выделяющий гормоны или другие вещества, обеспечивающие жизнедеятельность организма. Железы внутренней секреции. Грудная ж. Слюнная ж.
| уменьш. желёзка, -и, жен.
| прил. железистый, -ая, -ое (спец.). Ж. эпителий.
ЖЕЛЕЗА́, -ы́, мн же́лезы, желёз, железа́м, ж
Орган, обрабатывающий и выделяющий вещества, необходимые для жизнедеятельности организма человека или животного.
Щитовидная железа ежедневно выделяет в составе гормонов до 0,3 мг йода (Журн.).
ЖЕЛЕЗА́ -ы́; мн. же́лезы, желёз, железа́м; ж. Орган у человека и животных, вырабатывающий и выделяющий вещества, необходимые для жизнедеятельности организма. Поджелудочная ж. Слюнная ж. Потовые железы. Железы внутренней секреции.
◁ Желёзка (см.). Желе́зистый, -ая, -ое. Ж-ая клетка. Ж-ая ткань.
-ы́, мн. же́лезы, желёз, железа́м, ж.
Орган у человека и животных, вырабатывающий и выделяющий в кровь или на поверхность организма вещества, необходимые для его жизнедеятельности.
Поджелудочная железа. Слюнная железа. Потовые железы. Железы внутренней секреции.
Железа с внутренней секрецией. Разг. Шутл.-ирон. О злой, вредной, сварливой женщине. Мокиенко, Никитина 2003, 139.
F́ сущ см. Приложение II
железы́
железе́
железу́
железо́й́
о железе́
мн.
ж́е́лезы
желёз
железа́м́
ж́е́лезы
железа́ми
о железа́х́
Была пора смешливой бульбы
И щитовидной железы́,
Была пора Тараса Бульбы
И подступающей грозы.
О. Э. Мандельштам, «Когда в далекую Корею…»
Егор Петрович Мальцев
Хворает, и всерьез:
Уходит жизнь из пальцев,
Уходит из желёз.
А. А. Галич, Баллада о сознательности
железа́, же́лезы, железы́, желёз, железе́, железа́м, железу́, железо́й, железо́ю, железа́ми, железа́х
сущ., кол-во синонимов: 20
аден (3)
амфибронхий (1)
гипофиз (3)
гланда (3)
гонад (1)
гонада (1)
железка (17)
миндалина (6)
надпочечник (1)
параганглий (1)
паротида (1)
печень (6)
простата (2)
семенник (8)
странгалида (1)
тимус (1)
щитовидка (2)
эпифиз (3)
яичко (5)
яичник (8)
гипофиз, щитовидка, железка, эпифиз, простата, параганглий, миндалина, надпочечник, тимус, семенник, яичник, печень, яичко, гонада, гланда, гонад
▲ орган (животных)
↑ производящий, определенный, органическое соединение
железы - органы, вырабатывающие в - ва, необходимые организму.
мерокриновый (# железы). апокриновый. голокриновый.
♥
секрет (биол). секреторный.
секреция. гиперсекреция. гипосекреция.
альвеолы. альвеолярный.
железистые клетки.
↓ гидраденит.
▼ внутренняя секреция, внешняя секреция
см. реактор
Общеславянское слово, восходящее к той же основе gel, что и желвак ; перед звуком "е" происходило смягчение "г" в "ж". В других словах от той же основы, но пошедших другим путем развития, "г" сохранилось, как, например, в глаз.
Общесл. Образовано от *gel с помощью суф. -га (ср. аналогичное по морфологической структуре дереза): *gelza > железа после смягчения г перед е в ж и развития полногласия.
Общеслав. Суф. производное от той же основы (*gel-), что и желвак, голова. Исходное gelza > железа после изменения g > ж перед гласным переднего ряда и развития полногласия. Железа буквально - «затвердение».
железа́
мн. же́лезы, диал. зе́лезы, также залоза́, золо́за, укр. зало́за, блр. залоза́, др.-русск. желоза, железа, цслав. жлѣза "glandula", болг. жлеза́ (Младенов 168), сербохорв. жлиjѐзда, словен. žléza, др.-чеш. žléza, чеш. žláza, слвц. žlaza, польск. zoɫza, н.-луж., в.-луж. žaɫza; см. Торбьёрнссон, I, 107.
Сравнивают с лит. gẽležuones, gẽležūnes, geležū́nes, gẽležaunės мн. "железы" (Буга, РФВ 67, 240, 249; Траутман, BSW 84), далее - с арм. geɫj-k' "железы"; см. Лиден, Armen. Stud. 71; Мейе, MSL 13, 243 и сл.; Бугге, KZ 32, 5; Хюбшман 433. Последнее Перссон (793) и Сольмсен (Beitr. 223 и сл.) сравнивают с греч. γέλγις "головка или зубец чеснока". Стар. точка зрения о родстве с жёлудь (см.), греч. βάλανος, лат. glans, лит. gìlė, лтш. dzile (Торп 62; Цупица, GG 83; Траутман, Apr. Sprd. 338) сомнительна ввиду арм. g-; см. также Вальде - Гофм. I, 604 и сл. [Слова железа́ и желе́зо, вероятно, не следует отрывать друг от друга; см. Трубачев, ВСЯ, 2, 1957, стр. 34. - Т.]
- Выдаёт секрет.
- Орган, выделяющий вещества, необходимые для жизнедеятельности.
- Эндокринная ...
- Слёзная ...
- Щитовидная ...
- Поджелудочная ...
- Орган, вырабатывающий гормоны.
ЖЕЛЕЗА НИТРАТЫ - ЖЕЛЕ́ЗА НИТРА́ТЫ: Fe(NO3)2 и Fe(NO3)3. Образуют кристаллогидраты, напр., Fe(NO3)3·9H2O. Fe(NO3)3 - протрава при крашении тканей и коагулянт при очистке сточных вод.
ЖЕЛЕЗА НИТРАТЫ: Fe(NO3)2 и Fe(NO3)3. Образуют кристаллогидраты - напр., Fe(NO3)3.9H2O. Fe(NO3)3 - протрава при крашении тканей и коагулянт при очистке сточных вод.
ЖЕЛЕЗА ОКСИДЫ - ЖЕЛЕ́ЗА ОКСИ́ДЫ: FeO, Fe2O3 и Fe3O4. Природные оксиды железа (гематит и магнетит) - сырье для получения железа. Применяются в производстве магнитных материалов, в качестве пигментов, компонентов футеровочной керамики.
ЖЕЛЕЗА ОКСИДЫ: FeO - Fe2O3 и Fe3O4. Природные оксиды железа (гематит и магнетит) - сырье для получения железа. Применяются в производстве магнитных материалов, в качестве пигментов, компонентов футеровочной керамики.
ЖЕЛЕЗА СУЛЬФАТЫ - ЖЕЛЕ́ЗА СУЛЬФА́ТЫ: FeSO4 и Fe2(SO4)3. Образуют кристаллогидраты. FeSO4·7H2O (железный купорос) применяют в производстве чернил, для окраски шерсти в черный цвет, консервации древесины, как фунгицид. Fe2(SO4)3·9H2O - коагулянт при очистке воды, сырье для получения железных квасцов, протрава при крашении.
ЖЕЛЕЗА СУЛЬФАТЫ: FeSO4 и Fe2(SO4)3. Образуют кристаллогидраты. FeSO4.7H2O (железный купорос) применяют в производстве чернил - для окраски шерсти в черный цвет, консервации древесины, как фунгицид. Fe2(SO4)3.9H2O - коагулянт при очистке воды, сырье для получения железных квасцов, протрава при крашении.
Желе́за сульфа́ты{:} - FeSO4 и Fe2(SO4)3. Образуют кристаллогидраты. FeSO4·7H2O (железный купорос) применяют в производстве чернил, для окраски шерсти в чёрный цвет, консервации древесины, как фунгицид. Fe2(SO4)3·9Н2О - коагулянт при очистке воды, сырьё для получения железных квасцов, протрава при крашении.
ЖЕЛЕЗА СУЛЬФИДЫ - ЖЕЛЕ́ЗА СУЛЬФИ́ДЫ: FeS, FeS2 и др. Природные сульфиды железа - пирит, марказит, пирротин - главная составная часть колчеданов.
ЖЕЛЕЗА СУЛЬФИДЫ: FeS - FeS2 и др. Природные сульфиды железа - пирит, марказит, пирротин - главная составная часть колчеданов.
ПОДГРУППА VIIIB. ТРИАДЫ ЖЕЛЕЗА И ПЛАТИНОВЫХ МЕТАЛЛОВ
Индивидуальные триады VIIIB подгруппы имеют общий признак в том, что они занимают по одному положению в периодической таблице, что объясняется огромным сходством свойств элементов. Обозначение "B" для VIII группы не является необходимым, так как нет VIIIA подгруппы, однако химические и физические свойства элементов триад железа и платиновых металлов согласуются с общей классификацией их как переходных элементов.
ТРИАДА ЖЕЛЕЗА: ЖЕЛЕЗО, КОБАЛЬТ, НИКЕЛЬ
Тот факт, что члены триады железа более сходны друг с другом в своем переходном ряду, чем с элементами в столбцах периодической таблицы, не является необычным, так как во всех подгруппах первые члены подгруппы отличаются по своим свойствам. Температуры плавления элементов триады железа высокие, но ниже, чем у предшествующих элементов, находящихся в серединах серий переходных металлов. В табл. 15 приведены свойства, характеризующие сходство радиусов атомов, ионов и некоторых термических свойств.
Железо первый элемент в переходных рядах, имеющий спаренный электрон на внутренней d-орбитали. Спаренные электроны с такой орбитали труднее участвуют в образовании химической связи, чем неспаренные. Особенности внутреннего орбитального строения всех металлов этой триады проявляются в наличии у них сильных магнитных или ферромагнитных свойств. В магнитном поле атомы этих металлов ориентируются так, что металлы образуют постоянные магниты. Все металлы триады проявляют выраженное электроположительное поведение, металлическую связь, хорошую проводимость и металлический блеск. Они достаточно инертны в среде сильных окислителей и даже кислорода воздуха. В этих условиях на их поверхности образуются тонкие и инертные пленки оксидов, а также проявляется способность элемента предоставлять внутренние d-орбитали для образования связей с другими атомами по донорно-акцепторному механизму (например, от железа к хрому, вольфраму и другим металлам в процессах сплавления). Ни один элемент из триады железа не проявляет максимальной степени окисления VIII (в отличие от платиновых металлов). Все металлы триады железа образуют многообразные соединения, проявляя степени окисления II и III. Проявление высокой степени окисления и амфотерных свойств наиболее характерно для железа.
Железо. Железо второй (после алюминия) по распространенности металл, встречается в виде различных руд, пригодных для переработки (табл. 15). В США, например, богатая руда уже использована в сталелитейной промышленности. Железный рудник в районе Месаби-Рейндж (шт. Миннесота) теперь содержит только бедную железом гранитоподобную породу. Ее взрывают, извлекают, дробят и превращают в мелкий порошок. При обжиге образуется оксид железа, проявляющий магнитные свойства, благодаря чему из водной взвеси его отделяют от пустой породы магнитной сепарацией. Магнитный оксид брикетируют обкаткой в барабане, затем слегка спекают до получения окатышей, пригодных для доменного процесса. Таким способом из бедной руды (ЖЕЛЕЗА ТРИАДЫ И ПЛАТИНОВЫХ МЕТАЛЛОВ20% оксида железа) получают почти чистый Fe3O4, который совместно с известняком и коксом используется для выплавки чугуна в доменной печи.
Современная доменная печь это цилиндрическая башня высотой около 30 м и диаметром около 8 м. Через горн печи снизу вверх продувают подогретый воздух. Шихта в печи состоит из железной руды, известняка (CaCO3) и кокса. Подогретый воздух окисляет кокс c образованием СО и выделением тепла, которое вызывает плавление шихты, при этом силикаты переходят в CaSiO3, или шлам. Далее происходит ступенчатое восстановление оксида железа, разное в различных температурных зонах печи и зависящее от количества кислорода и концентрации СO. Получаемый чугун содержит только 93% Fe, остальное составляют C, Si, P и газовые включения азота, кислорода и других газов. Для удаления примесей C, S и P проводят обжиг в отражательных печах. Добавки определенных металлов сообщают сплаву твердость, вязкость, механическую прочность и другие физические свойства, необходимые для стали. Кроме того, полученный сплав обычно подвергают операциям отжига и закалки для создания хорошей кристаллической структуры и распределения фаз. Основная масса доменного чугуна передельный чугун (С > 4%) идет на переплавку в сталь в конвертерах, мартеновских или электрических дуговых печах; литейный чугун (С 2,43,8%) применяют в машиностроении для изготовления чугунного литья
(см. также ЖЕЛЕЗО; МЕТАЛЛЫ ЧЕРНЫЕ).
Кобальт. Металлический кобальт выделяют из руд, которые содержат много мышьяка, а также серебро в количестве, достаточном для промышленной переработки. Руду плавят с флюсом для получения сырого серебряного слитка, загрязненного штейна или сплава Co-As-Fe. Дополнительным обжигом удаляют As и Fe. Оставшиеся металлы, в том числе значительное количество меди, переводят в хлориды с помощью NaCl. Присутствующее серебро осаждают в виде AgCl. Водной вытяжкой в раствор переводят соли Co и Ni, которые затем осаждают в виде гидроксидов. Кобальт и никель очень похожи по химическим свойствам, поэтому их трудно отделить друг от друга. Разделение достигается благодаря тому, что Ni легко образует карбонил из NiO и CO, а кобальт нет. CoO восстанавливают до металла алюминием.
Никель. Никелевая руда в основном содержит смесь сульфидов никеля, меди и железа. При обжиге с дутьем воздуха и с песком в качестве флюса образуется смесь NiO и NiS. Большая часть железа переходит в шлак в виде силиката железа. При плавлении NiO-NiS в шахтной печи получают сплав Ni-Cu (штейн, который все еще содержит много серы). Штейн прокаливают в конвертере Бессемера, увеличивая содержание сплава Ni-Cu до 80%. Такой состав, все еще содержащий 20% серы, пригоден для использования в металлургии. Из этого сплава получают монель-металл, сплав, содержащий 70% Ni c добавками Cu, Fe и Mn. Чистые металлы можно получать из штейна комплексной переработкой, включая образование сульфидов в расплаве при добавлении Na2S. При этом NiS осаждается из расплава, а сульфиды меди и железа остаются в жидкой фазе. Полученный NiS после прокаливания образует NiO, из которого при восстановлении углеродом получают металл. Для получения металла высокой чистоты его растворяют и выделяют вновь электролитически. При этом среди прочих примесей на никелевом электроде осаждаются и платиновые металлы, которые с анода переходят в раствор при электролизе. Известен также карбонильный метод очистки никеля (Монд-процесс), при котором никель окисляют до оксида, затем получают летучий карбонил Ni(CO)4, при разложении которого образуется высокочистый никель.
Около половины получаемого никеля расходуется в производстве стали для повышения ее коррозионной стойкости и твердости. Он используется также для создания прочных покрытий на стальных изделиях; хотя хромовые покрытия предпочтительнее, лучшие результаты получаются при нанесении их на никелевую основу. Никелевый сплав пермаллой (78% Ni и 21% Fe) обладает высокой магнитной проницаемостью, что делает его ценным для использования в радиотехнике и системах связи. Американский "никель" пятицентовая монета состоит из сплава 25% Ni и 75% Cu, а "немецкое серебро" (нейзильбер) это сплав Ni-Zn-Cu с соотношением 1:1:2; высококоррозионностойкий сплав, используемый для изготовления термопар и обмотки катушек, состоящий из 74% Ni, 12% Fe, 11% Cr и 2% Mn, называется нихромом. Мелкодисперсный никелевый порошок применяется как эффективный катализатор гидрогенизации (например, конверсии масел в жиры).
Реакции. Все металлы триады железа реагируют с кислородом только при нагревании. Оксиды в низшей степени окисления имеют состав MO. Однако железо не образует оксид такого стехиометрического состава. В структуре оксида железа имеется дефицит железа и оксид отвечает формуле Fe0,95O, являясь нестехиометрическим соединением. При окислении Fe0,95O происходит окисление Fe2+ в Fe3+ с образованием Fe2O3. При этом обычно образуется оксид промежуточного состава Fe3O4. При добавлении щелочи к раствору соединений Fe2+ выпадает белый осадок Fe(OH)2, который быстро окрашивается в результате окисления и образования красного гидроксида железа(III) Fe(OH)3. При нагревании в восстановительной среде Fe(OH)2 выделяет оксид состава, близкого к FeO, который легко возгорается на воздухе. Кобальт и никель образуют оксиды строго стехиометрического состава CoO и NiO. В отличие от никеля, при добавлении к раствору Co2+ щелочи образуется светлоголубой Co(OH)2, быстро меняющий окраску на розовую и окисляющийся до состояния гидратированного оксида кобальта(III). При прокаливании CoO образуется Co3O4. Оксиды никеля и кобальта (NiO и CoO) получаются при разложении карбонатов NiCO3 и CoCO3. Соединения Co(III) окисляют воду с выделением кислорода. Гидратированный диоксид никеля NiO2*xH2O, получаемый электролитическим окислением NiO или Ni(OH)2, применяют в технологии аккумуляторов он служит катодом в никель-кадмиевых батареях ("никад", или NiO2-Cd), а также в железо-никелевом аккумуляторе Эдисона. Железо не образует оксидов со степенью окисления больше 3, но Fe(OH)3 или Fe2O3 можно окислить мощными окислителями в щелочной среде с образованием оксоанионов, что иллюстрирует амфотерный характер железа. Из гидроксида Fe(III) действием хлора в среде NaOH получают феррат(VI)-ион (FeVIO4)2, а из [[Fe(OH)6]]3 действием кислорода в присутствии Ba(OH)2 получают феррат(IV)-ион (FeIVO3)2, и наконец, феррат(V)-ион (FeVO4)3образуется из соединений Fe(II) под действием KO2. Соединения Fe(V) необычны для железа. Известен феррат(III)-ион FeIIIO2, образующийся из Fe2O3 и щелочи при высокой температуре; очевидно, что Fe(III) не проявляет ярко выраженной амфотерности.
Галогениды. Галогениды всех металлов триады железа образуются при непосредственном взаимодействии металлов с галогенами. Железо образует тригалогениды FeF3, FeCl3 и FeBr3, но не FeI3, так как иодид-ион окисляется железом(III) до свободного иода. FeCl3 существует в виде димера Fe2Cl6 (даже при 750° С в парах мало молекул мономера FeCl3), в чем он сходен с Al2Cl6. Кобальт со фтором образует CoF2 и CoF3, причем трифторид хороший фторирующий агент. Дигалогениды всех металлов триады и тригалогениды железа легко образуют комплексные соединения, как и следовало ожидать для переходных металлов. FeF3, например, образует комплексные ионы FeF52и FeF63. Cродство Fe(III) к OHпроявляется в гидролизе с образованием основных солей Fe(OH)Cl2 и Fe(OH)2Cl. Кобальт(III) слишком сильный окислитель, чтобы образовывать простые галогениды, хотя известны CoF3 и некоторые твердые соли Co(III), например Co2(SO4)3.
Комплексообразование. Состояние Co(III) можно стабилизировать в виде комплексного иона с помощью молекул или ионов, являющихся донорами электронной пары. Количество комплексных соединений Co(III) огромно и уступает, вероятно, только соединениям хрома. Донорами электронов или лигандами могут быть галогениды, аммиак, амины, диамины (например, этилендиамин NH2CH2CH2NH2), цианиды, органические кислоты, альдегиды, кетоны и многие другие соединения. Железо образует с цианид-ионом и ионом K+ темносиние комплексные ионы, например берлинскую лазурь Kfe[[Fe(CN)6]]. Другим важным комплексным соединением железа является нитропруссид натрия, красная соль состава Na2[[Fe(CN)5NO]]*2H2O, один из редких примеров положительно заряженного лиганда в комплексе: NO+ связан с Fe. Большой интерес для химиков представляет ферроцен Fe(C5H5)2 комплексное соединение Fe(II) c органической молекулой С5H6 (циклопентадиен) в качестве лиганда, имеющее структуру из двух органических молекул, между плоскостями которых находится железо. Такие соединения называются сандвичевыми. Аналогичные соединения образуют Co (кобальтоцен) и Ni (никелоцен).
Карбонилы. Наиболее необычный класс соединений представляют карбонилы, в которых переходный металл с координированными карбонильными группами образует связь с ионом металла или водорода. Пентакарбонил кобальта [[Co(CO)5]] образует натриевую соль Na[[Co(CO)5]], в которой степень окисления кобальта равна I, так как степень окисления CO равна 0. Другие необычные соединения известны для Ni, например, K2[[NiI(CN)3]], K4[[Ni0(CN)4]]. В соединении H2[[Fe(CO)4]] степень окисления железа равна II.
Сульфиды. Сульфиды FeS, CoS и NiS встречаются в составе природных руд. Их получают осаждением сероводородом из растворов солей M(II). FeS можно получить также прямым синтезом из металла и серы при нагревании, а также взаимодействием сероводорода с Fe2S3 при высоких температурах (7501000° С) в атмосфере H2.
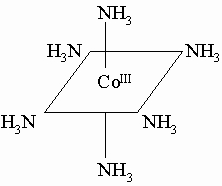
Стереохимия. Соединения металлов триады железа отличаются разнообразием строения. Двухвалентные Ni(II) и Co(II) могут образовывать ионы со структурой типа плоского квадрата, тетраэдра или октаэдра; комплексные соединения Co(III) и Fe(III), как правило, содержат по 6 лигандов и имеют октаэдрические ионы, например
ЖЕЛЕЗА ХЛОРИДЫ - ЖЕЛЕ́ЗА ХЛОРИ́ДЫ: FeCl2 и FeCl3. Образуют кристаллогидраты, напр., FeCl3·6H2O - протрава при крашении тканей, коагулянт при очистке воды, катализатор.
ЖЕЛЕЗА ХЛОРИДЫ: FeCl2 и FeCl3. Образуют кристаллогидраты - напр., FeCl3.6H2O - протрава при крашении тканей, коагулянт при очистке воды, катализатор.