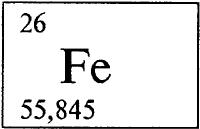Толковый словарь
ср.
1. Химический элемент, твёрдый ковкий металл серебристого цвета, образующий в соединении с углеродом сталь и чугун.
2. разг.
Лекарственный препарат, содержащий соединения такого элемента.
3. Малоуглеродистая сталь.
отт. разг. Изделия из такой стали.
Толковый словарь Ушакова
ЖЕЛЕ́ЗО, железа, мн. (только устар. поэт.) железы, ср.
1. только ед. Самый распространенный в природе тяжелый металл серебристого цвета, с примесью разных количеств углерода, образующий сталь и чугун. Изделия из железа.
|| Химический элемент из группы металлов (хим.). Зеленая окраска листьев и красная окраска крови обусловлены присутствием в организмах железа.
2. только ед., собир. Железные предметы, изделия из железа (спец.). Торговать железом.
3. только ед. Лекарственный препарат из железистых веществ (мед.). Он принимает железо от малокровия.
4. только мн. Цепи, оковы (устар. поэт.). «Увы! Куда ни брошу взор, везде бичи, везде железы.» Пушкин.
• Заковать в железо кого (книжн. устар.) - надеть на кого-нибудь кандалы.
Толковый словарь Ожегова
ЖЕЛЕ́ЗО, -а, ср.
1. Химический элемент, серебристо-белый металл, главная составная часть чугуна и стали.
2. Изделия из такого металла. Кровельное ж.
3. Лекарство, содержащее препараты такого химического элемента. Принимать ж.
| прил. железный, -ая, -ое (к 1 и 2 знач.). Железная руда. Ж. гвоздь. Ж. век (период древней культуры, характеризующийся производством орудий труда и оружия из железа).
Толковый словарь Даля
ЖЕЛЕЗО - ср. зале(и)зо южн., зап. металл, крушец, выплавляемый из руды в виде чугуна, и выковываемый из сего последнего под кричным молотом. В соединении с углеродом, оно образует сталь. В продажу железо идет в виде: полосового или сортового; первое прямо из под кричного молота; оно бывает: широкое, узкое, круглое, брусковое и пр. второе перековано: шинное, резное, листовое и пр. Ржа железо ест. Моль одежду, ржа железо, а худое братство нравы тлит. Деньги железо, а платье тлен. При рати железо дороже золота. Железом и золота добуду. Ржавое железо не блестит. Заруби деревом на железе. Что ощерился, аль железо увидал? В огне и железо плавко. В горну и железо надсядется. На то дорогу золотом устлали, чтоб она железо ела. Куй железо, пока кипит (пока горячо). Лезу я, лезу по железу на мясную гору? садиться на лошадь. Железо или мн. железа, вязи, оковы, кандалы, ножные, ручные цепи; железные конские путы. Железко, железце ср. железный обломок; мелкая железная, стальная вещь, вставляемая в какое-либо орудие или колодку, напр. копьецо стрелы, резец рубанка, железная часть долота и пр. Железный, из железа сделанный, почему-либо к железу относящийся; подобный железу по крепости, жесткости, цвету и пр. Железная руда, из которой добывается железо; железный завод, заведение, где оно выплавляется, выковывается; железный ряд, где оно продается железными торговцами. Железный сок, ·заводск. брызги и отломки от крицы, кричный сок. Железная лошадь, серо-железная, железного цвета, масти. Устюжна железная, а люди в ней каменные, за осаду ее при самозванцах. Железная дорога, железянка, чугунка. Железное колесо, тул. арктический пояс. Железные руки, сильные, но грубые и неуклюжие. Железный человек, стойкий, твердый; терпеливый, спорый;
| немилосердый, бездушный. Железное здоровье, крепкое. Либо железную цепь, либо золотую, добуду. Ссуды пишут на железной доске, а долги на песке. Железное дерево, бакаут, гваяк; ·наз. так ·и·др. весьма твердые тропической породы дерева. Железный корень, растение Centaurea scabiosa. Железный урок или железное ср., ·стар. пеня, пошлина с виновного, в пользу властей, за наложение оков. Железовая лошадь, см. масть. Железистый прил. содержащий в себе железо. Железина, окал, окалина, гарь, огарки; железная, горелая блестка, осыпающаяся во время ковки.
| Кусок, полоса железа. Железня, железняга жен., архан. железная плиточка в ладонь, для игры в бабки, в козны; биток, битка. Железник муж. дерево Caragana frutescens, дереза, чапыжник, ошибочно чилижник, сибирек? кустовая акация.
| Ракитник, дереза, Cytisus biflorus.
| Equisetum, хвощ столярный.
| Potentilla argentea, червичник, горлянка, забируха. Железница, рыба Clupea alosa, из рода сельдей, бешенка или верховодка. Железняк муж. торговец железом.
| Общее название руд, содержащих окисленное железо и похожих видом на камень, а не на железо: б.ч. известны: бурый и магнитный железняк, магнитный камень.
| Самый твердый, лучший кирпич, несколько сплавившийся.
| Растен. Verbena offic.
| Растен. Phlomis pungens, качим, перекати-поле.
| Растен. Sarrothamnus scoparius, жерновец, дереза, бобровик.
| Сказочная разрывили спрыг-трава, от которой железные замки и запоры рассыпаются; ею же добывают и клады. Железнянка, см. железнянка, железа, желвь. Железоделательный, железодельный завод, железный, выделывающий железо из руды. Железоковательный, железоковный, относящийся до выковки железа в полосах и самых крупных вещах. Железоплавиленный, железоплавильный, железоплавный, относящийся к выплавке железа; - завод, - печь. Железорезный, служащий к резке железа; -завод, -стан.
Словарь существительных
ЖЕЛЕ́ЗО, -а, ср
Химический элемент, ковкий металл серебристого цвета, образующий в соединении с углеродом сталь и чугун.
В чистом виде железо встречается редко, но, будучи основой для получения сталей и чугуна, его выплавка показывает уровень развития тяжелой промышленности.
Энциклопедический словарь
ЖЕЛЕ́ЗО -а; ср.
1. Химический элемент (Fe), ковкий металл серебристого цвета, образующий в соединении с углеродом сталь и чугун.
2. Обиходное название малоуглеродистой стали, металла серебристого цвета. Ковать ж. Ветер стучит железом крыши.
3. О том, что является сильным, твёрдым, крепким (о внешних физических качествах). Руки у тебя - ж.! // О том, что является жёстким, непреклонным (о внутренних моральных качествах). Характер у него - ж.
4. Разг. О лекарстве, содержащем железистые вещества. Организму не хватает железа. Пить ж. Яблоки содержат ж.
5. Разг. техн. Аппаратные средства компьютера (в отличие от программных средств). Купить недостающее железо.
◊ Выжечь калёным желе́зом. Искоренять, уничтожать что-л., прибегая к крайним, чрезвычайным мерам. Куй желе́зо, пока горячо (см. Кова́ть).
◁ Желе́зный; Желе́зистый; Желе́зка; Желе́зина (см.).
* * *
желе́зо (лат. Ferrum), химический элемент VIII группы периодической системы. Блестящий серебристо-белый металл. Образует полиморфные модификации; при обычной температуре устойчиво α-Fe (кристаллическая решётка - кубическая объёмно-центрированная) с плотностью 7,874 г/см3. α-Fe вплоть до 769°C (точка Кюри) ферромагнитно; tпл 1535°C. На воздухе окисляется - покрывается рыхлой ржавчиной. По распространённости элементов в природе железо находится на 4-м месте; образует около 300 минералов. На долю сплавов железа с углеродом и другими элементами приходится около 95% всей металлической продукции (чугун, сталь, ферросплавы). В чистом виде практически не используется (в быту железными часто называют стальные или чугунные изделия). Необходимо для жизнедеятельности животных организмов; входит в состав гемоглобина.
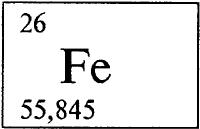
* * *
ЖЕЛЕЗО - ЖЕЛЕ́ЗО (лат. Ferrum), Fe (читается «феррум»), химический элемент, атомный номер 26, атомная масса 55,847. Происхождение как латинского, так и русского названий элемента однозначно не установлено. Природное железо представляет собой смесь четырех нуклидов (см. НУКЛИД) с массовыми числами 54 (содержание в природной смеси 5,82% по массе), 56 (91,66%), 57 (2,19%) и 58 (0,33%). Конфигурация двух внешних электронных слоев 3s2p6d64s2. Обычно образует соединения в степенях окисления +3 (валентность III) и +2 (валентность II). Известны также соединения с атомами железа в степенях окисления +4, +6 и некоторых других.
В периодической системе Менделеева железо входит в группу VIIIВ. В четвертом периоде, к которому принадлежит и железо, в эту группу входят также кобальт (см. КОБАЛЬТ) и никель (см. НИКЕЛЬ). Эти три элемента образуют триаду и обладают сходными свойствами.
Радиус нейтрального атома железа 0,126 нм, радиус иона Fe2+ - 0,080 нм, иона Fe3+ - 0,067 нм. Энергии последовательной ионизации атома железа 7,893, 16,18, 30,65, 57, 79 эВ. Сродство к электрону 0,58 эв. По шкале Полинга электроотрицательность железа около 1,8.
Железо высокой чистоты - это блестящий серебристо-серый, пластичный металл, хорошо поддающийся различным способам механической обработки.
Нахождение в природе
В земной коре железо распространено достаточно широко - на его долю приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красные железняки (руда гематит (см. ГЕМАТИТ), Fe2O3; содержит до 70% Fe), магнитные железняки (руда магнетит (см. МАГНЕТИТ), Fe3О4; содержит 72,4% Fe), бурые железняки (руда гидрогетит НFeO2·nH2O), а также шпатовые железняки (руда сидерит (см. СИДЕРИТ), карбонат железа, FeСО3; содержит около 48% Fe). В природе встречаются также большие месторождения пирита (см. ПИРИТ) FeS2 (другие названия - серный колчедан, железный колчедан, дисульфид железа и другие), но руды с высоким содержанием серы пока практического значения не имеют. По запасам железных руд Россия занимает первое место в мире. В морской воде 1·10-5-1·10-8% железа.
История получения железа
Железо играло и играет исключительную роль в материальной истории человечества. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и часто встречаются даже на поверхности Земли, но самородное железо на поверхности крайне редко. Вероятно, еще несколько тысяч лет назад человек заметил, что после горения костра в некоторых случаях наблюдается образование железа из тех кусков руды, которые случайно оказались в костре. При горении костра восстановление железа из руды происходит за счет реакции руды как непосредственно с углем, так и с образующимся при горении оксидом углерода (II) СО. Возможность получения железа из руд существенно облегчило обнаружение того факта, что при нагревании руды с углем возникает металл, который далее можно дополнительно очистить при ковке. Получение железа из руды с помощью сыродутного процесса было изобретено в Западной Азии во 2-м тыс. до н. э. Период с 9 по 7 в. до н. э., когда у многих племен Европы и Азии развилась металлургия железа, получил название железного века, (см. ЖЕЛЕЗНЫЙ ВЕК) пришедшего на смену бронзовому веку (см. БРОНЗОВЫЙ ВЕК). Усовершенствование способов дутья (естественную тягу сменили меха) и увеличение высоты горна (появились низкошахтные печи - домницы) привело к получению чугуна, который стали широко выплавлять в Западной Европе с 14 века. Полученный чугун переделывали в сталь. С середины 18 века в доменном процессе вместо древесного угля начали использовать каменно-угольный кокс (см. КОКС). В дальнейшем способы получения железа из руд были значительно усовершенствованы, и в настоящее время для этого используют специальные устройства - домны, кислородные конвертеры, электродуговые печи.
Физические и химические свойства
При температурах от комнатной и до 917 °C, а также в интервале температур 1394-1535 °C существует a-Fe с кубической объемно центрированной решеткой, при комнатной температуре параметр решетки а = 0,286645 нм. При температурах 917-1394 °C устойчиво b-Fe с кубической гранецентрированной решеткой Т (а = 0,36468 нм). При температурах от комнатной до 769 °C (так называемая точка Кюри (см. КЮРИ ТОЧКА)) железо обладает сильными магнитными свойствами (оно, как говорят, ферромагнитно), при более высоких температурах железо ведет себя как парамагнетик. Иногда парамагнитное a-Fe с кубической объемно центрированной решеткой, устойчивое при температурах от 769 до 917 °C, рассматривают как g-модификацию железа, а b-Fe, устойчивое при высоких температурах (1394-1535 °C), называют по традиции d-Fe (представления о существовании четырех модификаций железа - a, b, g и d- возникли тогда, когда еще не существовал рентгеноструктурный анализ и не было объективной информации о внутреннем строении железа). Температура плавления 1535 °C, температура кипения 2750 °C, плотность 7,87 г/см3. Стандартный потенциал пары Fe2+/Fe0 -0,447В, пары Fe3+/Fe2+ +0,771В.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближенно ее химическую формулу можно записать как Fe2О3·хН2О.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe2О3, при сгорании в чистом кислороде - оксид Fe3О4. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeО. При нагревании порошка серы и железа образуется сульфид, приближенную формулу которого можно записать как FeS.
Железо при нагревании реагирует с галогенами (см. ГАЛОГЕНЫ). Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200-300°C. При хлорировании железа (при температуре около 200°C) образуется летучий FeСl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeСl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа (II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с монооксидом углерода СО, причем образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена (см. ФЕРРОЦЕН) состава [Fe(-C5H5)2].
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная пленка пассивирует его поверхность.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа (II):
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа (III):
2Fe + 4H2SO4 = Fe2(SO4)3 + SO2 + 4H2O
Оксид железа (II) FeО обладает основными свойствами, ему отвечает основание Fe(ОН)2. Оксид железа (III) Fe2O3 слабо амфотерен, ему отвечает еще более слабое, чем Fe(ОН)2, основание Fe(ОН)3, которое реагирует с кислотами:
2Fe(ОН)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Гидроксид железа (III) Fe(ОН)3 проявляет слабо амфотерные свойства; он способен реагировать только с концентрированными растворами щелочей:
Fe(ОН)3 + КОН = К[Fe(ОН)4]
Образующиеся при этом гидроксокомплексы железа (III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причем в осадок выпадает гидроксид железа (III) Fe(OH)3.
Соединения железа (III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 = 3FeCl2
При хранении водных растворов солей железа (II) наблюдается окисление железа (II) до железа (III):
4FeCl2 + O2 + 2H2O = 4Fe(OH)Cl2
Из солей железа (II) в водных растворах устойчива соль Мора - двойной сульфат аммония и железа (II) (NH4)2Fe(SO4)2·6Н2О.
Железо (III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 - железокалиевые квасцы, (NH4)Fe(SO4)2 - железоаммонийные квасцы и т. д.
При действии газообразного хлора или озона на щелочные растворы соединений железа (III) образуются соединения железа (VI) - ферраты, например, феррат (VI) калия K2FeO4. Имеются сообщения о получении под действием сильных окислителей соединений железа (VIII).
Для обнаружения в растворе соединений железа (III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами CNS-. При взаимодействии ионов Fe3+ с анионами CNS- образуется ярко-красный роданид железа Fe(CNS)3. Другим реактивом на ионы Fe3+ служит гексацианоферрат (II) калия K4[Fe(CN)6] (ранее это вещество называли желтой кровяной солью). При взаимодействии ионов Fe3+ и [Fe(CN)6]4- выпадает ярко-синий осадок.
Реактивом на ионы Fe2+ в растворе может служить раствор гексацианоферрат (III) калия K3[Fe(CN)6], ранее называвшийся красной кровяной солью. При взаимодействии ионов Fe3+ и [Fe(CN)6]3- выпадает ярко-синий осадок такого же состава, как и в случае взаимодействия ионов Fe3+ и [Fe(CN)6]4-.
Сплавы железа с углеродом
Железо используется главным образом в сплавах, прежде всего в сплавах с углеродом - различных чугунах и сталях. В чугуне содержание углерода выше 2,14 % по массе (обычно - на уровне 3,5-4%), в сталях содержание углерода более низкое (обычно на уровне 0,8-1 %).
Чугун получают в домнах. Домна представляет собой гигантский (высотой до 30-40 м) усеченный конус, полый внутри. Стенки домны изнутри выложены огнеупорным кирпичом, толщина кладки составляет несколько метров. Сверху в домну вагонетками загружают обогащенную (освобожденную от пустой породы) железную руду, восстановитель кокс (каменный уголь специальных сортов, подвергнутый коксованию - нагреванию при температуре около 1000 °C без доступа воздуха), а также плавильные материалы (известняк и другие), способствующие отделению от выплавляемого металла примесей - шлака. Снизу в домну подают дутье (чистый кислород или воздух, обогащенный кислородом). По мере того, как загруженные в домну материалы опускаются, их температура поднимается до 1200-1300 °C. В результате реакций восстановления, протекающих главным образом с участием кокса С и СО:
Fe2O3 + 3C = 2Fe + 3CO;
Fe2O3 + 3CО = 2Fe + 3CO2
возникает металлическое железо, которое насыщается углеродом и стекает вниз.
Этот расплав периодически выпускают из домны через специальное отверстие - летку - и дают расплаву застыть в специальных формах. Чугун бывает белый, так называемый передельный (его используют для получения стали) и серый, или литьевой. Белый чугун - это твердый раствор углерода в железе. В микроструктуре серого чугуна можно различить микрокристаллики графита. Из-за наличия графита серый чугун оставляет след на белой бумаге.
Чугун хрупок, при ударе он колется, поэтому из него нельзя изготавливать пружины, рессоры, любые изделия, которые должны работать на изгиб.
Твердый чугун легче расплавленного, так что при его затвердевании происходит не сжатие (как обычно при затвердевании металлов и сплавов), а расширение. Эта особенность позволяет изготавливать из чугуна различные отливки, в том числе использовать его как материал для художественного литья.
Если содержание углерода в чугуне снизить до 1,0-1,5%, то образуется сталь. Стали бывают углеродистыми (в таких сталях нет других компонентов, кроме Fe и C) и легированными (такие стали содержат добавки хрома, никеля, молибдена, кобальта и других металлов, улучшающие механические и иные свойства стали).
Стали получают, перерабатывая чугун и металлический лом в кислородном конвертере, в электродуговой или мартеновской печах. При такой переработке снижается содержание углерода в сплаве до требуемого уровня, как говорят, избыточный углерод выгорает.
Физические свойства стали существенно отличаются от свойств чугуна: сталь упруга, ее можно ковать, прокатывать. Так как сталь, в отличие от чугуна, при затвердевании сжимается, то полученные стальные отливки подвергают обжатию на прокатных станах. После прокатки в объеме металла исчезают пустоты и раковины, появившиеся при затвердевании расплавов.
Производство сталей имеет в России давние глубокие традиции, и полученные нашими металлургами стали отличаются высоким качеством.
Применение железа, его сплавов и соединений
Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении сердечников электромагнитов, как катализатор химических процессов, для некоторых других целей. Но сплавы железа - чугун и сталь - составляют основу современной техники. Находят широкое применение и многие соединения железа. Так, сульфат железа (III) используют при водоподготовке, оксиды и цианид железа служат пигментами при изготовлении красителей и так далее.
Железо в организме
Железо присутствует в организмах всех растений и животных как микроэлемент, (см. МИКРОЭЛЕМЕНТЫ) то есть в очень малых количествах (в среднем около 0,02%). Однако железобактерии (см. ЖЕЛЕЗОБАКТЕРИИ), использующие энергию окисления железа (II) в железо (III) для хемосинтеза (см. ХЕМОСИНТЕЗ), могут накапливать в своих клетках до 17-20% железа. Основная биологическая функция железа - участие в транспорте кислорода и окислительных процессах. Эту функцию железо выполняет в составе сложных белков - гемопротеидов (см. ГЕМОПРОТЕИДЫ), простетической группой которых является железопорфириновый комплекс - гем (см. ГЕМ). Среди важнейших гемопротеидов дыхательные пигменты гемоглобин (см. ГЕМОГЛОБИН) и миоглобин, (см. МИОГЛОБИН) универсальные переносчики электронов в реакциях клеточного дыхания, окисления и фотосинеза цитохромы, (см. ЦИТОХРОМЫ) ферменты каталоза и пероксида, и других. У некоторых беспозвоночных железосодержащие дыхательные пигменты гелоэритрин и хлорокруорин имеют отличное от гемоглобинов строение. При биосинтезе гемопротеидов железо переходит к ним от белка ферритина (см. ФЕРРИТИН), осуществляющего запасание и транспорт железа. Этот белок, одна молекула которого включает около 4 500 атомов железа, концентрируется в печени, селезенке, костном мозге и слизистой кишечника млекопитающих и человека. Суточная потребность человека в железе (6-20 мг) с избытком покрывается пищей (железом богаты мясо, печень, яйца, хлеб, шпинат, свекла и другие). В организме среднего человека (масса тела 70 кг) содержится 4,2 г железа, в 1 л крови - около 450 мг. При недостатке железа в организме развивается железистая анемия, которую лечат с помощью препаратов, содержащих железо. Препараты железа применяются и как общеукрепляющие средства. Избыточная доза железа (200 мг и выше) может оказывать токсичное действие. Железо также необходимо для нормального развития растений, поэтому существуют микроудобрения на основе препаратов железа.
Большой энциклопедический словарь
ЖЕЛЕЗО (лат. Ferrum) - Fe, химический элемент VIII группы периодической системы, атомный номер 26, атомная масса 55,847. Блестящий серебристо-белый металл. Образует полиморфные модификации; при обычной температуре устойчиво ? -Fe (кристаллическая решетка - кубическая объемноцентрированная) с плотностью 7,874 г/см³. ? -Fe вплоть до 769 .С (точка Кюри) ферромагнитно; tпл 1535 .С. На воздухе окисляется - покрывается рыхлой ржавчиной. По распространенности элементов в природе железо находится на 4-м месте; образует ок. 300 минералов. На долю сплавов железа с углеродом и другими элементами приходится ок. 95% всей металлической продукции (чугун, сталь, ферросплавы). В чистом виде практически не используется (в быту железными часто называются стальные или чугунные изделия). Необходимо для жизнедеятельности животных организмов; входит в состав гемоглобина.
Академический словарь
-а, ср.
1. Химический элемент, тяжелый ковкий металл серебристого цвета, образующий в соединении с углеродом сталь и чугун.
2. Обиходное название малоуглеродистых сталей.
Изделия из железа.
|| собир.
Изделия из этого металла.
Листовое железо. Кровельное железо.
3. разг.
Лекарство, содержащее железистые1 вещества.
Прописать железо.
4. мн. ч. (желе́зы, -ле́з). устар. Цепи, оковы.
Увы! куда ни брошу взор - Везде бичи, везде железы. Пушкин, Вольность.
[Харков] попал к палачу на помост, а потом в железы за то, что убил стрелецкого голову. Злобин, Степан Разин.
◊
- каленым железом выжечь
- куй железо, пока горячо
Энциклопедия Кольера
Fe (ferrum),
химический элемент VIIIB подгруппы периодической системы элементов, металл, член триады железа (Fe, Co, Ni). Железо самородное редко встречается в природе, главным образом в минералах феррит, аваруит и метеоритах (т.н. метеоритное железо, которое содержит более 90% Fe). В соединениях с кислородом и другими элементами широко распространено в составе многих минералов и руд. По распространенности в земной коре (5,00%) это третий (после кремния и алюминия) элемент; считается, что земное ядро состоит в основном из железа. Основные минералы - гематит (красный железняк) Fe2O3; лимонит Fe2O3*nH2O (n = 1 - 4), содержащийся, например, в болотной руде; магнетит (магнитный железняк) Fe3O4 и сидерит FeCO3. Наиболее распространенным минералом железа, не являющимся, однако, источником его получения, является пирит (серный колчедан, железный колчедан) FeS2, который иногда называют за его желтый блеск золотом дураков или кошачьим золотом, хотя он в действительности часто содержит небольшие примеси меди, золота, кобальта и других металлов. СВОЙСТВА ЖЕЛЕЗА
Атомный номер 26 Атомная масса 55,847 Изотопы
стабильные 54, 56, 57, 58 нестабильные 52, 53, 55, 59
Температура плавления, ° С 1535 Температура кипения, ° С 3000 Плотность, г/см3 7,87 Твердость (по Моосу) 4,0-5,0 Содержание в земной коре, % (масс.) 5,00 Степень окисления
характерная +2, +3 прочие значения +1, +4, +6
Железо (элементное) известно и используется с доисторических времен. Первые изделия из железа, вероятно, были изготовлены из метеоритного железа в виде амулетов, драгоценностей и рабочего инструмента. Около 3500 лет назад человек открыл способ восстановления красной земли, содержащей оксид железа, в металл. С тех пор из железа было изготовлено огромное количество различных изделий. Оно сыграло важную роль в развитии материальной культуры человечества
(см. также ЖЕЛЕЗНЫЙ ВЕК; МЕТАЛЛЫ ЧЕРНЫЕ).
В наши дни железо в основном (95%) выплавляют из руд в виде чугунов и сталей и в сравнительно небольших количествах получают восстановлением металлизованных окатышей, а чистое железо - термическим разложением его соединений или электролизом солей. Железо - один из самых пригодных к эксплуатации металлов в сплаве с углеродом (сталь, чугун) - высокопрочная основа конструкционных материалов. Как материал, обладающий магнитными свойствами, железо используется для сердечников электромагнитов и якорей электромашин, а также в качестве слоев и пленок на магнитных лентах. Чистое железо - катализатор в химических процессах, компонент лекарственных средств в медицине. Железо является существенным химическим компонентом организмов многих позвоночных, беспозвоночных и некоторых растений. Оно входит в состав гема (пигмента эритроцитов - красных кровяных клеток) гемоглобина крови, мышечных тканей, костного мозга, печени и селезенки. Каждая молекула гемоглобина содержит 4 атома железа, которые способны создавать обратимую и непрочную связь с кислородом, образуя оксигемоглобин. Кровь, содержащая оксигемоглобин, циркулирует по телу, поставляя кислород к тканям для клеточного дыхания. Поэтому железо необходимо для дыхания и образования красных кровяных клеток. Миоглобин (или мышечный гемоглобин) снабжает кислородом мышцы. Общее количество железа в человеческом теле (средней массы 70 кг) составляет 3-5 г. Из этого количества 65% Fe находится в гемоглобине. От 10 до 20 мг Fe ежедневно требуется для обеспечения нормального метаболизма среднего взрослого. Красное мясо, яйца, желток, морковь, фрукты, любая пшеница и зеленые овощи в основном обеспечивают организм железом при нормальном питании; при анемии, связанной с недостатком железа в организме, принимают лекарственные препараты железа. См. также АНЕМИЯ; КРОВЬ.
Свойства. Металлическое железо представляет собой серовато-белое блестящее твердое пластичное вещество. Железо кристаллизуется в трех модификациях (a, g, d). a-Fe имеет объемноцентрированную кубическую кристаллическую решетку, химически устойчиво до 910° С. При 910° С a-Fe переходит в g-Fe, стабильное в интервале 910-1400° С; g-Fe кристаллизуется в гранецентрированной кубической кристаллической решетке (см. также АЛЛОТРОПИЯ). При температуре выше 1400° С образуется d-Fe с решеткой, в основном аналогичной решетке a-Fe. Железо - ферромагнетик, оно легко намагничивается, но теряет магнитные свойства при снятии магнитного поля. С повышением температуры магнитные свойства железа ухудшаются и выше 769° С оно практически не поддается намагничиванию (иногда железо в интервале 769-910° С называют b-Fe); g-Fe не является магнитным материалом. С химической точки зрения железо - довольно активный металл, проявляет характерные степени окисления +2, +3, реже +1, +4, +6. Непосредственно соединяется с некоторыми элементами, с S образует FeS - сульфид железа(III), с галогенами, кроме иода, - галогениды железа(III), такие, как FeCl3. Легко окисляется; с кислородом дает оксиды FeO, Fe2O3, Fe3O4 (FeO + Fe2O3), легко корродирует (ржавеет). Вытесняет водород из паров воды при высокой температуре. Растворяется в разбавленных кислотах (например, HCl, H2SO4, HNO3), вытесняя водород и образуя соли Fe(II) (соответственно FeCl2, FeSO4, Fe(NO3)2). В умеренно концентрированных H2SO4 и HNO3 железо растворяется с образованием солей Fe(III), а в сильноконцентрированных - пассивируется и не реагирует. Пассивность железа, по-видимому, объясняется образованием на его поверхности пленки оксида железа, которая, однако, легко разрушается при простом соскабливании. Ржавление железа (атмосферная коррозия железа) - это окисление его кислородом воздуха. Реакция происходит в присутствии ионов солей, растворенных в воде, и ионов, образующихся при диссоциации угольной кислоты - продукта взаимодействия атмосферного углекислого газа и влаги. В результате образуется рыхлая ржавчина красного цвета, или гидратированный оксид состава Fe2O3*nH2O.
См. также КОРРОЗИЯ МЕТАЛЛОВ.
Соединения. Соли железа(II) обычно зеленого цвета, легко окисляются на воздухе. Кристаллогидрат хлорида железа FeCl2Ч4H2O быстро впитывает влагу из окружающей среды. Его используют как протраву в текстильной промышленности и как вяжущее в медицине. Кристаллогидрат сульфата железа(II) FeSO4*7H2O (железный купорос) применяют в производстве чернил, красок, пигментов и как дезинфицирующее средство. При кристаллизации сульфата железа из раствора, содержащего также сульфат аммония, образуется двойной сульфат железа и аммония, или соль Мора FeSO4*(NH4)2*6H2O, устойчивая к окислению на воздухе; ее используют для получения растворов, содержащих ионы Fe(II), пригодные для длительного хранения. Соли Fe(III), обычно красного или желтого цвета, легко восстанавливаются и гидролизуются, образуя кислые растворы. Растворы FeCl3 в спирте или в воде используют для остановки кровотечения или как тонизирующие. FeCl3 применяют также в технологии пигментов и чернил и как протраву при крашении и набивке текстиля. Мелкодисперсный оксид железа(III) Fe2O3 (румяна, или венецианский кармин) - готовый абразив или пигмент.
Комплексные соединения. Ионы Fe(II) и Fe(III) образуют комплексные анионы, например гексацианоферрат(II)-ион Fe(CN)64- и гексацианоферрат(III)-ион Fe(CN)63-. Берлинская лазурь (синий пигмент) - гексацианоферрат(II) железа(III) Fe4[[Fe(CN)6]]3, турнбулева синь (также синий пигмент) - гексацианоферрат(III) железа(II) Fe3[[Fe(CN)6]]2. Комплексные ионы железа часто используют для обнаружения ионов железа(II) и железа(III) по результатам образования окрашенных комплексных соединений. Они применяются также в светокопировальной технике (цианотипная бумага): бумагу пропитывают раствором соли железа(III) и высушивают. При наложении на нее чертежа, выполненного на кальке, и выдержке на свету Fe(III) восстанавливается на освещенных местах до Fe(II) и после проявления бумаги в растворе гексацианоферрата образует комплексное соединение, окрашивающее засвеченные места бумаги в синий цвет. Цианотипная бумага передает изображение белыми линиями на синем фоне.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Конецкая Д.С. и др. Железо высокой степени чистоты. М., 1978 Пикеринг Ф. Физическое металловедение и разработка сталей. М., 1982
Иллюстрированный энциклопедический словарь
ЖЕЛЕЗО (Ferrum), Fe, химический элемент VIII группы периодической системы, атомный номер 26, атомная масса 55,847; металл, tпл 1535°C. Содержание в земной коре 4,65% по массе. Железо входит в состав гемоглобина. Его используют для выплавки чугуна и стали, как материал сердечников электромагнитов и якорей электромашин, для нанесения покрытий на магнитофонные ленты и т.д.
Практический толковый словарь
мед. железо (iron, ferrum)
Основной микроэлемент.
- Повышает количество гемоглобина в крови - красных кровяных телец.
- Необходимо для переноса кислорода красными кровяными тельцами.
Быстрее усваивается вместе с витамином C.
Дефицит железа проявляется в чувстве усталости в течение всего дня, в частых ночных пробуждениях. Увеличивается риск инфекционных заболеваний.
Железо влияет на производство меланина и перенос кислорода в гемоглобине. Кислород требуется для обмена веществ в организме. Железо также принимает участие в производстве множества ферментов.
Железо в наибольшем количестве содержится в печени, в жирных сортах рыбы, в красном мясе, кровяных колбасах, почках, в яичном желтке, в бобовых, в сухофруктах и цельных злаках, в зеленых листовых овощах, зернобобовых, гречневой крупе, пшене и др.
Суточная потребность в железе у мужчин 10 мг, у женщин 12-15 мг.
Сверхдозы железа (несколько десятков таблеток) могут привести к летальному исходу.
Пищевые добавки, содержащие железо противопоказаны при таких заболеваниях, как гемохроматоз, гемосидероз, полиситемия и при некоторых формах анемии.
см. тж микроэлементы
Поговорки
Понюхать железа. Жарг. мол. Шутл. Послушать музыку в стиле «тяжёлый металл». Максимов, 129.
Гнуть (качать, таскать) железо. Жарг. мол. Заниматься культуризмом, бодибилдингом. Елистратов 1994, 133; Максимов, 88, 130.
Ковать железо, пока горячо. Разг. Не терять времени, используя благоприятные обстоятельства. Ф 1, 241.
Выжигать калёным железом что. Разг. Искоренять, уничтожать что-л., прибегая к крайним мерам. ФСРЯ, 93; Ф 1, 92. // Всецело, полностью, без остатка искоренять, уничтожать что-л. БМС 183; БТС, 171, 301.
Хвастаться железом. Жарг. угол. Шутл.-ирон. Улыбаться. ТСУЖ, 55.
На железах. Новг. На железном ходу. НОС 2, 125.
Словарь русского арго
ЖЕЛЕЗО, -а, с.
1. Надежный человек.
Серега - он железо, после трех бутылок приползет.
2. Металлический рок.
3. Мелочь, металлические деньги.
4. Приспособления для занятий атлетизмом (гири, гантели и т. п.).
Заниматься железом.
Я бросил железо, только бегаю.
5. Машина, обычно плохая.
На советском железе катаюсь.
6. в зн. нареч. То же, что железно.
Никому не проболтаешься? - железо!
7. Аппаратное обеспечение компьютера (процессор, память, диски и т. п.).
8. Мужской половой орган.
См. также железка
2. и 3. - ср. металл; 7. - из жаргона пользователей компьютеров.
Словарь сленга
Коронки, вставные металлические зубы.
Орфографический словарь
Формы слов для слова железо
желе́зо, желе́за, желе́з, желе́зу, желе́зам, желе́зом, желе́зами, желе́зе, желе́зах
Синонимы к слову железо
сущ., кол-во синонимов: 18
ферро; феррум, крица; аппаратное обеспечение
Морфемно-орфографический словарь
Грамматический словарь
Этимология
Общеславянское слово, восходящее к той же основе gel, что и желвак, железа и т. п. Основа gel когда-то имела значение "камень", а смысловой переход с камня на название металла произошел в силу того, что железо в породе имеет вид камня.
Этимологический словарь
Древнерусское - железо.
Старославянское - железо.
Происхождение и точное время появления в языке слова остается невыясненным. Существует мнение, что слово образовалось в древнем неизвестном языке Европы. В древнерусском языке впервые зафиксировано в XI в.
Некоторые исследователи указывают на возможность образования слова от общеславянской основы gel с обобщенным значением «твердый».
Железо - самый распространенный в природе металл.
Родственным являются:
Польское - zelazo.
Производное: железный.
Этимологический словарь русского языка
Общесл. Ооразовано от *ge с помощью суф. -го прусск. gelso - «железо», греч. chalkos-»медь»): *gelzo > железо в силу изменения г в ж в результате первой палатализации заднеязычных ч развития полногласия.
Этимологический словарь
Общеслав. Суф. производное (суф. -z-, ср. с другим суф. польск. żeliwo «чугун») от той же основы (*gel-), что и желвак, голова, глаз. Металл был назван словом, ранее обозначавшим камень и кость по той же функции и сходству с последними.
желе́зо
диал. зеле́зо, зяле́зо, укр. залíзо, желíзо, блр. зеле́зо, зале́зо, ст.-слав. желѣзо σίδηρος, желѣзнъ σιδηροῦς, болг. желя́зо, сербохорв. жѐС™езо, словен. želézo, чеш., слвц. železo, польск. żelazo, в.-луж., н.-луж. železo.
Родственно лит. geležìs, жем. gelžìs, лтш. dzèlzs, далее - греч. гомер. χαλκός "медь, бронза"; см. И. Шмидт, Vok. 2, 67; Шрадер, Sprachvgl. 2, 65; Траутман, BSW 83; Шпехт 26 и сл.; Младенов 165; Брандт, РФВ 25, 224; М. - Э. 1, 543 и сл. Согласно Мейе (BSL 24, 138), Мейе - Вайану (510 и сл.), Микколе (Balt. und Slav. 41), заимств. в древности из неизвестного вост. языка. Сюда же относили название занимающихся ковкой меди Τελχῖνες, Θελγῖνες, но см. Шпехт, там же. [Праслав. *žel-zo, скорее всего, родственно ст.-слав. желы "черепаха", греч. χέλυς - то же, русск. желва́к, голова́, польск. gɫaz "камень" с общим исходным знач. "камень". Мысль о заимствовании из не-и.-е. языков ошибочна; см. Трубачев, ВСЯ, 2, 1957, стр. 31 и сл. - Т.]
Сканворды для слова железо
- Металл, из которого может быть «сделана» логика.
- Жертва ржавчины.
- Куй его, пока горячо!
- Металл, из которого сделан Феликс.
- Куётся только сгоряча.
- Резцы бобров имеют рыжий оттенок из-за высокого содержания в эмали этого элемента.
- Во времена Гомера греки ещё не умели плавить этот металл, ведь не зря поэт называет его «для выделки трудным».
- Металл, давший название веку.
- Материал для одной маски.
- Так у компьютерщиков именуется сам компьютер, без программного обеспечения.
- Самый устойчивый элемент Периодической системы Менделеева.
- «Иду в воду - красно, выйду - черно» (загадка).
- Переведите с латинского слово «феррум».
- Химический элемент, Fe.
- Нехватка какого вещества в крови чаще всего приводит к анемии?
- За высокое содержание этого элемента в местной воде первый русский курорт, появившийся при Петре I в Карелии, получил название Марциальные Воды - в честь Марса.
- Атомиум, созданный к Всемирной выставке в Брюсселе представляет собой фрагмент кристаллической решётки этого элемента, увеличенный в 165 миллиардов раз.
- У человека и животных запасы этого микроэлемента накапливаются в особом белковом комплексе - ферритине.
- Английским крестьянам изделия из этого металла служили оберегом против злых фей и эльфов.
- Кровавый водопад, протекающий в Антарктиде, назван так благодаря наличию большого количества оксидов этого металла в воде.
- Когда к византийскому императору Маркиану пришли посланцы Аттилы с требованием дани, тот ответил: «Золото у меня для друзей, для врагов же ...».
- Чтобы избежать накопления денег, в древней Спарте деньги чеканились из этого материала.
- Материал, из которого должен быть сделан подарок, преподнесённый к шестой годовщине свадьбы.
- Палласово ...
- Издревле руда из Бискайи славится отсутствием вредных примесей серы и фосфора и высоким содержанием его.
- Химический элемент, металл.
- Металлические части уздечки.
Полезные сервисы