м.
1. Химический элемент, серебристо-белый твёрдый металл с красноватым оттенком, применяющийся в технике и медицине.
2. Минерал, содержащий в себе этот металл.
3. Прочная ярко-синяя краска, в состав которой входит этот металл.
м.
1. Химический элемент, серебристо-белый твёрдый металл с красноватым оттенком, применяющийся в технике и медицине.
2. Минерал, содержащий в себе этот металл.
3. Прочная ярко-синяя краска, в состав которой входит этот металл.
КО́БАЛЬТ, кобальта, мн. нет, муж. (нем. Kobalt).
1. Химический элемент со свойствами металла (хим.).
2. Краска темно-синего цвета в виде порошка (шмальта), содержащая этот металл (торг.).
3. в знач. неизм. прил. Цвета этой краски (разг., редк.). Фарфоровая чашка цвета кобальта.
КО́БАЛЬТ, -а, муж. Химический элемент, твёрдый серебристо-белый металл с красноватым отливом.
| прил. кобальтовый, -ая, -ое. К. сплав.
КОБАЛЬТ - муж. металл сероватого цвета, в разных ископаемых, которые, по виду, называются: кобальтом белым, красным и пр. Кобальтовый, содержащий кобальт, к нему относящийся. Кобальтовые цветы, красный мышьяковый кобальт.
КО́БАЛЬТ, -а, м
Химический элемент, серебристо-белый металл с красноватым отливом, более твердый, чем железо.
В основном кобальт используется для получения кобальтовых сплавов: магнитных, жаропрочных, сверхтвердых, коррозийностойких и др.
КО́БАЛЬТ -а; м. [нем. Kobalt]
1. Химический элемент (Co), серебристо-белый металл с красноватым отливом, более твёрдый, чем железо.
2. Краска тёмно-синего цвета, в состав которой входит этот металл.
◁ Ко́бальтовый, -ая, -ое. К-ые руды. К-ая сталь. К-ая краска.
* * *
ко́бальт (лат. Cobaltum), химический элемент VIII группы периодической системы. Название от немецкого Kobold - домовой, гном. Серебристо-белый металл с красноватым оттенком; плотность 8,9 г/см3, tпл1494ºC; ферромагнитен (точка Кюри 1121ºC). При обычной температуре на воздухе химически стоек. Минералы редки, добывается из руд никеля. В основном кобальт используется для получения кобальтовых сплавов (магнитные, жаропрочные, сверхтвёрдые, коррозионностойкие и др.). Радиоактивный изотоп 60Co используют как источник γ-излучения в медицине и технике. Кобальт важен для жизни растений и животных, входит в состав витамина B12.
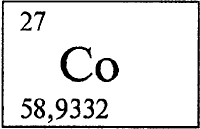
* * *
КОБАЛЬТ - КО́БАЛЬТ (лат. Сobaltum), Со, химический элемент с атомным номером 27, атомная масса 58,9332. Химический символ элемента Cо произносится так же, как и название самого элемента. Природный кобальт состоит из двух стабильных нуклидов (см. НУКЛИД): 59Со (99,83% по массе) и 57Со (0,17%). В периодической системе элементов Д. И. Менделеева кобальт входит в группу VIIIВ и вместе с железом (см. ЖЕЛЕЗО)и никелем (см. НИКЕЛЬ)образует в 4-м периоде в этой группе триаду близких по свойствам переходных металлов. Конфигурация двух внешних электронных слоев атома кобальта 3s2p6d74s2. Образует соединения чаще всего в степени окисления +2 (валентность II), реже - в степени окисления +3 (валентность III) и очень редко в степенях окисления +1, +4 и +5 (валентности, соответственно, I, IV и V).
Радиус нейтрального атома кобальта 0,125 нм, радиус ионов (координационное число 6) Со2+ - 0,082 нм, Со3+ - 0,069 нм и Со4+ - 0,064 нм. Энергии последовательной ионизации атома кобальта 7,865, 17,06, 33,50, 53,2 и 82,2 эВ. По шкале Полинга электроотрицательность кобальта 1,88. Кобальт - блестящий, серебристо-белый, тяжелый металл с розоватым оттенком.
История открытия
С древности оксиды кобальта использовались для окрашивания стекол и эмалей в глубокий синий цвет. До 17 века секрет получения краски из руд держался в тайне. Эти руды в Саксонии называли «кобольд» (нем. Kobold - домовой, злой гном, мешавший рудокопам добывать руду и выплавлять из нее металл). Честь открытия кобальта принадлежит шведскому химику Г. Брандту (см. БРАНДТ Георг). В 1735 году он выделил из коварных «нечистых» руд новый серебристо-белый со слабым розоватым оттенком металл, который предложил называть «кобольдом». Позднее это название трансформировалось в «кобальт».
Нахождение в природе
В земной коре содержание кобальта равно 410-3% по массе. Кобальт входит в состав более 30 минералов. К ним относятся каролит CuCo2S4, линнеит Co3S4, кобальтин (см. КОБАЛЬТИН)CoAsS, сферокобальтит CoCO3, смальтит СоAs2 и другие. Как правило, кобальту в природе сопутствуют его соседи по 4-му периоду - никель, железо, медь (см. МЕДЬ)и марганец (см. МАРГАНЕЦ (химический элемент)). В морской воде приблизительно (1-7)·10-10 % кобальта.
Получение
Кобальт - относительно редкий металл, и богатые им месторождения в настоящее время практически исчерпаны. Поэтому кобальтсодержащее сырье (часто это никелевые руды, содержащие кобальт как примесь) сначала обогащают, получают из него концентрат. Далее для извлечения кобальта концентрат или обрабатывают растворами серной кислоты или аммиака, или методами пирометаллургии перерабатывают в сульфидный или металлический сплав. Этот сплав затем выщелачивают серной кислотой. Иногда для извлечения кобальта проводят сернокислотное «кучное» выщелачивание исходной руды (измельченную руду размещают в высоких кучах на специальных бетонных площадках и сверху поливают эти кучи выщелачивающим раствором).
Для очистки кобальта от сопутствующих примесей все более широко применяют экстракцию. Наиболее сложная задача при очистке кобальта от примесей - это отделение кобальта от наиболее близкого к нему по химическим свойствам никеля. Раствор, содержащий катионы двух этих металлов, часто обрабатывают сильными окислителями - хлором или гипохлоритом натрия NaOCl; кобальт при этом переходит в осадок. Окончательную очистку (рафинирование) кобальта осуществляют электролизом его сульфатного водного раствора, в который обычно добавлена борная кислота Н3ВО3.
Физические и химические свойства
Кобальт - твердый металл, существующий в двух модификациях. При температурах от комнатной до 427°C устойчива альфа-модификация (кристаллическая решетка гексагональная с параметрами а=0,2505 нм и с=0,4089 нм). Плотность 8,90 кг/дм3. При температурах от 427°C до температуры плавления (1494°C) устойчива бета-модификация кобальта (решетка кубическая гранецентрированная). Температура кипения кобальта около 2960°C. Кобальт - ферромагнетик, (см. Ферромагнетизм (см. ФЕРРОМАГНЕТИЗМ)), точка Кюри (см. КЮРИ ТОЧКА) 1121°C. Стандартный электродный потенциал Со0/Со2+ -0,29 B.
На воздухе компактный кобальт устойчив, при нагревании выше 300°C покрывается оксидной пленкой (высокодисперсный кобальт пирофорен (см. ПИРОФОРНЫЕ МЕТАЛЛЫ)). С парами воды, содержащимися в воздухе, водой, растворами щелочей и карбоновых кислот кобальт не взаимодействует. Концентрированная азотная кислота пассивирует поверхность кобальта, как пассивирует она и поверхность железа.
Известно несколько оксидов кобальта. Оксид кобальта (II) СоО обладает основными свойствами. Он существует в двух полиморфных модификациях: альфа-форма (кубическая решетка), устойчивая при температурах от комнатной до 985°C, и существующая при высоких температурах бета-форма (также кубическая решетка). СоО можно получить или нагреванием в инертной атмосфере гидроксоркарбоната кобальта Со(ОН)2СоСО3, или осторожным восстановлением Со3О4.
Если нитрат кобальта Со(NO3)2, его гидроксид Со(ОН)2 или гидроксокарбонат прокалить на воздухе при температуре около 700°C, то образуется оксид кобальта Со3О4 (CoO·Co2O3). Этот оксид по химическому поведению похож на Fe3О4. Оба эти оксида сравнительно легко восстанавливаются водородом до свободных металлов:
Со3О4 + 4Н2 = 3Со + 4Н2О.
При прокаливании Со(NO3)2, Со(ОН)2 и т. д. при 300°C возникает еще один оксид кобальта - Со2О3. При приливании раствора щелочи к раствору соли кобальта (II) выпадает осадок Со(ОН)2, который легко окисляется. Так, при нагревании на воздухе при температуре немногим выше 100°C Со(ОН)2 превращается в СоООН. Если на водные растворы солей двухвалентного кобальта действовать щелочью в присутствии сильных окислителей, то образуется Со(ОН)3.
При нагревании кобальт реагирует со фтором с образованием трифторида СоF3. Если на СоО или СоСО3 действовать газообразным HF, то образуется еще один фторид кобальта СоF2. При нагревании кобальт взаимодействует с хлором и бромом с образованием, соответственно, дихлорида СоСl2 и дибромида СоBr2. За счет реакции металлического кобальта с газообразным НI при температурах 400-500°C можно получить дииодид кобальта СоI2. Сплавлением порошков кобальта и серы можно приготовить серебристо-серый сульфид кобальта СоS (бета-модификация). Если же через раствор соли кобальта (II) пропускать ток сероводорода H2S, то выпадает черный осадок сульфида кобальта СоS (альфа-модификация):
CoSO4 + H2S = CoS + H2SO4
При нагревании CoS в атмосфере H2S образуется Со9S8 с кубической кристаллической решеткой. Известны и другие сульфиды кобальта, в том числе Co2S3, Co3S4 и CoS2. С графитом кобальт образует карбиды Со3C и Со2С, c фосфором - фосфиды составов СоP, Со2P, СоP3. Кобальт реагирует и с другими неметаллами, в том числе с азотом (возникают нитриды Со3N и Co2N), селеном (получены селениды кобальта CoSe и CoSe2), кремнием (известны силициды Co2Si, CoSi CoSi2) и бором (в числе известных боридов кобальта - Со3В, Со2В, СоВ).
Металлический кобальт способен поглощать значительные объемы водорода, не образуя при этом соединений постоянного состава. Косвенным путем синтезированы два стехиометрических гидрида кобальта СоН2 и СоН. Известны растворимые в воде соли кобальта - сульфат СоSO4, хлорид СоСl2, нитрат Со(NO3)2 и другие. Интересно, что разбавленные водные растворы этих солей имеют бледно-розовую окраску. Если же перечисленные соли (в виде соответствующих кристаллогидратов) растворить в спирте или ацетоне, то возникают темно-синие растворы. При добавлении воды к этим растворам их окраска мгновенно переходит в бледно-розовую.
К нерастворимым соединениям кобальта относятся фосфат Со3(PO4)2, силикат Со2SiO4. Для кобальта, как и для никеля, характерно образование комплексных соединений. Так, в качестве лигандов (см. ЛИГАНДЫ) при образовании комплексов с кобальтом часто выступают молекулы аммиака NH3. При действии аммиака на растворы солей кобальта(II) возникают амминные комплексы кобальта красного или розового цвета, содержащие катионы состава [Co(NH3)6-n(H2O)n]2+. Эти комплексы довольно неустойчивы и легко разлагаются даже водой.
Значительно стабильнее амминные комплексы трехвалентного кобальта, которые можно получить действием аммиака на растворы солей кобальта в присутствии окислителей. Так, известны гексамминные комплексы с катионом [Co(NH3)6]3+ (эти комплексы желтого или коричневого цвета получили название лутеосолей), аквапентамминные комплексы красного или розового цвета с катионом [Co(NH3)5H2O]3+ (так называемые розеосоли). В ряде случаев лиганды вокруг атома кобальта могут иметь различное пространственное расположение, и тогда существуют цис- и транс-изомеры соответствующих комплексов.
В качестве лигандов в комплексах кобальта могут выступать также анионы CN-, NO2-. При взаимодействии смеси водорода и СО с гидроксокарбонатом кобальта при повышенном давлении, а также взаимодействием под давлением СО и порошка металлического кобальта получают биядерный октакарбонил дикобальта состава Со2(СО)8. При его осторожном нагревании образуется карбонил Со4(СО)12. Карбонил Со2(СО)8 используют для получения высокодисперсного кобальта, применяемого для нанесения кобальтовых покрытий на различные материалы.
Применение
Основная доля получаемого кобальта расходуется на приготовление различных сплавов. Так, добавление кобальта позволяет повысить жаропрочность стали, обеспечивает улучшение ее механических и иных свойств. Кобальт - компонент некоторых твердых сплавов, из которых изготовляют быстрорежущий инструмент (сверла, разцы). Особенно важны магнитные кобальтовые сплавы (в том числе так называемые магнитомягкие и магнитотвердые). Магнитные сплавы на основе кобальта используют при изготовлении сердечников электромоторов, их применяют в трансформаторах и в других электротехнических устройствах. Для изготовления головок магнитной записи применяют кобальтовые магнитомягкие сплавы. Кобальтовые магнитотвердые сплавы типа SmCo5, PrCo5, характеризующиеся большой магнитной энергией, используют в современном приборостроении.
Для изготовления постоянных магнитов находят применение сплавы, содержащие 52% кобальта и 5-14% ванадия или хрома (так называемые викаллои (см. ВИКАЛЛОЙ)). Кобальт и некоторые его соединения служат катализаторами (см. КАТАЛИЗАТОРЫ). Соединения кобальта, введенные в стекла при их варке, обеспечивают красивый синий (кобальтовый) цвет стеклянных изделий. Соединения кобальта используют как пигменты многих красителей.
Биологическая роль
Кобальт относится к числу микроэлементов (см. МИКРОЭЛЕМЕНТЫ) , то есть постоянно присутствует в тканях растений и животных. Некоторые наземные растения и морские водоросли способны накапливать кобальт. Входя в молекулу витамина В12 (кобаламина), кобальт участвует в важнейших процессах животного организма - кроветворении, функциях нервной системы и печени, ферментативных реакциях. Кобальт участвует в ферментативных процессах фиксации атмосферного азота клубеньковыми бактериями. В организме среднего человека (масса тела 70 кг) содержится около 14 мг кобальта. Суточная потребность составляет 0,007-0,015 мг, ежедневное поступление с пищей 0,005-1,8 мг. У жвачных животных эта потребность гораздо выше, например, у дойных коров - до 20 мг. Соединения кобальта обязательно входят в состав микроудобрений. Однако избыток кобальта для человека вреден. ПДК пыли кобальта в воздухе 0,5 мг/м3, в питьевой воде допустимое содержание солей кобальта 0,01 мг/л. Токсическая доза - 500 мг. Особенно токсичны пары октакарбонила кобальта Со2(СО)8.
Радионуклид кобальт-60
Большое практическое значение имеет искусственно получаемый радионуклид кобальта 60Со (период полураспада Т1/2 5,27 года). Испускаемое этим радионуклидом гамма-излучение обладает достаточно мощной проникающей способностью, и «кобальтовые пушки» - устройства, снабженные 60Со, широко используют при дефектоскопии, например, сварных швов газопроводов, в медицине для лечения онкологических заболеваний и для других целей. Используется 60Со и в качестве радионуклидной метки.
КОБАЛЬТ (лат. Cobaltum) - Со, химический элемент VIII группы периодической системы, атомный номер 27, атомная масса 58,9332. Название от немецкого Kobold - домовой, гном. Серебристо-белый металл с красноватым оттенком; плотность 8,9 г/см³, tпл 1494 .С; ферромагнитен (точка Кюри 1121 .С). При обычной температуре на воздухе химически стоек. Минералы редки, добывается из руд никеля. В основном кобальт используется для получения кобальтовых сплавов (магнитные, жаропрочные, сверхтвердые, коррозионностойкие и др.). Радиоактивный изотоп 60Со используют как источник ?-излучения в медицине и технике. Кобальт важен для жизни растений и животных, входит в состав витамина B12.
-а, м.
1. Химический элемент, серебристо-белый металл с красноватым отливом, более твердый, чем железо.
2. Краска темно-синего цвета, в состав которой входит этот металл.
[нем. Kobalt]
КОБАЛЬТ (Cobaltum), Co, химический элемент VIII группы периодической системы, атомный номер 27, атомная масса 58,9332; металл, tпл 1494°C; ферромагнетик, точка Кюри 1121°C. Кобальт - компонент магнитных, высокопрочных, твердых и других сплавов; радиоактивный изотоп 60Co - источник g-излучения (кобальтовая пушка). Кобальт впервые получен шведским химиком Г. Брандтом в 1735.
ко́бальт, ко́бальты, ко́бальта, ко́бальтов, ко́бальту, ко́бальтам, ко́бальтом, ко́бальтами, ко́бальте, ко́бальтах
КОБАЛЬТ (ново-лат. cobaltum, от Kobold - горный дух). Светло-серый металл, открытый в 1833 г. Брандтом.
- Металл с розоватым или синеватым отливом.
- Химический элемент, Co.
- Название этого химического элемента в переводе с немецкого означает - домовой, гном.
- Синяя краска.
Кобальти́н (кобальтовый блеск), минерал класса сульфидов, CoAsS. Примеси Ni, Fe. Белые, розовые зернистые агрегаты, кристаллы. Твёрдость 5,5; плотность 6,2 г/см3. Происхождение гидротермальное. Руда кобальта.
* * *
КОБАЛЬТИН - КОБАЛЬТИ́Н (кобальтовый блеск), минерал класса сульфидов (см. СУЛЬФИДЫ ПРИРОДНЫЕ) , CoAsS. Примеси Ni, Fe. Белые, розовые зернистые агрегаты, кристаллы. Твердость 5,5; плотность 6,2 г/см3. Происхождение гидротермальное (см. ГИДРОТЕРМАЛЬНЫЕ МЕСТОРОЖДЕНИЯ) . Руда кобальта.
КОБАЛЬТИН (кобальтовый блеск) - минерал класса сульфидов, CoAsS. Примеси Ni, Fe. Белые, розовые зернистые агрегаты, кристаллы. Твердость 5,5; плотность 6,2 г/см³. Происхождение гидротермальное. Руда кобальта.
КОБАЛЬТИН (кобальтовый блеск), минерал, сульфоарсенид, CoAsS. Может содержать до 10% железа. Цвет серебряно-белый с розоватым оттенком. Хрупкий, твердость 5,5, плотность 6,2. Блеск металлический. Сингония кубическая. Иногда встречается в виде октаэдров или пиритоэдров (пентагондодекаэдров), спайность совершенная по кубу. Установлен в высокотемпературных контактовых и гидротермальных жильных месторождениях совместно с другими минералами кобальта и никеля. Один из основных минералов кобальтовых руд, хотя сравнительно редок; содержание кобальта 26-34%. Наиболее известные месторождения - Тунаберг (Швеция), Кобальт (провинция Онтарио, Канада) и Дашкесан (Азербайджан).
кобальти́н, кобальти́ны, кобальти́на, кобальти́нов, кобальти́ну, кобальти́нам, кобальти́ном, кобальти́нами, кобальти́не, кобальти́нах
кобальти́н
- кобальтовый блеск - минерал, сульфоарсенид кобальта, золотисто-серебряного цвета с металлическим блеском; примен. как основная руда для получения кобальта и его солей.
Ко́бальтовые ру́ды - Главные минералы: кобальтин, линнеит, скуттерудит, шмальтинхлоантит. Типы кобальтовой руды - мышьяковые, сернистые, окислённые. Имеются промышленные концентрации Со в месторождениях никеля, меди и железа. Содержание Со в руде от тысячных и сотых долей до 4%. Общие мировые запасы свыше 6 млн. т кобальта. Главные добывающие зарубежные страны: Демократическая Республика Конго, Замбия, Австралия, Канада, Индонезия.
* * *
КОБАЛЬТОВЫЕ РУДЫ - КО́БАЛЬТОВЫЕ РУ́ДЫ. Главные минералы: кобальтин (см. КОБАЛЬТИН), линнеит, скуттерудит, шмальтинхлоантит. Типы кобальтовых руд - мышьяковые, сернистые, окисленные. Имеются промышленные концентрации Со в месторождениях никеля, меди и железа. Содержание Со в руде от тысячных и сотых долей до 4%. Общие мировые запасы св. 6 млн. т кобальта. Главные добывающие зарубежные страны: Демократическая Республика Конго (см. КОНГО (Киншаса)), Замбия (см. ЗАМБИЯ), Австралия (см. АВСТРАЛИЯ (государство)), Канада (см. КАНАДА (государство)), Индонезия (см. ИНДОНЕЗИЯ).
КОБАЛЬТОВЫЕ РУДЫ. Главные минералы: кобальтин - линнеит, скуттерудит, шмальтинхлоантит. Типы кобальтовых руд - мышьяковые, сернистые, окисленные. Имеются промышленные концентрации Со в месторождениях никеля, меди и железа. Содержание Со в руде от тысячных и сотых долей до 4%. Общие мировые запасы св. 6 млн. т кобальта. Главные добывающие зарубежные страны: Заир, Замбия, Австралия, Канада, Индонезия.
прил.
1. соотн. с сущ. кобальт, связанный с ним
2. Свойственный кобальту, характерный для него.
3. Содержащий в себе кобальт 1., 2..
4. Имеющий цвет кобальта [кобальт 3.]; ярко-синий.
КО́БАЛЬТОВЫЙ, кобальтовая, кобальтовое. прил. к кобальт в 1 и 2 знач. Кобальтовый цвет.
|| Из кобальта (в 1 знач.). Кобальтовое стекло. Кобальтовая краска.
-ая, -ое.
прил. к кобальт.
||
Содержащий кобальт.
Кобальтовые руды. Кобальтовая сталь. Кобальтовая краска.
ко́бальтовый, ко́бальтовая, ко́бальтовое, ко́бальтовые, ко́бальтового, ко́бальтовой, ко́бальтовых, ко́бальтовому, ко́бальтовым, ко́бальтовую, ко́бальтовою, ко́бальтовыми, ко́бальтовом, ко́бальтов, ко́бальтова, ко́бальтово, ко́бальтовы, ко́бальтовее, поко́бальтовее, ко́бальтовей, поко́бальтовей