РТУТЬ -и; ж. Химический элемент (Hg), жидкий тяжёлый металл серебристо-белого цвета (широко применяется в химии и электротехнике). Живой, как ртуть. (очень подвижный).
◊ Гремучая ртуть Взрывчатое вещество в виде белого или серого порошка.
* * *
ртуть (лат. Hydrargyrum), химический элемент II группы периодической системы. Серебристый жидкий металл (отсюда латинское название; от греческого hýdōr - вода и árgyros - серебро). Плотность при 20°C 13,546 г/см3 (тяжелее всех известных жидкостей), tпл -38,87°C, tкип 356,58°C. Пары ртути при высокой температуре и при электрическом разряде излучают голубовато-зелёный свет, богатый ультрафиолетовыми лучами. Химически стойка. Основной минерал - киноварь HgS; встречается также ртуть самородная. Используется при изготовлении термометров, манометров, газоразрядных приборов, в производстве хлора и гидроксида натрия (как катод). Сплавы ртути с металлами - амальгамы. Ртуть и многие её соединения ядовиты.
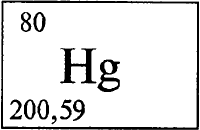
* * *
РТУТЬ - РТУ́ТЬ (лат. Hydrargyrum), Hg (читается «гидраргирум»), химический элемент с атомным номером 80, атомная масса 200,59.
Природная ртуть состоит из смеси семи стабильных нуклидов: 196Hg (содержание 0,146% по массе), 198Hg (10,02%), 199Hg (16,84%), 200Hg (23,13%), 201Hg (13,22%), 202Hg (29,80%) и 204Hg (6,85%). Радиус атома ртути 0,155 нм. Радиус иона Hg+ - 0,111 нм (координационное число 3), 0,133 нм (координационное число 6), иона Hg2+ - 0,083 нм (координационное число 2), 0,110 нм (координационное число 4), 0,116 нм (координационное число 6) или 0,128 нм (координационное число 8). Энергии последовательной ионизации нейтрального атома ртути равны 10,438, 18,756 и 34,2 эВ. Расположена во IIВ группе, 6 периода периодической системы. Конфигурация внешнего и предвнешнего электронных слоев 5s2p6d106s 2. В соединениях проявляет степени окисления +1 и +2. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,9.
История открытия
Ртуть известна человечеству с древнейших времен. Обжиг киновари (см. КИНОВАРЬ) HgS, приводящий к получению жидкой ртути, использовали еще в 5 в. до н. э. в Междуречье (см. МЕСОПОТАМИЯ). Использование киновари и жидкой ртути описано в древних документах Китая, Ближнего Востока. Первое подробное описание получения ртути из киновари описано Теофрастом (см. ТЕОФРАСТ) около 300 лет до н. э.
В древности ртуть использовали для добычи золота (см. ЗОЛОТО (химический элемент)) из золотых руд. Этот способ основан на ее способности растворять многие металлы, образуя жидкие или легкоплавкие амальгамы (см. АМАЛЬГАМА). При прокаливании амальгамы золота летучая ртуть испаряется, золото остается. Во второй половине 15 в в Мексике применяли амальгамирование для извлечения из руды серебра (см. СЕРЕБРО).
Алхимики считали ртуть составной частью всех металлов, полагая, что изменением ее содержания можно осуществить превращение ртути в золото. Только в 20 в. физики установили, что в процессе ядерной реакции атомы ртути действительно превращаются в атомы золота. Но такой способ чрезвычайно дорог.
Жидкая ртуть - очень подвижная жидкость. Алхимики называли ртуть «меркурием» по имени римского бога Меркурия, славившегося своей быстротой в перемещении. В английском, французском, испанском и итальянском языках для ртути используется название «mercury». Современное латинское название происходит от греческих слов «хюдор» - вода и «аргирос» - серебро, т. е. «жидкое серебро».
Ртутные препараты использовали в медицине в средние века (ятрохимия (см. ЯТРОХИМИЯ)).
Нахождение в природе
Редкий рассеянный элемент. Содержание ртути в земной коре 7,0·10-6% по массе. В природе ртуть встречается в свободном состоянии. Образует более 30 минералов. Основной рудный минерал киноварь. Минералы ртути в виде изоморфных примесей встречаются в кварце, халцедоне, карбонатах, слюдах, свинцово-цинковых рудах. Желтая модификация HgO встречается в природе в виде минерала монтроидита. В обменных процессах литосферы, гидросферы, атмосферы участвует большое количество ртути. Содержание ртути в рудах от 0,05 до 6-7%.
Получение
Первоначально ртуть получали из киновари (см. КИНОВАРЬ), помещая ее куски в вязанки хвороста и обжигая киноварь в кострах.
В настоящее время ртуть получают окислительно-восстановительным обжигом руд или концентратов при 700-800оС в печах кипящего слоя, трубчатых или муфельных. Условно процесс может быть выражен:
HgS + O2 = Hg + SO2
Выход ртути при таком способе составляет около 80%. Более эффективен способ получения ртути путем нагревания руды с Fe (см. ЖЕЛЕЗО) и CaO:
HgS + Fe = Hg- + FeS,
4HgS + 4CaO = 4Hg- + 3CaS + CaSO4.
Особо чистую ртуть получают электрохимическим рафинированием на ртутном электроде. При этом содержание примесей составляет от 1·10-6 до 1·10-7%.
Физические и химические свойства
Ртуть - серебристо-белый металл, в парах бесцветный. Единственный жидкий при комнатной температуре металл. Температура плавления -38,87°C, кипения 356,58°C. Плотность жидкой ртути при 20°C 13,5457 г/см3 , твердой ртути при -38,9°C - 14,193 г/см3.
Твердая ртуть - бесцветные кристаллы октаэдрической формы, существующая в двух кристаллических модификациях. «Высокотемпературная» модификация обладает ромбоэдрической решеткой a-Hg, параметры ее элементарной ячейки (при 78 К) а= 0,29925 нм, угол b = 70,74о. Низкотемпературная модификация b-Hg обладает тетрагональной решеткой (ниже 79К).
С использованием ртути голландский физик и химик Х.Камерлинг-Оннес (см. КАМЕРЛИНГ-ОННЕС Хейке) в 1911 впервые наблюдал явление сверхпроводимости (см. СВЕРХПРОВОДИМОСТЬ). Температура перехода a-Hg в сверхпроводящее состояние 4,153К, b-Hg - 3,949К. При более высоких температурах ртуть ведет себя как диамагнетик (см. ДИАМАГНЕТИК). Жидкая ртуть не смачивает стекло и практически не растворяется в воде (в 100 г воды при 25°C растворяется 6·10-6 г ртути).
Стандартный электродный потенциал пары Hg2+2/Hg0 = +0.789 B, пары Hg2+/Hg0 = +0.854B, пары Hg2+/Hg2+2= +0.920B. В неокисляющих кислотах ртуть не растворяется с выделением водорода (см. ВОДОРОД). (см. КИСЛОРОД)
Кислород (см. КИСЛОРОД) и сухой воздух при обычных условиях ртуть не окисляют. Влажный воздух и кислород при ультрафиолетовом облучении или электронной бомбардировке окисляют ртуть с поверхности с образованием оксидов.
Ртуть окисляется кислородом воздуха при температуре выше 300°C, образуя оксид ртути HgO красного цвета:
2Hg + O2 = 2HgO.
Выше 340°C этот оксид разлагается на простые вещества.
При комнатной температуре ртуть окисляется озоном (см. ОЗОН).
Ртуть не реагирует при нормальных условиях с молекулярным водородом, но с атомарным водородом образует газообразный гидрид HgH. Ртуть не взаимодействует с азотом, фосфором, мышьяком, углеродом, кремнием, бором, германием.
С разбавленными кислотами ртуть не реагирует, но растворяется в царской водке (см. ЦАРСКАЯ ВОДКА) и в азотной кислоте. Причем, в случае с кислотой продукт реакции зависит от концентрации кислоты и соотношения ртути и кислоты. При избытке ртути, на холоду, протекает реакция:
6Hg + 8HNO3 разбавл. = 3Hg2(NO3)2 + 2NO + 4H2O.
При избытке кислоты:
3Hg + 8HNO3 = 3Hg(NO3)2 + 2NO + 4H2O.
С галогенами (см. ГАЛОГЕНЫ) ртуть активно взаимодействует с образованием галогенидов (см. ГАЛОГЕНИДЫ). При реакциях ртути с серой (см. СЕРА), селеном (см. СЕЛЕН) и теллуром (см. ТЕЛЛУР) возникают халькогениды (см. ХАЛЬКОГЕНИДЫ) HgS, HgSe, HgTe. Эти халькогениды праrтически не растворимы в воде. Например, значение ПР HgS = 2·10-52. Сульфид ртути растворяется только в кипящей HCl, царской водке (при этом образуется комплекс [HgCl4]2-) и в концентрированных растворах сульфидов щелочных металлов:
HgS + K2S = K2[HgS2].
Сплавы ртути с металлами называют амальгамами (см. АМАЛЬГАМА). Стойкие к амальгамированию металлы - железо (см. ЖЕЛЕЗО), ванадий (см. ВАНАДИЙ), молибден (см. МОЛИБДЕН), вольфрам (см. ВОЛЬФРАМ), ниобий (см. НИОБИЙ) и тантал (см. ТАНТАЛ (химический элемент)). Со многими металлами ртуть образует интерметаллические соединения меркуриды.
Ртуть образует два оксида: оксид ртути(II) HgO и неустойчивый на свету и при нагревании оксид ртути(I) Hg2O (черные кристаллы).
HgO образует две модификации - желтую и красную, отличающиеся размерами кристаллов. Красная модификация образуется при добавлении к раствору соли Hg2+ щелочи:
Hg(NO3)2 + 2NaOH = HgOЇ + 2NaNO3 + H2O.
Желтая форма химически более активна, при нагревании краснеет. Красная форма при нагревании чернеет, но приобретает прежний цвет при охлаждении.
При добавлении щелочи к раствору соли ртути(I) образуется оксид ртути (I) Hg2O:
Hg2(NO3)2 + 2NaOH = Hg2O + H2O + 2NaNO3.
На свету Hg2O распадается на ртуть и HgO, давая осадок черного цвета.
Для соединений ртути(II) характерно образование устойчивых комплексных соединений (см. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ):
2KI + HgI2 = K2[HgI4],
2KCN + Hg(CN)2 = K2[Hg(CN)4].
Соли ртути(I) содержат группировку Hg22+ со связью -Hg-Hg-. Получают эти соединения, восстанавливая соли ртути(II) ртутью:
HgSO4 + Hg + 2NaCl = Hg2Cl2 + Na2SO4,
HgCl2 + Hg = Hg2Cl2.
В зависимости от условий, соединения ртути(I) могут проявлять как окислительные, так и восстановительные свойства:
Hg2Cl2 + Cl2 = 2HgCl2,
Hg2Cl2 + SnCl2 = 2Hg + SnCl4. (см. ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ)
Пероксид (см. ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ) HgO2 - кристаллы; неустойчив, взрывается при нагревании и ударе.
Применение
Ртуть используют для изготовления катодов при электрохимическом получении едких щелочей и хлора, а также для полярографов, в диффузионных насосах, барометрах и манометрах; для определения чистоты фтора и его концентрации в газах. Парами ртути наполняют колбы газоразрядных ламп (ртутных и люминесцентных) и источников УФ излучения. Ртуть применяют при нанесении золотых покрытий и при добычи золота из руды. (см. РТУТИ ХЛОРИДЫ)
Сулема (см. РТУТИ ХЛОРИДЫ) - важнейший антисептик, применяют при разбавлениях 1:1000. Оксид ртути (II), киноварь HgS применяются для лечения глазных и кожных и венерических заболеваний. Киноварь также используют для приготовления чернил и красок. В древности из киновари готовили румяна. Каломель (см. КАЛОМЕЛЬ) используется в ветеринарии в качестве слабительного средства.
Физиологическое действие
Ртуть и ее соединения высокотоксичны. Пары и соединения ртути накапливаясь в организме человека, сорбируются легкими, попадают в кровь, нарушают обмен веществ и поражают нервную систему. Признаки ртутного отравления проявляются уже при содержании ртути в концентрации 0.0002-0.0003 мг/л. Пары ртути фитотоксичны, ускоряют старение растений.
При работе с ртутью и ее соединениями следует предотвращать ее попадание в организм через дыхательные пути и кожу. Хранят в закрытых сосудах.
