м.
1. Химический элемент, мягкий серебристо-белый металл, соединения которого применяются в промышленности и медицине.
2. разг.
Соль этого элемента, используемая в рентгенологии.
м.
1. Химический элемент, мягкий серебристо-белый металл, соединения которого применяются в промышленности и медицине.
2. разг.
Соль этого элемента, используемая в рентгенологии.
БА́РИЙ, бария, мн. нет, муж. (от греч. barys - тяжелый) (хим.). Мягкий металл золотисто-желтого цвета.
БА́РИЙ, -я, м
Химический элемент, серебристый мягкий, химически очень активный, воспламеняющийся при нагревании металл; применяют в вакуумной технике как газопоглотитель, в сплавах (типографских, подшипниковых); соли бария используют в производстве красок, стекол, эмалей, в пиротехнике, медицине.
Во избежание окисления барий обычно хранят под слоем керосина.
БА́РИЙ -я; м. [лат. Barium от греч. barys - тяжёлый].
1. Химический элемент (Ba), мягкий серебристо-белый химически активный металл (применяется в технике, промышленности, медицине).
2. Разг. О сернокислой соли этого элемента (принимается внутрь в качестве контрастного вещества при рентгенологическом обследовании желудка, кишечника и т.п.). Выпить стакан бария.
◁ Ба́риевый, -ая, -ое (1 зн.). Б-ые соли. Б. катод.
* * *
ба́рий (лат. Barium), химический элемент II группы периодической системы, относится к щёлочноземельным металлам. Название от греческого barýs - тяжёлый. Серебристо-белый мягкий металл; плотность 3,78 г/см3, tпл 727°C. Химически очень активен, при нагревании воспламеняется. Минералы: барит и витерит. Применяют в вакуумной технике как газопоглотитель, в сплавах (типографские, подшипниковые); соли бария - в производстве красок, стёкол, эмалей, в пиротехнике, медицине.
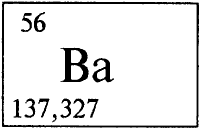
* * *
БАРИЙ - БА́РИЙ (лат. Baryum), Ва (читается «барий»), химический элемент с атомным номером 56, атомная масса 137,327. Расположен в шестом периоде в группе IIА периодической системы. Относится к щелочноземельным элементам. Природный барий состоит из семи стабильных изотопов с массовыми числами 130 (0,101%), 132 (0,097%), 134 (2,42%), 135 (6,59%), 136 (7,81%), 137 (11,32%) и 138 (71,66%). Конфигурация внешнего электронного слоя 6s2. Степень окисления +2 (валентность II). Радиус атома 0,221 нм, радиус иона Ва2+ 0,138 нм. Энергии последовательной ионизации равны 5,212, 10,004 и 35,844 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 0,9.
История открытия
Название элемента происходит от греческого «барис» - тяжелый. В 1602 один болонский ремесленник обратил внимание на тяжелый минерал барит (см. БАРИТ) BaSO4 (плотность 4,50 кг/дм3). В 1774 швед К. Шееле (см. ШЕЕЛЕ Карл Вильгельм), прокаливая барит, получил оксид ВаО. Только в 1808 англичанин Г. Дэви (см. ДЭВИ Гемфри) использовал электролиз для восстановления активных металлов из расплавов их солей.
Распространенность в природе
Содержание в земной коре 0,065%. Важнейшие минералы - барит и витерит (см. ВИТЕРИТ) ВаСО3.
Получение
Основное сырье для получения бария и его соединений - баритовый концентрат (80-95% BaSO4). Его нагревают в насыщенном растворе соды Na2CO3:
BaSO4 + Na2CO3 = ВаCO3 + Na2SO4
Осадок растворимого в кислотах карбоната бария перерабатывают далее.
Основной промышленный метод получения металлического бария - восстановление его порошком алюминия (см. АЛЮМИНИЙ) при 1000-1200 °C:
4ВаО + 2Аl = 3Ва + ВаOАl2О3
Восстановлением барита каменным углем или коксом при нагревании получают BaS:
BaSO4 + 4С = BaS + 4СО
Образующийся растворимый в воде сульфид бария, перерабатывают на другие соединения бария, Ba(OH)2, ВаCO3, Ва(NO3)2.
Физические и химические свойства
Барий - серебристо-белый ковкий металл, кристаллическая решетка - кубическая, объемно центрированная, а = 0,501 нм. При температуре 375 °C переходит в b-модификацию. Температура плавления 727 °C, кипения 1637 °C, плотность 3,780 г/см3. Стандартный электродный потенциал Ва2+/Ва равен -2,906 В.
Имеет высокую химическую активность. Интенсивно окисляется на воздухе, образуя пленку, содержащую оксид бария ВаО, пероксид ВаО2.
Энергично реагирует с водой:
Ва + 2Н2О = Ва(ОН)2 + Н2
При нагревании взаимодействует с азотом (см. АЗОТ) с образованием нитрида Ва3N2:
Ba + N2= Ba3N2
В токе водорода (см. ВОДОРОД) при нагревании барий образует гидрид ВаН2. С углеродом барий образует карбид ВаС2. С галогенами (см. ГАЛОГЕНЫ) барий образует галогениды:
Ва + Сl2 = ВаСl2,
Возможно взаимодействие с серой (см. СЕРА) и другими неметаллами.
BaO - основный оксид. Он реагирует с водой с образованием гидроксида бария:
ВаО + Н2О = Ва(ОН)2
При взаимодействии с кислотными оксидами BaO образует соли:
ВаО +СО2 = ВаСО3
Основный гидроксид Ва(ОН)2 немного растворим в воде, обладает щелочными свойствами.
Ионы Ва2+ бесцветны. Хлорид, бромид, иодид, нитрат бария хорошо растворимы в воде. Нерастворимы карбонат, сульфат, средний ортофосфат бария. Сульфат бария BaSO4 нерастворим в воде и кислотах. Поэтому образование белого творожистого осадка BaSO4 является качественной реакцией на ионы Ва2+ и сульфат-ионы.
BaSO4 растворяется в горячем растворе концентрированной Н2SO4, образуя кислый сульфат:
BaSO4 +Н2SO4 = 2Ba(НSO4)2
Ионы Ва2+ окрашивают пламя в желто-зеленый цвет.
Применение
Сплав Ba с Al - основа геттеров (газопоглотителей). BaSO4 - компонент белых красок, его добавляют при выделке некоторых сортов бумаги, используют при выплавке алюминия, в медицине - для рентгеновского обследования.
Соединения бария используют в стеклопроизводстве, при изготовлении сигнальных ракет.
Титанат бария BaTiO3 - компонент пьезоэлементов, малогабаритных конденсаторов, используется в лазерной технике.
Физиологическое действие
Соединения бария токсичны, ПДК в воздухе 0,5 мг/м3.
БАРИЙ (лат. Barium) - Ba, химический элемент II группы периодической системы, атомный номер 56, атомная масса 137,33, относится к щелочноземельным металлам. Название от греч. barys - тяжелый. Серебристо-белый мягкий металл; плотность 3,78 г/см³, tпл 727 .C. Химически очень активен, при нагревании воспламеняется. Минералы: барит и витерит. Применяют в вакуумной технике как газопоглотитель, в сплавах (типографские, подшипниковые); соли бария - в производстве красок, стекол, эмалей, в пиротехнике, медицине.
БАРИЙ (Barium), Ba, химический элемент II группы периодической системы, атомный номер 56, атомная масса 137,33; относится к щелочноземельным металлам. Открыт шведским химиком К. Шееле в 1774, получен Г. Дэви в 1808.
БАРИЙ (лат. barium, от греч. barys - тяжелый). Желтоватый металл, названный так потому, что в связи с другими металлами дает тяжелые соединения.
- Радиоактивный элемент.
- Химический элемент, Ba.
- Щёлочноземельный металл.
- Этот «тяжёлый» серебристо-серый металл добавляют в материалы для защитных покрытий от вредных излучений.
- Название этого химического элемента происходит от греческого слова «тяжёлый».
- Этот металл был открыт в виде оксида в 1774 году Карлом Шееле и Юханом Ганом.