ГА́ЛЛИЙ -я; м. [от лат. Gallia - Франция] Химический элемент (Ga), мягкий легкоплавкий металл серебристо-белого цвета (применяется в производстве полупроводников).
* * *
Га́ллий (лат. Gallium), химический элемент III группы периодической системы. Название от Gallia - латинское название Франции. Серебристо-белый легкоплавкий (tпл 29,77ºC) металл; плотность (г/см3) твердого металла 5,904, жидкого 6,095; tкип 2205ºC. На воздухе химически стоек. В природе рассеян, встречается вместе с Al. Применяют в основном (на 97%) в производстве полупроводниковых материалов (GaAs, GaSb, GaP, GaN).
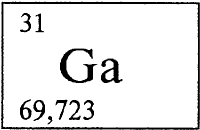
* * *
ГАЛЛИЙ - ГА́ЛЛИЙ (лат. Gallium, от Gallia - латинского названия Франции), Ga (читается «галлий»), химический элемент с атомным номером 31, атомная масса 69,723.
Природный галлий состоит из двух изотопов 69Ga (61,2% по массе) и 71Ga (38,8%). Конфигурация внешнего электронного слоя 4s2p1. Степень окисления +3 , +1 (валентности I, III).
Расположен в группе IIIА периодической системы элементов, в 4-м периоде.
Радиус атома 0,1245 нм, радиус иона Ga3+0,062 нм. Энергии последовательной ионизации 5,998, 20,514, 30,71, 64,2 и 89,8 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,6.
История открытия
Впервые существование этого элемента предсказано Д. И. Менделеевым (см. МЕНДЕЛЕЕВ Дмитрий Иванович) в 1871 на основании открытого им периодического закона. Он назвал его экаалюминий. В 1875 П. Э. Лекок де Буабодран (см. ЛЕКОК ДЕ БУАБОДРАН Поль Эмиль) выделил галлий из цинковых руд.
Де Буабодран определил плотность галлия - 4,7 г/см3, что не соответствовало предсказанному Д. И. Менделеевым значению 5,9 г/см3. Уточненное значение плотности галлия (5,904 г/см3) совпало с предсказанием Менделеева.
Нахождение в природе
Содержание в земной коре 1,8·10-3% по массе. Галлий относится к рассеянным элементам. В природе встречается в виде очень редких минералов: зенгеита Ga(OH)3 , галлита CuGaS2и других. Является спутником алюминия (см. АЛЮМИНИЙ), цинка (см. ЦИНК (химический элемент)), германия (см. ГЕРМАНИЙ), железа (см. ЖЕЛЕЗО); содержится в сфалеритах (см. СФАЛЕРИТ), нефелине (см. НЕФЕЛИН), натролите, бокситах, (см. БОКСИТЫ) германите, в углях и железных рудах некоторых месторождений.
Получение
Основной источник галлия - алюминатные растворы, получаемые при переработке глинозема. После удаления большей части Al и многократного концентрирования образуется щелочной раствор, содержащий Ga и Al. Галлий выделяют электролизом этого раствора.
Физические и химические свойства
Галлий - легкоплавкий светло-серый металл с синеватым оттенком. Расплав Ga может находиться в жидком состоянии при температуре ниже температуры плавления (29,75 °C). Температура кипения 2200 °C, это объясняется тем, что в жидком галлии плотная упаковка атомов с координационным числом 12. Для ее разрушения надо затратить много энергии.
Кристаллическая решетка устойчивой a-модификации образована двухатомными молекулами Ga2, связанными между собой ван-дер-ваальсовыми силами (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ), длина связи 0,244 нм.
Стандартный электродный потенциал пары Ga3+/Ga равен -0,53В, Ga находится в электрохимическом ряду до водорода (см. ВОДОРОД).
По химическим свойствам галлий сходен с алюминием.
На воздухе Ga покрывается оксидной пленкой, предохраняющей от дальнейшего окисления. С мышьяком (см. МЫШЬЯК), фосфором (см. ФОСФОР), сурьмой (см. СУРЬМА) образует арсенид, фосфид и антимонид галлия, с серой (см. СЕРА), селеном (см. СЕЛЕН), теллуром (см. ТЕЛЛУР) - халькогениды. При нагревании Ga реагирует с кислородом (см. КИСЛОРОД). С хлором (см. ХЛОР) и бромом (см. БРОМ) галлий взаимодействует при комнатной температуре, с иодом (см. ИОД) - при нагревании. Галогениды галлия, образуют димеры Ge2X6.
Галлий образует полимерные гидриды:
4LiH + GaCl3 = Li[GaH4] + 3LiCl.
Устойчивость ионов падает в ряду BH4- - AlH4- - GaH4-. Ион BH4- устойчив в водном растворе, AlH4- и GaH4- быстро гидролизуются:
GaH4- + 4H2O = Ga(OH)3 + OH- + 4H2
При нагревании под давлением Ga реагирует с водой:
2Ga + 4H2O = 2GaOOH + 3H2
С минеральными кислотами Ga медленно реагирует с выделением водорода:
2Ga + 6HCl = 2GaCl3 + 3H2
Галлий растворяется в щелочах с образованием гидроксогаллатов:
2Ga + 6H2O + 2NaOH = 2Na[Ga(OH)4] + 3H2
Оксид и гидроксид галлия проявляют амфотерные свойства, хотя основные свойства у них по сравнению с Al усилены:
Ga2O3 + 6HCl = 2GaCl2,
Ga2O3 + 2NaOH + 3H2O = 2Na[Ge(OH)4]
Ga2O3 + Na2CO3 = 2NaGaO2 + CO2
При подщелачивании раствора какой-либо соли галлия выделяется гидроксид галлия переменного состава Ge2O3·xH2O:
Ga(NO3)2 + 3NaOH = Ga(OH)3Ї + 3NaNO3
При растворении Ga(OH)3 и Ga2O3 в кислотах образуются аквакомплексы [Ga(H2O)6]3+, поэтому из водных растворов соли галлия выделяются в виде кристаллогидратов, например, хлорид галлия GaCl3·6H2O, галлийкалиевые квасцы KGa(SO4)2·12H2O. Аквакомплексы галлия в растворах бесцветны.
Применение
Около 97% получаемого промышленностью галлия используется для получения соединений с полупроводниковыми свойствами, например, арсенида галлия GaAs. Металлический галлий применяют в радиоэлектронике для «холодной пайки» керамических и металлических деталей, для легирования Ge и Si, получения оптических зеркал. Ga может заменять Hg в выпрямителях электрического тока. Эвтектический сплав галлия с индием используют в радиационных контурах реакторов.
Особенности обращения
Галлий - малотоксичный элемент. Из-за низкой температуры плавления слитки Ga рекомендуется транспортировать в пакетах из полиэтилена, который плохо смачивается жидким галлием.