м.
Химический элемент, твёрдое вещество серовато-белого цвета с металлическим блеском, являющееся полупроводниковым материалом.
м.
Химический элемент, твёрдое вещество серовато-белого цвета с металлическим блеском, являющееся полупроводниковым материалом.
ГЕРМА́НИЙ -я; м. Химический элемент (Ge), твёрдое вещество серовато-белого цвета с металлическим блеском (является основным полупроводниковым материалом). Пластинка германия.
◁ Герма́ниевый, -ая, -ое. Г-ое сырьё. Г. слиток.
* * *
герма́ний (лат. Germanium), химический элемент IV группы периодической системы. Название от латинского Germania - Германия, в честь родины К. А. Винклера. Серебристо-серые кристаллы; плотность 5,33 г/см3, tпл 938,3ºC. В природе рассеян (собственные минералы редки); добывают из руд цветных металлов. Полупроводниковый материал для электронных приборов (диоды, транзисторы и др.), компонент сплавов, материал для линз в ИК-приборах, детекторов ионизирующего излучения.
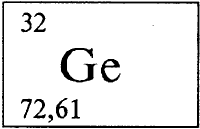
* * *
ГЕРМАНИЙ - ГЕРМА́НИЙ (лат. Germanium), Gе (читается «гертемпманий»), химический элемент с атомным номером 32, атомная масса 72,61. Природный германий состоит из пяти изотопов с массовыми числами 70 (содержание в природной смеси 20,51% по массе), 72 (27,43%), 73 (7,76%), 74 (36,54%), и 76 (7,76%). Конфигурация внешнего электронного слоя 4s2p2. Степени окисления +4, +2 (валентности IV, II). Расположен в группе IVA, в 4 периоде в периодической системе элементов.
История открытия
Был открыт К. А. Винклером (см. ВИНКЛЕР Клеменс Александр) (и назван в честь его родины - Германии) в 1886 при анализе минерала аргиродита Ag8GeS6 после того, как существование этого элемента и некоторые его свойства были предсказаны Д. И. Менделеевым (см. МЕНДЕЛЕЕВ Дмитрий Иванович).
Нахождение в природе
Содержание в земной коре 1,5·10-4 % по массе. Относится к рассеянным элементам. В природе в свободном виде не встречается. Содержится в виде примеси в силикатах, осадочных железных, полиметаллических, никелевых и вольфрамовых рудах, углях, торфе, нефтях, термальных водах и водорослях. Важнейшие минералы: германит Cu3(Ge,Fe,Ga)(S,As)4, стоттит FeGe(OH)6, плюмбогерманит (Pb,Ge,Ga)2SO4(OH)2·2H2O, аргиродит Ag8GeS6, рениерит Cu3(Fe,Ge,Zn)(S,As)4.
Получение германия
Для получения германия используют побочные продукты переработки руд цветных металлов, золу от сжигания углей, некоторые продукты коксохимии. Сырье, содержащее Ge, обогащают флотацией. Затем концентрат переводят в оксид GeO2, который восстанавливают водородом (см. ВОДОРОД):
GeO2 + 4H2 = Ge + 2H2O
Германий полупроводниковой чистоты с содержанием примесей 10-3 -10-4% получают зонной плавкой (см. ЗОННАЯ ПЛАВКА), кристаллизацией (см. КРИСТАЛЛИЗАЦИЯ) или термолизом летучего моногермана GeH4:
GeH4 = Ge + 2H2,
который образуется при разложении кислотами соединений активных металлов с Ge - германидов:
Mg2Ge + 4HCl = GeH4- + 2MgCl2
Физические и химические свойства
Германий - вещество серебристого цвета с металлическим блеском. Кристаллическая решетка устойчивой модификации (Ge I), кубическая, гранецентрированная типа алмаза, а = 0,533 нм (при высоких давлениях получены три другие модификации). Температура плавления 938,25 °C, кипения 2850 °C, плотность 5,33 кг/дм3. Обладает полупроводниковыми свойствами, ширина запрещенной зоны 0,66 эВ (при 300 К). Германий прозрачен для инфракрасного излучения с длиной волны больше 2 мкм.
По химическим свойствам Ge напоминает кремний (см. КРЕМНИЙ). При обычных условиях устойчив к кислороду (см. КИСЛОРОД), парам воды, разбавленным кислотам. В присутствии сильных комплексообразователей или окислителей, при нагревании Ge реагирует с кислотами:
Ge + H2SO4 конц = Ge(SO4)2 + 2SO2 + 4H2O,
Ge + 6HF = H2[GeF6] + 2H2,
Ge + 4HNO3 конц. = H2GeO3 + 4NO2 + 2H2O
Ge реагирует с царской водкой (см. ЦАРСКАЯ ВОДКА):
Ge + 4HNO3 + 12HCl = GeCl4 + 4NO + 8H2O.
С растворами щелочей Ge взаимодействует в присутствии окислителей:
Ge + 2NaOH + 2H2O2 = Na2[Ge(OH)6].
При нагревании на воздухе до 700 °C Ge загорается. Ge легко взаимодействует с галогенами (см. ГАЛОГЕНЫ) и серой (см. СЕРА):
Ge + 2I2 = GeI4
С водородом (см. ВОДОРОД), азотом (см. АЗОТ), углеродом (см. УГЛЕРОД) германий непосредственно в реакции не вступает, соединения с этими элементами получают косвенным путем. Например, нитрид Ge3N4 образуется при растворении дииодида германия GeI2 в жидком аммиаке:
GeI2 + NH3 жидк -> [GeNH]n -> Ge3N4
Оксид германия (IV), GeO2, - белое кристаллическое вещество, существующее в двух модификациях. Одна из модификаций частично растворима в воде с образование сложных германиевых кислот. Проявляет амфотерные свойства.
С щелочами GeO2 взаимодействует как кислотный оксид:
GeO2 + 2NaOH = Na2GeO3 + H2O
GeO2 взаимодействует с кислотами:
GeO2 + 4HCl = GeCl4 + 2H2O
Тетрагалогениды Ge - неполярные соединения, легко гидролизующиеся водой.
3GeF4 + 2H2O = GeO2 + 2H2GeF6
Тетрагалогениды получают прямым взаимодействием:
Ge + 2Cl2 = GeCl4
или термическим разложением:
BaGeF6 = GeF4 + BaF2
Гидриды германия по химическим свойствам подобны гидридам кремния, но моногерман GeH4 более устойчив, чем моносилан SiH4. Германы образуют гомологические ряды GenH2n+2, GenH2n и другие, но эти ряды короче, чем у силанов.
Моногерман GeH4 - газ, устойчивый на воздухе, не реагирующий с водой. При длительном хранении разлагается на H2 и Ge. Получают моногерман восстановлением диоксида германия GeO2 борогидридом натрия NaBH4:
GeO2 + NaBH4 = GeH4 + NaBO2.
Очень неустойчивый монооксид GeO образуется при умеренном нагревании смеси германия и диоксида GeO2:
Ge + GeO2 = 2GeO.
Соединения Ge (II) легко диспропорционируют с выделением Ge:
2GeCl2 -> Ge + GeCl4
Дисульфида германия GeS2 - белое аморфное или кристаллическое вещество, получается осаждением H2S из кислых растворов GeCl4:
GeCl4 + 2H2S = GeS2Ї + 4HCl
GeS2 растворяется в щелочах и сульфидах аммония или щелочных металлов:
GeS2 + 6NaOH = Na2[Ge(OH)6] + 2Na2S,
GeS2 + (NH4)2S = (NH4)2GeS3
Ge может входить в состав органических соединений. Известны (CH3)4Ge, (C6H5)4Ge, (CH3)3GeBr, (C2H5)3GeOH и другие.
Применение
Германий - полупроводниковый материал, применяется в технике и радиоэлектронике при производстве транзисторов и микросхем. Тонкие пленки Ge, нанесенные на стекло, применяют в качестве сопротивлений в радарных установках. Сплавы Ge с металлами используются в датчиках и детекторах. Диоксид германия применяют в производстве стекол, пропускающих инфракрасное излучение.
ГЕРМАНИЙ (лат. Germanium) - Ge, химический элемент IV группы периодической системы, атомный номер 32, атомная масса 72,59. Назван от латинского Germania - Германия, в честь родины К. А. Винклера. Серебристо-серые кристаллы; плотность 5,33 г/см³, tпл 938,3 .С. В природе рассеян (собственно минералы редки); добывают из руд цветных металлов. Полупроводниковый материал для электронных приборов (диоды, транзисторы и др.), компонент сплавов, материал для линз в ИК-приборах, детекторов ионизированного излучения.
ГЕРМАНИЙ (Germanium), Ge, химический элемент IV группы периодической системы, атомный номер 32, атомная масса 72,59; неметалл; полупроводниковый материал. Германий открыт немецким химиком К. Винклером в 1886.
герма́ний, герма́нии, герма́ния, герма́ниев, герма́нию, герма́ниям, герма́нием, герма́ниями, герма́ниях
- Вплоть до 1970-х годов этот элемент был основным полупроводником электронной промышленности, пока на смену не пришёл кремний.
- Химический элемент, Ge.
- Полупроводник.