НУКЛЕИНОВЫЕ КИСЛОТЫ - биополимеры, состоящие из остатков фосфорной кислоты, сахаров и азотистых оснований (пуринов и пиримидинов). Имеют фундаментальное биологическое значение, поскольку содержат в закодированном виде всю генетическую информацию любого живого организма, от человека до бактерий и вирусов, передаваемую от одного поколения другому. Нуклеиновые кислоты были впервые выделены из клеток гноя человека и спермы лосося швейцарским врачом и биохимиком Ф.Мишером между 1869 и 1871. Впоследствии было установлено, что существует два типа нуклеиновых кислот: рибонуклеиновая (РНК) и дезоксирибонуклеиновая (ДНК), однако их функции долго оставались неизвестными. В 1928 английский бактериолог Ф. Гриффит обнаружил, что убитые патогенные пневмококки могут изменять генетические свойства живых непатогенных пневмококков, превращая последние в патогенные. В 1945 микробиолог О.Эвери из Рокфеллеровского института в Нью-Йорке сделал важное открытие: он показал, что способность к генетической трансформации обусловлена переносом ДНК из одной клетки в другую, а следовательно, генетический материал представляет собой ДНК. В 1940-1950 Дж. Бидл и Э. Тейтум из Станфордского университета (шт. Калифорния) обнаружили, что синтез белков, в частности ферментов, контролируется специфическими генами. В 1942 Т.Касперсон в Швеции и Ж.Браше в Бельгии открыли, что нуклеиновых кислот особенно много в клетках, активно синтезирующих белки. Все эти данные наводили на мысль, что генетический материал - это нуклеиновая кислота и что она как-то участвует в синтезе белков. Однако в то время многие полагали, что молекулы нуклеиновых кислот, несмотря на их большую длину, имеют слишком простую периодически повторяющуюся структуру, чтобы нести достаточно информации и служить генетическим материалом. Но в конце 1940-х годов Э. Чаргафф в США и Дж. Уайатт в Канаде, используя метод распределительной хроматографии на бумаге, показали, что структура ДНК не столь проста и эта молекула может служить носителем генетической информации.

Структура ДНК была установлена в 1953 М.
Уилкинсом, Дж. Уотсоном и Ф. Криком в Англии. Это фундаментальное открытие позволило понять, как происходит удвоение (репликация) нуклеиновых кислот. Вскоре после этого американские исследователи А. Даунс и Дж. Гамов предположили, что структура белков каким-то образом закодирована в нуклеиновых кислотах, а к 1965 эта гипотеза была подтверждена многими исследователями: Ф. Криком в Англии, М. Ниренбергом и С. Очоа в США, Х. Кораной в Индии. Все эти открытия, результат столетнего изучения нуклеиновых кислот, произвели подлинную революцию в биологии. Они позволили объяснить феномен жизни в рамках взаимодействия между атомами и молекулами.
Типы и распространение. Как мы уже говорили, есть два типа нуклеиновых кислот: ДНК и РНК. ДНК присутствует в ядрах всех растительных и животных клеток, где она находится в комплексе с белками и является составной частью хромосом. У особей каждого конкретного вида содержание ядерной ДНК обычно одинаково во всех клетках, кроме гамет (яйцеклеток и сперматозоидов), где ДНК вдвое меньше. Таким образом, количество клеточной ДНК видоспецифично. ДНК найдена и вне ядра: в митохондриях ("энергетических станциях" клеток) и в хлоропластах (частицах, где в растительных клетках идет фотосинтез). Эти субклеточные частицы обладают некоторой генетической автономией. Бактерии и цианобактерии (сине-зеленые водоросли) содержат вместо хромосом одну или две крупные молекулы ДНК, связанные с небольшим количеством белка, и часто - молекулы ДНК меньшего размера, называемые плазмидами. Плазмиды несут полезную генетическую информацию, например содержат гены устойчивости к антибиотикам, но для жизни самой клетки они несущественны. Некоторое количество РНК присутствует в клеточном ядре, основная же ее масса находится в цитоплазме - жидком содержимом клетки. Большую ее часть составляет рибосомная РНК (рРНК). Рибосомы - это мельчайшие тельца, на которых идет синтез белка. Небольшое количество РНК представлено транспортной РНК (тРНК), которая также участвует в белковом синтезе. Однако оба этих класса РНК не несут информации о структуре белков - такая информация заключена в матричной, или информационной, РНК (мРНК), на долю которой приходится лишь небольшая часть суммарной клеточной РНК. Генетический материал вирусов представлен либо ДНК, либо РНК, но никогда обеими одновременно.
ОБЩИЕ СВОЙСТВА
Молекулы нуклеиновых кислот содержат множество отрицательно заряженных фосфатных групп и образуют комплексы с ионами металлов; их калиевая и натриевая соли хорошо растворимы в воде. Концентрированные растворы нуклеиновых кислот очень вязкие и слегка опалесцируют, а в твердом виде эти вещества белые. Нуклеиновые кислоты сильно поглощают ультрафиолетовый свет, и это свойство лежит в основе определения их концентрации. С этим же свойством связан и мутагенный эффект ультрафиолетового света. Длинные молекулы ДНК хрупки и легко ломаются, например при продавливании раствора через шприц. Поэтому работа с высокомолекулярными ДНК требует особой осторожности.
Химическая структура. Нуклеиновые кислоты - это длинные цепочки, состоящие из четырех многократно повторяющихся единиц (нуклеотидов). Их структуру можно представить следующим образом:
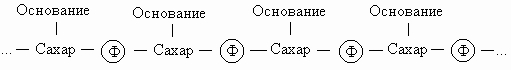
Символ Ф обозначает фосфатную группу. Чередующиеся остатки сахара и фосфорной кислоты образуют сахарофосфатный остов молекулы, одинаковый у всех ДНК, а огромное их разнообразие обусловливается тем, что четыре азотистых основания могут располагаться вдоль цепи в самой разной последовательности. Сахаром в нуклеиновых кислотах является пентоза; четыре из пяти ее углеродных атомов вместе с одним атомом кислорода образуют кольцо. Атомы углерода пентозы обозначают номерами от 1' до 5'. В РНК сахар представлен рибозой, а в ДНК - дезоксирибозой, содержащей на один атом кислорода меньше. Фрагменты полинуклеотидных цепей ДНК и РНК показаны на рисунке.
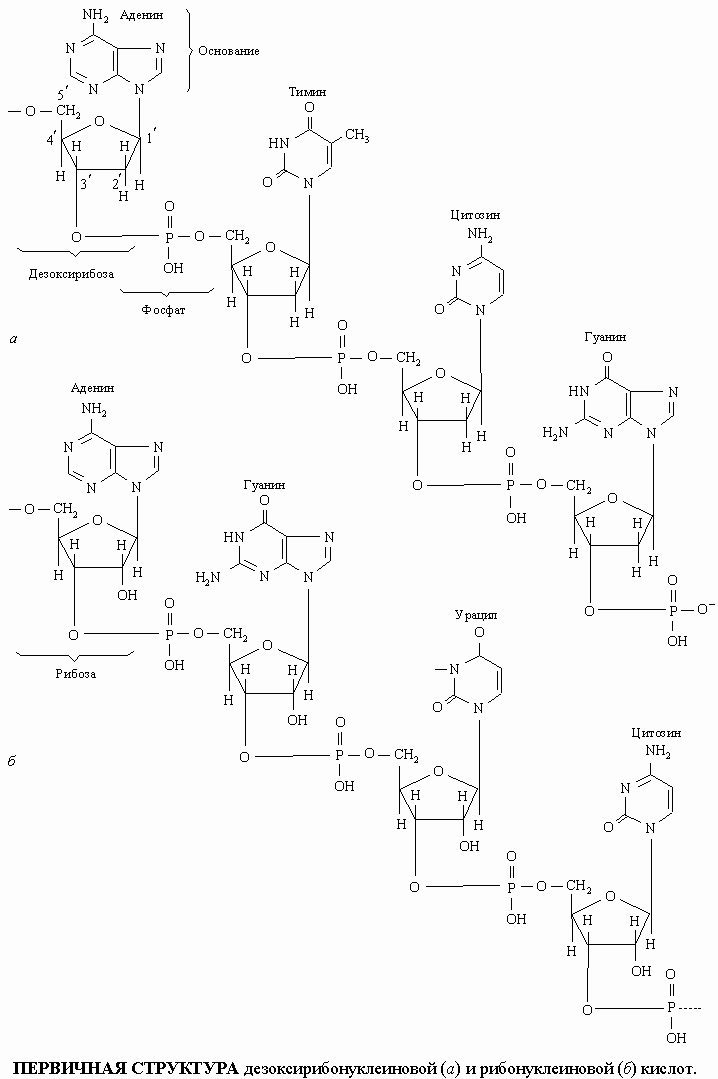
ПЕРВИЧНАЯ СТРУКТУРА дезоксирибонуклеиновой (а) и рибонуклеиновой (б) кислот
Поскольку фосфатные группы присоединены к сахару асимметрично, в положениях 3' и 5', молекула нуклеиновой кислоты имеет определенное направление. Сложноэфирные связи между мономерными единицами нуклеиновых кислот чувствительны к гидролитическому расщеплению (ферментативному или химическому), которое приводит к высвобождению отдельных компонентов в виде небольших молекул. Азотистые основания - это плоские гетероциклические соединения. Они присоединены к пентозному кольцу по положению 1ў. Более крупные основания имеют два кольца и называются пуринами: это аденин (А) и гуанин (Г). Основания, меньшие по размерам, имеют одно кольцо и называются пиримидинами: это цитозин (Ц), тимин (Т) и урацил (У). В ДНК входят основания А, Г, Т и Ц, в РНК вместо Т присутствует У. Последний отличается от тимина тем, что у него отсутствует метильная группа (CH3). Урацил встречается в ДНК некоторых вирусов, где он выполняет ту же функцию, что и тимин.
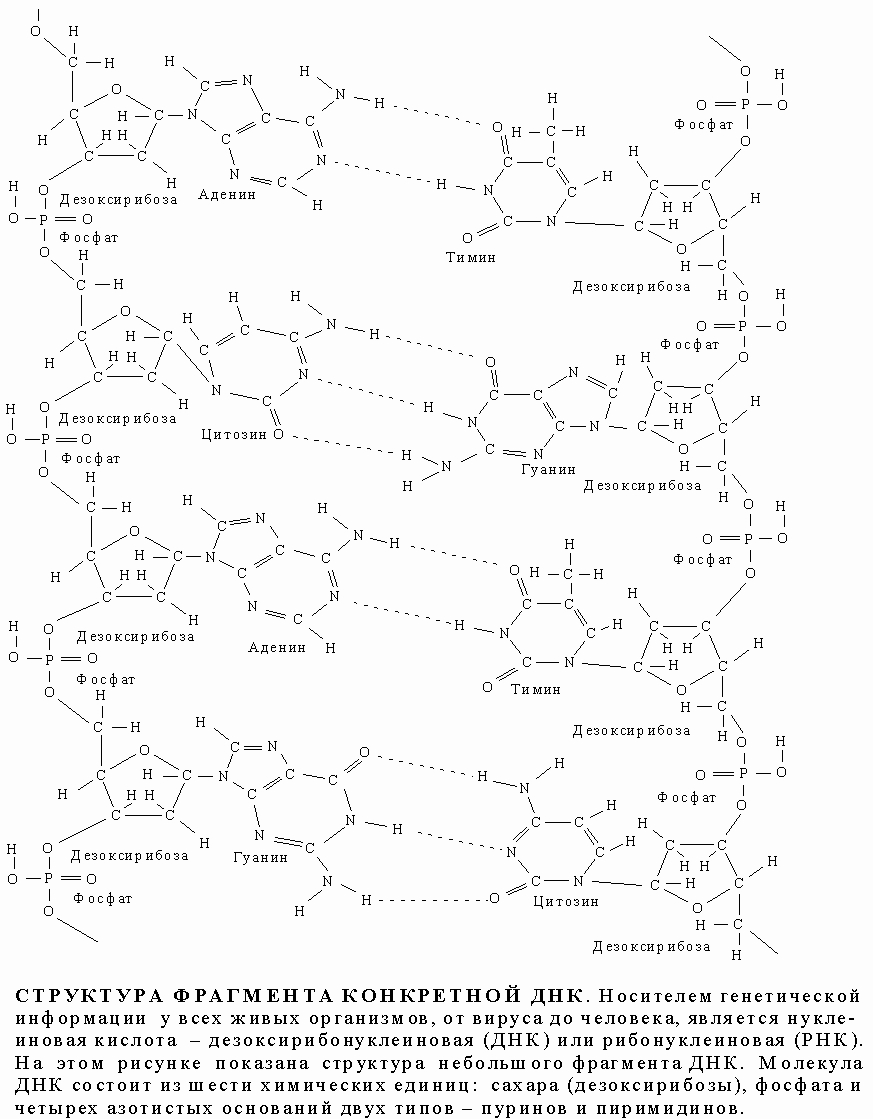
СТРУКТУРА ФРАГМЕНТА КОНКРЕТНОЙ ДНК
Трехмерная структура. Важной особенностью нуклеиновых кислот является регулярность пространственного расположения составляющих их атомов, установленная рентгеноструктурным методом. Молекула ДНК состоит из двух противоположно направленных цепей (иногда содержащих миллионы нуклеотидов), удерживаемых вместе водородными связями между основаниями:
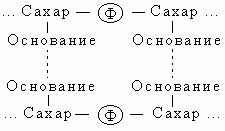
Водородные связи, соединяющие основания противоположных цепей, относятся к категории слабых, но благодаря своей многочисленности в молекуле ДНК они прочно стабилизируют ее структуру. Однако если раствор ДНК нагреть примерно до 60° С, эти связи рвутся и цепи расходятся - происходит денатурация ДНК (плавление). Обе цепи ДНК закручены по спирали относительно воображаемой оси, как будто они навиты на цилиндр. Эта структура называется двойной спиралью. На каждый виток спирали приходится десять пар оснований.
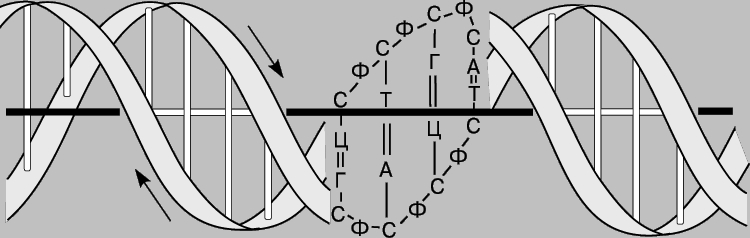
ДВОЙНАЯ СПИРАЛЬ ДНК. По своей структуре ДНК напоминает винтовую лестницу. Ее боковины составлены из чередующихся остатков сахара и фосфатных групп; каждый остаток сахара в одной боковине соединен со своим партнером в другой с помощью "перекладины", состоящей из пурина (аденина или гуанина) и пиримидина (цитозина или тимина), при этом аденин соединяется только с тимином, а гуанин - с цитозином.
Правило комплементарности. Уотсон и Крик показали, что образование водородных связей и регулярной двойной спирали возможно только тогда, когда более крупное пуриновое основание аденин (А) в одной цепи имеет своим партнером в другой цепи меньшее по размерам пиримидиновое основание тимин (Т), а гуанин (Г) связан с цитозином (Ц). Эту закономерность можно представить следующим образом:
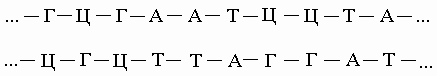
Соответствие А"Т и Г"Ц называют правилом комплементарности, а сами цепи - комплементарными. Согласно этому правилу, содержание аденина в ДНК всегда равно содержанию тимина, а количество гуанина - количеству цитозина. Следует отметить, что две цепи ДНК, различаясь химически, несут одинаковую информацию, поскольку вследствие комплементарности одна цепь однозначно задает другую. Структура РНК менее упорядочена. Обычно это одноцепочечная молекула, хотя РНК некоторых вирусов состоит из двух цепей. Но даже такая РНК более гибка, чем ДНК. Некоторые участки в молекуле РНК взаимно комплементарны и при изгибании цепи спариваются, образуя двухцепочечные структуры (шпильки). В первую очередь это относится к транспортным РНК (тРНК). Некоторые основания в тРНК подвергаются модификации уже после синтеза молекулы. Например, иногда происходит присоединение к ним метильных групп.
ФУНКЦИЯ НУКЛЕИНОВЫХ КИСЛОТ
Одна из основных функций нуклеиновых кислот состоит в детерминации синтеза белков. Информация о структуре белков, закодированная в нуклеотидной последовательности ДНК, должна передаваться от одного поколения к другому, и поэтому необходимо ее безошибочное копирование, т.е. синтез точно такой же же молекулы ДНК (репликация).
Репликация и транскрипция. С химической точки зрения синтез нуклеиновой кислоты - это полимеризация, т.е. последовательное присоединение строительных блоков. Такими блоками служат нуклеозидтрифосфаты; реакцию можно представить следующим образом:
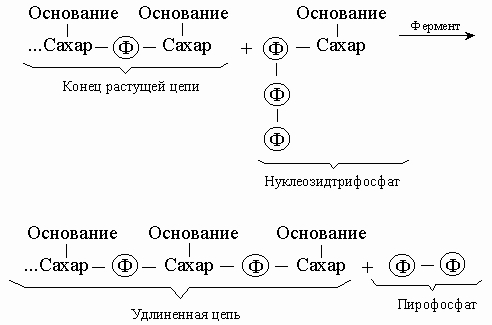
Энергия, необходимая для синтеза, высвобождается при отщеплении пирофосфата, а катализируют реакцию особые ферменты - ДНК-полимеразы. В результате такого синтетического процесса мы получили бы полимер со случайной последовательностью оснований. Однако большинство полимераз работает только в присутствии уже существующей нуклеиновой кислоты -матрицы, диктующей, какой именно нуклеотид присоединится к концу цепи. Этот нуклеотид должен быть комплементарен соответствующему нуклеотиду матрицы, так что новая цепь оказывается комплементарной исходной. Используя затем комплементарную цепь в качестве матрицы, мы получим точную копию оригинала. ДНК состоит из двух взаимно комплементарных цепей. В ходе репликации они расходятся, и каждая из них служит матрицей для синтеза новой цепи:
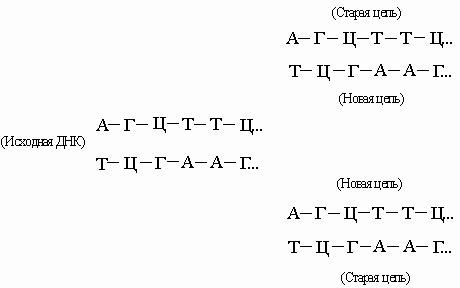
Так образуются две новые двойные спирали с той же последовательностью оснований, что и у исходной ДНК. Иногда в процессе репликации происходит "сбой", и возникают мутации (см. также НАСЛЕДСТВЕННОСТЬ). В результате транскрипции ДНК образуются клеточные РНК (мРНК, рРНК и тРНК):
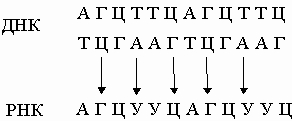
Они комплементарны одной из цепей ДНК и являются копией другой цепи, за исключением того, что место тимина у них занимает урацил. Таким способом можно получить множество РНК-копий одной из цепей ДНК. В нормальной клетке передача информации осуществляется только в направлении ДНК -> ДНК и ДНК -> РНК. Однако в клетках, инфицированных вирусом, возможны и другие процессы: РНК -> РНК и РНК -> ДНК. Генетический материал многих вирусов представлен молекулой РНК, обычно одноцепочечной. Проникнув в клетку-хозяина, эта РНК реплицируется с образованием комплементарной молекулы, на которой, в свою очередь, синтезируется множество копий исходной вирусной РНК:
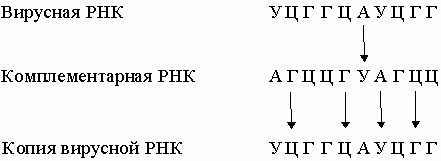
Вирусная РНК может транскрибироваться ферментом - обратной транскриптазой - в ДНК, которая иногда включается в хромосомную ДНК клетки-хозяина. Теперь эта ДНК несет вирусные гены, и после транскрипции в клетке может появиться вирусная РНК. Таким образом, спустя длительное время, в течение которого никакого вируса в клетке не обнаруживается, он снова в ней появится без повторного заражения. Вирусы, генетический материал которых включается в хромосому клетки-хозяина, часто являются причиной рака.
Трансляция нуклеиновых кислот в белки. Генетическая информация, закодированная в нуклеотидной последовательности ДНК, переводится не только на язык нуклеотидной последовательности РНК, но и на язык аминокислот - мономерных единиц белков. Белковая молекула - это цепочка из аминокислот. Каждая аминокислота содержит кислую карбоксильную группу -COOH и оснвную аминогруппу -NH2. Карбоксильная группа одной аминокислоты связывается с аминогруппой другой, образуя амидную связь, и этот процесс продолжается, пока не образуется цепь, содержащая до 1000 аминокислот (см. также БЕЛКИ). В белках присутствует 20 разных аминокислот, от последовательности которых зависят их природа и функции. Эта последовательность определяется нуклеотидной последовательностью соответствующего гена - участка ДНК, кодирующего данный белок. Однако сама ДНК не является матрицей при синтезе белка. Сначала она транскрибируется в ядре с образованием матричной РНК (мРНК), которая диффундирует в цитоплазму, и на ней как на матрице синтезируется белок. Процесс ускоряется благодаря тому, что на каждой молекуле мРНК может одновременно синтезироваться множество белковых молекул. Репликация нуклеиновых кислот осуществляется благодаря образованию водородных связей между комплементарными основаниями исходной и дочерней цепей. Аминокислоты не образуют водородных связей с основаниями, так что прямое копирование матрицы невозможно. Они взаимодействуют с матрицей опосредованно, через "адапторные" нуклеиновые кислоты - небольшие молекулы транспортных РНК (тРНК), состоящие примерно из 80 оснований и способные связываться с мРНК. Каждая тРНК содержит специфическую последовательность из трех оснований, антикодон, который комплементарен группе из трех оснований, кодону, в мРНК. Антикодоны взаимодействуют с кодонами по правилу комплементарности, примерно так же, как взаимодействуют две цепи ДНК. Таким образом, последовательность оснований в мРНК определяет порядок присоединения тРНК, несущих аминокислоты. Схематически перенос информации от ДНК к белку можно представить следующим образом:

Последовательность оснований в ДНК задает порядок следования аминокислот в белке, поскольку каждая аминокислота присоединяется специфическим ферментом только к определенным тРНК, а те, в свою очередь, - только к определенным кодонам в мРНК. Комплексы тРНК-аминокислота связываются с матрицей по одному в каждый данный момент времени. Ниже перечислены основные этапы белкового синтеза (см. также рисунок).
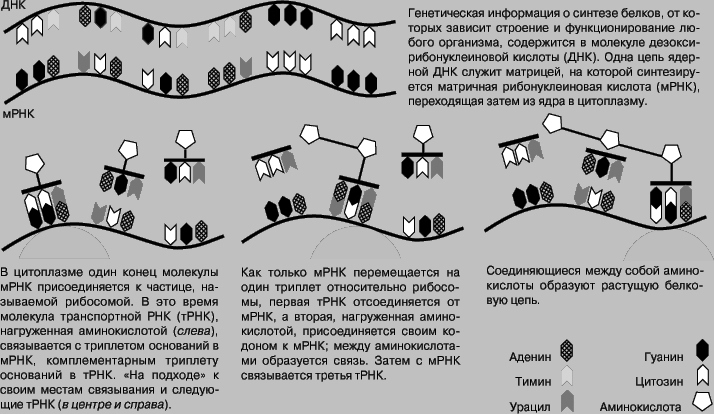
ЭТАПЫ БЕЛКОВОГО СИНТЕЗА
1. Ферменты, называемые аминоацил-тРНК-синтетазами, присоединяют аминокислоты к соответствующим тРНК. Таких ферментов 20, по одному для каждой аминокислоты. 2. Молекула мРНК присоединяется своим первым кодоном к небольшой частице, называемой рибосомой. Рибосомы состоят из примерно равных количеств рРНК и белка. Структура и функция рибосом весьма сложны, но главная их задача - облегчение взаимодействия мРНК и тРНК и ускорение полимеризации аминокислот, связанных с разными тРНК. 3. тРНК, нагруженная аминокислотой, связывается с соответствующим кодоном мРНК, которая, в свою очередь, контактирует с рибосомой. Образуется комплекс рибосома-мРНК-тРНК-аминокислота. 4. мРНК, подобно ленте на конвейере, продвигается по рибосоме на один кодон вперед. 5. Следующая тРНК, нагруженная аминокислотой, присоединяется ко второму кодону. 6. Первая и вторая аминокислоты связываются между собой. 7. Первая тРНК отсоединяется от комплекса, и теперь вторая тРНК несет две аминокислоты, связанные между собой. 8. мРНК снова продвигается на один кодон вперед, и все события повторяются, а растущая аминокислотная цепь удлиняется на одну аминокислоту. Процесс продолжается, пока не будет достигнут последний, "стоп"-кодон и последняя тРНК не отделится от готовой белковой цепи. В бактериальных клетках цепь из 100-200 аминокислот собирается за несколько секунд. В животных клетках этот процесс занимает около минуты.
Генетический код. Итак, каждая аминокислота в белке опосредованно детерминируется определенным кодоном (группой из 3 оснований) в мРНК и в конечном счете в ДНК. Поскольку в нуклеиновых кислотах имеется четыре вида оснований, число возможных кодонов составляет 4ґ4ґ4 = 64. Соответствие между кодонами и аминокислотами, которые они кодируют, называется генетическим или биологическим кодом. Это соответствие было установлено опытным путем: к разрушенным клеткам добавляли синтетические полинуклеотиды известного состава и смотрели, какие аминокислоты включаются в белки. Позднее появилась возможность прямо сравнить последовательности аминокислот в вирусных белках и оснований в вирусных нуклеиновых кислотах. Чрезвычайно интересно, что генетический код, за редкими исключениями, одинаков для всех организмов - от вирусов до человека. Одно из таких исключений составляют изменения в генетическом коде, используемом митохондриями. Митохондрии - это небольшие автономные субклеточные частицы (органеллы), присутствующие во всех клетках, кроме бактерий и зрелых эритроцитов. Предполагают, что когда-то митохондрии были самостоятельными организмами; проникнув в клетки, они со временем стали их неотъемлемой частью, но сохранили некоторое количество собственной ДНК и синтезируют несколько митохондриальных белков.
Вообще говоря, каждой аминокислоте соответствует более одного кодона. Большинство кодонов, кодирующих одну и ту же аминокислоту, имеют два одинаковых первых основания, но в трех случаях (для лейцина, серина и аргинина) имеются два альтернативных набора первых дублетов в кодонах, соответствующих одной и той же аминокислоте. Природа основания в третьем положении не столь важна; одна и та же аминокислота - глицин - может кодироваться по-разному: ГГУ, ГГЦ, ГГА и ГГГ. Однако кодоны для двух разных аминокислот могут иметь два одинаковых первых основания, и тогда различие между ними будет определяться природой третьего основания - пурином или пиримидином. Так, гистидин кодируется триплетами ЦАУ и ЦАЦ, а глутамин - ЦАА и ЦАГ. Три кодона, УАА, УАГ и УГА, не кодируют никаких аминокислот и называются "бессмысленными". Одна молекула ДНК кодирует много белковых цепей. Каждый отрезок, кодирующий одну цепь, называют цистроном. Начало и конец цистрона, а также граница раздела между ними помечаются с помощью своего рода знаков химической пунктуации. По крайней мере у бактерий в начале цистрона находится метиониновый кодон АУГ. Логично предположить, что первой аминокислотой в белке всегда должен быть метионин, но часто несколько первых аминокислот отщепляются ферментативно после окончания синтеза белка. Конец белковой цепи помечается одним или несколькими "бессмысленными" кодонами. У бактерий (прокариот) практически вся ДНК кодирует какие-либо белки или тРНК. Однако у высших форм (эукариот) значительная часть ДНК состоит из простых повторяющихся последовательностей и "молчащих" генов, которые не транскрибируются в РНК и поэтому не транслируются в белки. Кроме того, исходно синтезированная мРНК содержит участки, не детерминирующие никаких белковых последовательностей. Такие участки (интроны), расположенные между кодирующими участками (экзонами), перед началом синтеза белка удаляются специальными ферментами. Почему в ДНК существуют эти казалось бы бесполезные сегменты - неясно; возможно, они выполняют регуляторные функции. У простейшей Tetrahymena РНК сама удаляет свои интроны и соединяет свободные концы цепей, действуя как фермент по отношению к себе самой. Это единственное известное исключение из правила, согласно которому нуклеиновые кислоты не обладают ферментативной активностью.
Транспортные РНК и супрессия. Смысл информации, содержащейся в ДНК, если переводить ее на язык аминокислот, определяется как самой ДНК, так и считывающим механизмом, т.е. зависит не только от того, какие кодоны есть в ДНК и в какой последовательности они расположены, но также и от того, какие именно аминокислоты (и к каким тРНК) присоединяют аминоацил-тРНК-синтетазы. Конечно, природа синтетаз и тРНК тоже определяется ДНК, и в этом смысле ДНК является первичным детерминантом белковой последовательности. Тем не менее суммарная детерминация представляет собой функцию всей системы, поскольку результат зависит от исходных компонентов. Если бы соответствие между тРНК и аминокислотами было другим, смысл кодонов тоже изменился бы. Известно, что мутации в ДНК изменяют считывающий механизм и в результате меняют - пусть и незначительно - смысл кодонов. Так, в бактерии Escherichia coli глициновая тРНК обычно узнает в мРНК кодон ГГА; мутация в ДНК, с которой транскрибируется эта тРНК, изменяет антикодон глициновой тРНК таким образом, что теперь он узнает кодон АГА, соответствующий аргинину, и в белковой молекуле вместо аргинина появляется глицин. Это не обязательно имеет фатальные последствия, поскольку не все аргинины кодируются триплетом АГА и есть аргининовые тРНК, по-прежнему узнающие "свои" АГА. В результате измененными оказываются не все белковые молекулы. Иногда такие мутации, изменяющие антикодон, подавляют (супрессируют) мутации в кодоне. Например, если в результате мутации глициновый кодон ГГА превращается в АГА, он все же может прочитываться как глицин, если антикодон глициновой тРНК, в свою очередь, изменился так, что эта тРНК стала узнавать АГА. В этом случае вторая "ошибка" устраняет первую. Мутации, приводящие к изменению антикодонов, могут иметь разные последствия, поскольку один и тот же кодон может узнаваться несколькими тРНК. Вообще говоря, узнавание осуществляется благодаря комплементарности оснований кодона и антикодона, однако одно из оснований кодона может модифицироваться таким образом, что антикодон будет узнавать даже неполностью комплементарный кодон. В результате одна и та же тРНК может взаимодействовать с несколькими разными кодонами, кодирующими одну и ту же аминокислоту. Этот феномен неполного соответствия кодона и антикодона был назван Ф. Криком "шатанием".
Регуляция активности генов. Для организма было бы катастрофой, если бы во всех его клетках одновременно работали все гены и синтезировались все закодированные ими белки. Бактерии, например, должны все время приспосабливаться к условиям среды, синтезируя нужные ферменты. Все клетки высших организмов имеют один и тот же набор генов, но, к счастью, клетки мозга не продуцируют пищеварительные ферменты, а в хрусталике глаза не синтезируются мышечные белки. Активность гена характеризуется тем, транскрибируется ли он с образованием соответствующей мРНК. ДНК - длинная молекула, и в определенных ее участках имеются последовательности, называемые промоторами, которые распознаются специфическим транскрибирующим ферментом - полимеразой. В этих участках и только в них начинается транскрипция, продолжаясь до тех пор, пока не достигнет последовательности оснований, означающей конец считывания. Существуют особые репрессорные белки, которые связываются с ДНК поблизости от промотора в участке, называемом оператором. Образовавшийся комплекс блокирует транскрипцию, и мРНК не синтезируется. Таким образом, репрессорные белки являются ингибиторами транскрипции. С другой стороны, существуют небольшие молекулы, которые образуют комплекс с репрессорами и снимают их блокирующее действие на транскрипцию. Иными словами, они ингибируют ингибиторы. Так, у бактерий в норме отсутствуют ферменты, катализирующие расщепление некоторых сахаров; однако если один из этих сахаров появляется в среде, он образует комплекс с репрессором, ингибирование снимается и запускается синтез соответствующего фермента. Ферменты, синтез которых индуцируется собственными субстратами, называются индуцибельными. В ряде случаев, наоборот, репрессорный белок не блокирует транскрипцию мРНК, если он не связан с определенной молекулой. У бактерий некоторые ферменты, участвующие в синтезе определенных аминокислот, образуются только в отсутствие этих аминокислот, т.е. бактерии производят данные ферменты лишь по мере надобности. Если добавить в среду соответствующую аминокислоту, она образует комплекс с репрессором и активирует его, а тем самым ингибирует транскрипцию соответствующих генов. Уже образовавшаяся мРНК вскоре расщепляется, и синтез ферментов останавливается. Такие ферменты являются отрицально индуцибельными. Поскольку репрессорные белки сами кодируются генами, работа которых, в свою очередь, может регулироваться другими генами, а синтез малых молекул-индукторов и гормонов также в конечном счете регулируется генами, механизмы регуляции генной активности могут быть очень сложными.
ЛИТЕРАТУРА
Ичас М. Биологический код. М., 1971 Шабарова З.А., Богданов А.А. Химия нуклеиновых кислот и их компонентов, М., 1978 Зенгер В. Принципы структурной организации нуклеиновых кислот. М., 1987