м.
Блестящий, мягкий, быстро окисляющийся на воздухе металл белого цвета.
НА́ТРИЙ, натрия, мн. нет, муж. (лат. natrium) (хим.). Мягкий и белый легкий щелочной металл. Поваренная соль представляет собой химическое соединение хлора с натрием.
НА́ТРИЙ, -я, муж. Химический элемент, мягкий серебристо-белый лёгкий металл.
| прил. натриевый, -ая, -ое. Натриевая селитра.
НАТРИЙ - муж. металлическое или корольковое основание натра, соды, одной из щелочей, как напр. железо есть основание ржавчины, вохры, зеленого купороса и пр. Натриевый, к нему относящийся. Натр муж. сода, окись натрия; растительная щелочь, от пережига морских водорослей, как калий подобная щелочь, от пережига материковых растений. Натровый, к нему относящийся или его в себе содержащий. Натролит муж. ископаемое, главнейше натр или соду содержащее.
НА́ТРИЙ, -я, м
Химический элемент, мягкий металл серебристо-белого цвета, быстро окисляющийся на воздухе; взаимодействие с водой может сопровождаться взрывом, поэтому его сохраняют под слоем керосина.
Натрий применяется для получения чистых металлов, а также в качестве теплоносителя в ядерных реакторах.
НА́ТРИЙ -я; м. Химический элемент (Na), мягкий металл серебристо-белого цвета, быстро окисляющийся на воздухе.
◁ На́триевый, -ая, -ое. Н-ые соединения. Н-ая селитра.
* * *
на́трий (лат. Natrium), химический элемент I группы периодической системы; относится к щелочным металлам. Название (от арабского натрун) первоначально относилось к природной соде. Серебристо-белый металл, мягкий, лёгкий (плотность 0,968 г/см3), легкоплавкий (tпл 97,86°C). На воздухе быстро окисляется. Взаимодействие с водой может сопровождаться взрывом. Занимает 6-е место по распространённости в земной коре (минералы галит, мирабилит и др.) и 1-е среди металлических элементов в Мировом океане. Применяют для получения чистых металлов (K, Zr, Та и др.), как теплоноситель в ядерных реакторах (сплав с калием) и источник свечения в натриевых лампах. Натрий участвует в минеральном обмене всех живых организмов.
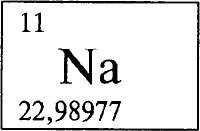
* * *
НАТРИЙ - НА́ТРИЙ (лат. Natrium, от арабского натрун, греческого nitron - природная сода), Na (читается «натрий»), химический элемент с атомным номером 11, атомной массой 22,98977. В природе встречается один стабильный изотоп 23Na. Принадлежит к числу щелочных металлов. Расположен в третьем периоде в группе IА в периодической системе элементов. Конфигурация внешнего электронного слоя 3s1. Степень окисления +1 (валентность I).
Рaдиус атома 0,192 нм, радиус иона Na+0,116 нм (координационное число 6). Энергии последовательной ионизации 5,139 и 47,304 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,00.
Историческая справка
Поваренная соль (хлорид натрия NaCl), едкая щелочь (гидроксид натрия NaOH) и сода (карбонат натрия Na2CO3) находили применение еще в Древней Греции.
Металлический Na впервые получил в 1807 Г. Дэви (см. ДЭВИ Гемфри), используя электролиз расплава каустической соды.
Нахождение в природе
Содержание в земной коре 2,64% по массе. Основные минералы: галит (см. ГАЛИТ) NaCl, мирабилит (см. МИРАБИЛИТ) Na2SO4·10H2O, тенардит (см. ТЕНАРДИТ) Na 2SO 4 , чилийская селитра NaNO3 ,трона (см. ТРОНА) NaHCO3·Na2CO 3·2H2O, бура (см. БУРА) Na2B4O7·10H2O и природные силикаты, например, нефелин (см. НЕФЕЛИН) Na[AlSiO4].
В воде Мирового океана содержится 1,5·1016т солей натрия.
Получение
Na получают электролизом расплава хлорида натрия NaCl, с добавлением NаСl2, КСl и NaF для снижения температуры плавления электролита до 600°C. Аноды изготовлены из графита, катоды - из меди или железа. Электролиз расплава проводят в стальном электролизере с диафрагмой. Параллельно с Na электролизом получают Cl2:
2NaCl=2Na+Cl2
Получаемый Na очищают вакуумной дистилляцией или обработкой титаном или сплавом титана и циркония.
Физические и химические свойства
Натрий - мягкий серебристо-белый металл, быстро тускнеющий на воздухе.
Na мягок, легко режется ножом, поддается прессованию и прокатке. Выше -222°C устойчива кубическая модификация, а = 0,4291 нм. Ниже - гексагональная модификация. Плотность 0,96842 кг/дм3. Тaмпература плавления 97,86°C, кипения 883,15°C. Пары натрия состоят из Na и Na2.
Na химически очень активен. При комнатной температуре взаимодействует с O2 воздуха, парами воды и CO2 с образованием рыхлой корки. При сгорании Na в кислороде образуются пероксид Na2О2 и оксид Na2O:
4Na+O2=2Na2O и 2Na+O2=Na2O2
При нагревании на воздухе Na сгорает желтым пламенем, в желтый цвет окрашивают пламя и многие соли натрия. Натрий бурно реагирует с водой и разбавленными кислотами:
2Na+H2O=2NaOH+H2
При взаимодействии Na и спирта выделяется H2 и образуется алкоголят натрия. Например, взаимодействуя с этанолом С2Н5ОН, Na образует этанолят натрия С2Н5ОNa:
С2Н5ОН+2Na=2С2Н5ОNa+H2
Кислородсодержащие кислоты, взаимодействуя с Na, восстанавливаются:
2Na+2Н2SO4=SO2+Na2SO4+2H2O
При нагревании до 200°C Na реагирует с H2 с образованием гидрида NaН:
2Na+H2=2NaH
Натрий самовоспламеняется в атмосфере фтора (см. ФТОР) или хлора (см. ХЛОР), с иодом (см. ИОД) реагирует при нагревании. При перетирании в ступке Na реагирует с S с образованием сульфидов переменного состава. С N2 реакция протекает в электрическом разряде, образуются нитрид натрия Nа3N или азид NaN3. Na реагирует с жидким аммиаком с образованием голубых растворов, где Na присутствует в виде ионов Na+.
Оксид натрия Na2O проявляет ярко выраженные основные свойства, легко реагирует с водой с образованием сильного основания - гидроксида натрия NaОН:
Na2O+H2O=2NaOH
Пероксид натрия Na2O2 реагирует с водой с выделением кислорода:
2Na2O2+2H2O=4NaOH+O2
Гидроксид натрия - очень сильное основание, щелочь, (см. ЩЕЛОЧИ) хорошо растворим в воде (в 100 г воды при 20 °C растворяется 108 г NaOH). NaОН взаимодействует с кислотными и амфотерными (см. АМФОТЕРНОСТЬ) оксидами:
CO2+2NaOH=Na2CO3+H2O,
Al2O3+2NaOH+3H2O=2Na[Al(OH)4] (в растворе),
Al2O3+2NaOH=2NaAlO2+H2O (при сплавлении)
В промышленности гидроксид натрия NaOH получают электролизом водных растворов NaCl или Na2CO3 c применением ионообменных мембран и диафрагм:
2NaCl+2H2O=2NaOH+Cl2+H2
Попадание твердого NaOH или капель его раствора на кожу вызывает тяжелые ожоги. Водные растворы NaOH при хранении разрушают стекло, расплавы - фарфор.
Карбонат натрия Na2CO3 получают насыщением водного раствора NaCl аммиаком и CO2. Рaстворимость образующегося гидрокарбоната натрия NaHCO3 менее 10 г в 100 г воды при 20°C, основная часть NaHCO3 выпадает в осадок:
NaCl+NH3+CO2=NaHCO3 ,
который отделяют фильтрованием. При прокаливании NaHCO3 образуется кальцинированная сода:
2NaHCO3=Na2CO3+CO2+H2O
У большинства солей Na растворимость с ростом температуры возрастает не так сильно, у солей калия (см. КАЛИЙ).
Na - сильный восстановитель:
TiCl4+4Na=4NaCl+Ti
Применение
Нaтрий применяется как восстановитель активных металлов, его расплав в смеси с калием является теплоносителем в ядерных реакторах, так как он плохо поглощает нейтроны. Пaры Na используются в лампах накаливания.
NaCl используется в пищевой промышленности, гидроксид натрия NaOH - в производстве бумаги, мыла, искусственных волокон, в качестве электролита. Кaрбонат натрия Na2CO3 и гидрокарбонат NaНСO3 - применяется в пищевой промышленности, является компонентом огнетушащих средств, лекарством. Фосфат натрия Na3PO4 - компонент моющих средств, применяют в производстве стекол и красок, в пищевой промышленности, в фотографии. Силикаты mNa2O·nSiO2 - компоненты шихты в производстве стекла, для получения алюмосиликатных катализаторов, жаростойких, кислотоупорных бетонов.
Физиологическая роль
Ионы натрия Na+ необходимы для нормального функционирования организма, они участвуют в процессах обмена веществ. В плазме крови человека содержание ионов Na+ 0,32% по массе, в костях - 0,6%, В мышечных тканях - 1,5%. Для восполнения естественной убыли человек должен ежедневно употреблять с пищей 4-5 г Na.
Особенности обращения с металлическим натрием
Хранят натрий в герметично закрытых железных контейнерах под слоем обезвоженного керосина или минерального масла. Загоревшийся Na заливают минеральным маслом или засыпают смесью талька и NaCl. Образующиеся отходы металлического Na уничтожают в емкостях с этиловым или пропиловым спиртом.
НАТРИЙ (лат. Natrium) - Na, химический элемент I группы периодической системы Менделеева, атомный номер 11, атомная масса 22,98977; относится к щелочным металлам. Название (от араб. натрун) первоначально относилось к природной соде. Серебристо-белый металл, мягкий, легкий (плотность 0,968 г/см³), легкоплавкий (tпл 97,86 .С). На воздухе быстро окисляется. Взаимодействие с водой может сопровождаться взрывом. Занимает 6-е место по распространенности в земной коре (минералы галит, мирабилит и др.) и 1-е среди металлических элементов в Мировом ок. Применяют для получения чистых металлов (К, Zr, Та и др.), как теплоноситель в ядерных реакторах (сплав с калием) и источник свечения в натриевых лампах. Натрий участвует в минеральном обмене всех живых организмов.
-я, м.
Химический элемент, мягкий металл серебристо-белого цвета, быстро окисляющийся на воздухе.
[лат. natrium]
НАТРИЙ (Natrium), Na, химический элемент I группы периодической системы, атомный номер 11, атомная масса 22,98977; мягкий щелочной металл, tпл 97,86°C. Натрий и его сплавы с калием - теплоносители в ядерных реакторах. Натрий - компонент сплавов для подшипников, модификатор алюминиевых и других сплавов, катализатор в синтезе бутадиенового каучука; амальгаму натрия используют для получения гидроксида натрия. Открыт в 1807 Г. Дэви.
мед. натрий (natrium) и хлор (chlorine)
Это основные держатели осмотического давления, которое предотвращает утечку воды из кровеносных сосудов в прилежащие ткани.
см. тж микроэлементы, натрия хлорид
Название этого металла было заимствовано из латинского, где natrium (от natrum - "сода") восходит к арабскому natroun от древнеегипетского ntr.
НАТРИЙ (греч. nitron, лат. natrum). Металл белого цвета, составляющий часть поваренной соли, соды, селитры и др.
- Какой химический элемент стоит в начале третьего периода таблицы Менделеева?
- Англичане и французы называют этот металл «содиум».
- Металл, предотвращающий обезвоживание организма.
- Щелочной металл.
- Металл, наиболее распространённый в мировом океане.
- Металл, присутствующий и в соде, и в поваренной соли.
- Металл, взрывающийся в воде.
- Поваренная соль - это хлористый ...
- Химический элемент, Na.
- Катион какого металла содержится в молекуле поваренной соли?
- В газообразном состоянии он образует двухатомные молекулы, хотя это типичный металл.
- Металл, который хранится в масле.