м.
Химический элемент, серебристо-белый, мягкий, легкоплавкий металл, применяющийся (в соединениях) в сельском хозяйстве, промышленности, фармакологии и т.п.
м.
Химический элемент, серебристо-белый, мягкий, легкоплавкий металл, применяющийся (в соединениях) в сельском хозяйстве, промышленности, фармакологии и т.п.
КА́ЛИЙ, калия, мн. нет, муж., и кали, нескл., ср. (араб. - поташ) (хим.). Химический элемент - щелочный металл серебристо-белого цвета, добываемый из углекалиевой соли.
КА́ЛИЙ, -я, муж. Химический элемент, мягкий металл серебристо-белого цвета.
| прил. калиевый, -ая, -ое и калийный, -ая, -ое. Калиевые соли. Калийные удобрения.
КАЛИЙ - муж. потасий, металл, составляющий основанье кали, весьма сходный с натрием (содием). Кали ср., нескл., растительная щелочь или щелочная соль; углекислый калий, чистый поташ. Калиевый, к калию относящийся. Калистый, содержащий кали.
КА́ЛИЙ, -я, м
Химический элемент, металл, серебристо-белого цвета, добываемый из углекислой соды (поташа).
Из-за высокой химической активности в чистом виде калий практически не применяется, но его соединения имеют очень большой спектр применения в производстве удобрений, медицине и промышленности.
КА́ЛИЙ -я; м. [араб. kali] Химический элемент (K), металл серебристо-белого цвета, добываемый из углекалиевой соли (поташа).
◁ Ка́лиевый, -ая, -ое. К-ые месторождения. К-ые соли. Кали́йный, -ая, -ое. К-ая промышленность. К-ые удобрения.
* * *
ка́лий (лат. Kalium), химический элемент I группы периодической системы, относится к щелочным металлам. Название от арабского аль-кали - поташ (давно известное соединение калия, добываемое из древесной золы). Серебристо-белый металл, мягкий, легкоплавкий; плотность 0,8629 г/см3, tпл 63,51ºC. Быстро окисляется на воздухе, с водой реагирует со взрывом. По распространённости в земной коре занимает 7-е место (минералы: сильвин, каинит, карналлит и др.; см. Калийные соли). Входит в состав тканей растительных и животных организмов. Около 90% добываемых солей используется как удобрения. Металлический калий используют в химических источниках тока, как геттер в электронных лампах, для получения суперпероксида KO2; сплавы K с Na - теплоносители в ядерных реакторах.
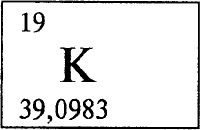
* * *
КАЛИЙ - КА́ЛИЙ (лат. Kalium), K (читается «калий»), химический элемент с атомным номером 19, атомная масса 39,0983.
Калий встречается в природе в виде двух стабильных нуклидов (см. НУКЛИД): 39К (93,10% по массе) и 41К (6,88%), а также одного радиоактивного 40К (0,02%). Период полураспада калия-40 Т1/2 примерно в 3 раза меньше, чем Т1/2 урана-238 и составляет 1,28 миллиарда лет. При b-распаде калия-40 образуется стабильный кальций-40, а при распаде по типу электронного захвата (см. ЭЛЕКТРОННЫЙ ЗАХВАТ) образуется инертный газ аргон-40.
Калий принадлежит к числу щелочных металлов (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ). В периодической системе Менделеева калий занимает место в четвертом периоде в подгруппе IА. Конфигурация внешнего электронного слоя 4s1, поэтому калий всегда проявляет степень окисления +1 (валентность I).
Атомный радиус калия 0,227 нм, радиус иона K+ 0,133 нм. Энергии последовательной ионизации атома калия 4,34 и 31,8 эВ. Электроотрицательность (см. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ) калия по Полингу 0,82, что говорит о его ярко выраженных металлических свойствах.
В свободном виде - мягкий, легкий, серебристый металл.
История открытия
Соединения калия, как и его ближайшего химического аналога - натрия (см. НАТРИЙ), были известны с древности и находили применение в различных областях человеческой деятельности. Однако сами эти металлы были впервые выделены в свободном состоянии только в 1807 в ходе экспериментов английского ученого Г. Дэви (см. ДЭВИ Гемфри). Дэви, используя гальванические элементы как источник электрического тока, провел электролиз расплавов поташа (см. ПОТАШ) и каустической соды (см. КАУСТИЧЕСКАЯ СОДА) и таким образом выделил металлические калий и натрий, которые назвал «потассием» (отсюда сохранившееся в англоязычных странах и Франции название калия - potassium) и «содием». В 1809 английский химик Л. В. Гильберт предложил название «калий» (от арабского аль-кали - поташ).
Нахождение в природе
Содержание калия в земной коре 2,41% по массе, калий входит в первую десятку наиболее распространенных в земной коре элементов. Основные минералы, содержащие калий: сильвин (см. СИЛЬВИН) KСl (52,44% К), сильвинит (Na,K)Cl (этот минерал представляет собой плотно спрессованную механическую смесь кристалликов хлорида калия KCl и хлорида натрия NaCl), карналлит (см. КАРНАЛЛИТ) KCl·MgCl2·6H2O (35,8% К), различные алюмосиликаты (см. АЛЮМОСИЛИКАТЫ), содержащие калий, каинит (см. КАИНИТ) KCl·MgSO4·3H2O, полигалит (см. ПОЛИГАЛИТ) K2SO4·MgSO4·2CaSO4·2H2O, алунит (см. АЛУНИТ) KAl3(SO4)2(OH)6. В морской воде содержится около 0,04% калия.
Получение
В настоящее время калий получают при взаимодействии с жидким натрием расплавленных KOH (при 380-450°C) или KCl (при 760-890°C):
Na + KOH = NaOH + K
Калий также получают электролизом расплава KCl в смеси с K2CO3 при температурах, близких к 700°C:
2KCl = 2K + Cl2
От примесей калий очищают вакуумной дистилляцией.
Физические и химические свойства
Металлический калий мягок, он легко режется ножом и поддается прессованию и прокатке. Обладает кубической объемно центрированной кубической решеткой, параметр а = 0,5344 нм. Плотность калия меньше плотности воды и равна 0,8629 г/см3. Как и все щелочные металлы, калий легко плавится (температура плавления 63,51°C) и начинает испаряться уже при сравнительно невысоком нагревании (температура кипения калия 761°C).
Калий, как и другие щелочные металлы, химически очень активен. Легко взаимодействует с кислородом воздуха с образованием смеси, преимущественно состоящей из пероксида К2О2 и супероксида KO2 (К2О4):
2K + O2 = K2O2, K + O2 = KO2.
При нагревании на воздухе калий сгорает фиолетово-красным пламенем. С водой и разбавленными кислотами калий взаимодействует со взрывом (воспламеняется образующийся водород):
2K + 2H2O = 2KOH + H2
Кислородсодержащие кислоты при таком взаимодействии могут восстанавливаться. Например, атом серы серной кислоты восстанавливается до S, SO2 или S2-:
8К + 4Н2SO4 = K2S + 3K2SO4 + 4H2O.
При нагревании до 200-300 °C калий реагирует с водородом с образованием солеподобного гидрида КН:
2K + H2 = 2KH
С галогенами (см. ГАЛОГЕНЫ) калий взаимодействует со взрывом. Интересно отметить, что с азотом калий не взаимодействует.
Как и другие щелочные металлы, калий легко растворяется в жидком аммиаке с образованием голубых растворов. В таком состоянии калий используют для проведения некоторых реакций. При хранении калий медленно реагирует с аммиаком с образованием амида KNH2:
2K + 2NH3 жидк. = 2KNH2 + H2
Важнейшие соединения калия: оксид К2О, пероксид К2О2, супероксид К2О4, гидроксид КОН, иодид KI, карбонат K2CO3 и хлорид KCl.
Оксид калия К2О, как правило, получают косвенным путем за счет реакции пероксида и металлического калия:
2K + K2O2 = 2K2O
Этот оксид проявляет ярко выраженные основные свойства, легко реагирует с водой с образованием гидроксида калия КОН:
K2O + H2O = 2KOH
Гидроксид калия, или едкое кали, хорошо растворим в воде (до 49,10% массе при 20°C). Образующийся раствор - очень сильное основание, относящееся к щелочам (см. ЩЕЛОЧИ). КОН реагирует с кислотными и амфотерными оксидами:
SO2 + 2KOH = K2SO3 + H2O,
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4] (так реакция протекает в растворе) и
Al2O3 + 2KOH = 2KAlO2 + H2O (так реакция протекает при сплавлении реагентов).
В промышленности гидроксид калия KOH получают электролизом водных растворов KCl или K2CO3 c применением ионообменных мембран и диафрагм:
2KCl + 2H2O = 2KOH + Cl2+ H2,
или за счет обменных реакций растворов K2CO3 или K2SO4 с Ca(OH)2 или Ba(OH)2:
K2CO3 + Ba(OH)2 = 2KOH + BaCO3
Попадание твердого гидроксида калия или капель его растворов на кожу и в глаза вызывает тяжелые ожоги кожи и слизистых оболочек, поэтому работать с этими едкими веществами следует только в защитных очках и перчатках. Водные растворы гидроксида калия при хранении разрушают стекло, расплавы - фарфор.
Карбонат калия K2CO3 (обиходное название поташ) получают при нейтрализации раствора гидроксида калия углекислым газом:
2KOH + CO2 = K2CO3 + Н2О.
В значительных количествах поташ содержится в золе некоторых растений.
Применение
Металлический калий - материал для электродов в химических источниках тока. Сплав калия с другим щелочным металлом - натрием находит применение в качестве теплоносителя (см. ТЕПЛОНОСИТЕЛЬ) в ядерных реакторах.
В гораздо больших масштабах, чем металлический калий, находят применение его соединения. Калий - важный компонент минерального питания растений, он необходим им в значительных количествах для нормального развития, поэтому широкое применение находят калийные удобрения (см. КАЛИЙНЫЕ УДОБРЕНИЯ): хлорид калия КСl, нитрат калия, или калийная селитра, KNO3, поташ K2CO3 и другие соли калия. Поташ используют также при производстве специальных оптических стекол, как поглотитель сероводорода при очистке газов, как обезвоживающий агент и при дублении кож.
В качестве лекарственного средства находит применение иодид калия KI. Иодид калия используют также в фотографии и в качестве микроудобрения. Раствор перманганата калия КMnO4 («марганцовку») используют как антисептическое средство.
По содержанию в горных породах радиоактивного 40К определяют их возраст.
Калий в организме
Калий - один из важнейших биогенных элементов (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ), постоянно присутствующий во всех клетках всех организмов. Ионы калия К+ участвуют в работе ионных каналов (см. ИОННЫЕ КАНАЛЫ) и регуляции проницаемости биологических мембран (см. БИОЛОГИЧЕСКИЕ МЕМБРАНЫ), в генерации и проведении нервного импульса, в регуляции деятельности сердца и других мышц, в различных процессах обмена веществ. Содержание калия в тканях животных и человека регулируется стероидными гормонами надпочечников. В среднем организм человека (масса тела 70 кг) содержит около 140 г калия. Поэтому для нормальной жизнедеятельности с пищей в организм должно поступать 2-3 г калия в сутки. Богаты калием такие продукты, как изюм, курага, горох и другие.
Особенности обращения с металлическим калием
Металлический калий может вызвать очень сильные ожоги кожи, при попадании мельчайших частичек калия в глаза возникают тяжелые поражения с потерей зрения, поэтому работать с металлическим калием можно только в защитных перчатках и очках. Загоревшийся калий заливают минеральным маслом или засыпают смесью талька и NaCl. Хранят калий в герметично закрытых железных контейнерах под слоем обезвоженного керосина или минерального масла.
КАЛИЙ (лат. Kalium) - К, химический элемент I группы периодической системы, атомный номер 19, атомная масса 39,0983, относится к щелочным металлам. Название от араб. аль-кали - поташ (давно известное соединение калия, добывающееся из древесной золы). Серебристо-белый металл, мягкий, легкоплавкий; плотность 0,8629 г/см³, tпл 63,51 .С. Быстро окисляется на воздухе, с водой реагирует со взрывом. По распространенности в земной коре занимает 7-е место (минералы: сильвин, каинит, карналлит и др.; см. Калийные соли). Входит в состав тканей растительных и животных организмов. Ок. 90% добываемых солей используется как удобрения. Сам металл применяют в химических источниках тока, как геттер в электронных лампах, для получения надпероксида KO2; сплавы K с Na - теплоносители в ядерных реакторах.
-я, м.
Химический элемент, металл серебристо-белого цвета, добываемый из углекалиевой соли (поташа).
[араб. kali]
КАЛИЙ (Kalium), K, химический элемент I группы периодической системы, атомный номер 19, атомная масса 39,0983; относится к щелочным металлам; tпл 63,51°C. В живых организмах калий - основной внутриклеточный катион, участвует в генерации биоэлектрических потенциалов, поддержании осмотического давления, в углеводном обмене, синтезе белков. Калий - материал катодов, газопоглотитель, в виде сплавов с натрием - теплоноситель в ядерных реакторах, соединения калия - удобрения и др. Открыт английским ученым Г. Дэви в 1807.
мед. калий (potassium)
Жизненно важный макроэлемент (минерал).
- Необходим для нормальной работы нервной системы.
- Способствует поддержанию водного баланса в клетках и тканях.
Источники калия:
- Запеченный белый или сладкий картофель.
- Подорожник, бананы, апельсиновый сок, большинство сухофруктов.
Соли калия содержатся в кураге, изюме, кожуре молодого картофеля, рыбе, отрубях, бобовых.
см. тж микроэлементы
КАЛИЙ - новолатинск. kalium, от араб. kali, щелочь. Мягкий и легкий металл, составляющий основание кали. Открыт Деви в 1807 году.
- Щелочной металл.
- Металл, составляющий основу бертолетовой соли.
- Цианистый ...
- Это название носит сейчас химический элемент, открытый английским химиком Гэмфри Дэви и названный им «потасиум».
- Химический элемент, K.
- Тело любого человека испускает небольшое радиоактивное излучение благодаря углероду-14 и этому элементу с атомной массой 40.
- Этот элемент необходим для укрепления сердечной мышцы и нормализации давления, а в каждом банане его до 300 миллиграммов.
- Название этого химического элемента произошло от арабского «аль-кали», что означает поташ.
Кали́йные со́ли (калиевые соли). Основные минералы: сильвин, карналлит, каинит, полигалит и др. Месторождения осадочного происхождения. Промышленное содержание K2О в руде 12-30%. Бассейны: Соликамский (Россия), Прикарпатский (Украина), Припятский (Белоруссия), Верхнерейнский (Франция, Германия), Делавэрский (США), Саскачеванский (Канада) и др. Мировые запасы около 50 млрд. т.
* * *
КАЛИЙНЫЕ СОЛИ - КАЛИ́ЙНЫЕ СО́ЛИ (калиевые соли). Главные минералы: сильвин (см. СИЛЬВИН), карналлит (см. КАРНАЛЛИТ), каинит (см. КАИНИТ), полигалит (см. ПОЛИГАЛИТ), лангбейнит и др. Месторождения осадочного (см. ОСАДОЧНЫЕ МЕСТОРОЖДЕНИЯ) происхождения. Промышленное содержание К2О в руде 12-30%. Бассейны: Верхнекамский (Российская Федерация), Прикарпатский (Украина), Припятский (Белоруссия), Верхнерейнский (Франция, Германия), Делавэрский (США), Саскачеванский (Канада) и др. Мировые запасы ок. 50 млрд т (нач. 1990-х гг.).
КАЛИЙНЫЕ СОЛИ (калиевые соли). Главные минералы: сильвин - карналлит, каинит, полигалит, лангбейнит и др. Месторождения осадочного происхождения. Промышленное содержание К2О в руде 12-30%. Бассейны: Верхнекамский (Российская Федерация), Прикарпатский (Украина), Припятский (Белоруссия), Верхнерейнский (Франция, Германия), Делавэрский (США), Саскачеванский (Канада) и др. Мировые запасы ок. 50 млрд. т (нач. 1990-х гг.).
КАЛИЙНЫЕ СОЛИ (калиевые соли), содержат K2O 12-30%. Главные минералы: сильвин, карналлит, каинит, полигалит и др. Мировые запасы около 50 млрд. т. Главные добывающие страны: Канада, Франция, Германия, США, Белоруссия, Россия.
Кали́йные удобре́ния - минеральные вещества, используемые как источник калия для питания растений. Сырые калийные соли (сильвинит, карналлит, каинит) и концентрированные удобрения (хлористый калий, сульфат калия и др.), а также зола; эффективны на разных почвах при внесении под картофель, корнеплоды, лён, табак и другие культуры, потребляющие много калия.
* * *
КАЛИЙНЫЕ УДОБРЕНИЯ - КАЛИ́ЙНЫЕ УДОБРЕ́НИЯ, минеральные вещества, используемые как источник калия (см. КАЛИЙ) для питания растений. Сырые калийные соли (см. КАЛИЙНЫЕ СОЛИ) (сильвинит, карналлит, каинит) и концентрированные удобрения (хлористый калий, сульфат калия (см. КАЛИЯ СУЛЬФАТ) и др.), а также зола; эффективны на разных почвах при внесении под картофель, корнеплоды, лен, табак и другие культуры, потребляющие много калия.
КАЛИЙНЫЕ удобрения - минеральные вещества, используемые как источник калия для питания растений. Сырые калийные соли (сильвинит, карналлит, каинит) и концентрированные удобрения (хлористый калий, сульфат калия и др.), а также зола; эффективны на разных почвах при внесении под картофель, корнеплоды, лен, табак и другие культуры, потребляющие много калия.
кали́йный, кали́йная, кали́йное, кали́йные, кали́йного, кали́йной, кали́йных, кали́йному, кали́йным, кали́йную, кали́йною, кали́йными, кали́йном, кали́ен, кали́йна, кали́йно, кали́йны, кали́йнее, покали́йнее, кали́йней, покали́йней