ЖЕЛЕЗО (лат. Ferrum) - Fe, химический элемент VIII группы периодической системы, атомный номер 26, атомная масса 55,847. Блестящий серебристо-белый металл. Образует полиморфные модификации; при обычной температуре устойчиво ? -Fe (кристаллическая решетка - кубическая объемноцентрированная) с плотностью 7,874 г/см³. ? -Fe вплоть до 769 .С (точка Кюри) ферромагнитно; tпл 1535 .С. На воздухе окисляется - покрывается рыхлой ржавчиной. По распространенности элементов в природе железо находится на 4-м месте; образует ок. 300 минералов. На долю сплавов железа с углеродом и другими элементами приходится ок. 95% всей металлической продукции (чугун, сталь, ферросплавы). В чистом виде практически не используется (в быту железными часто называются стальные или чугунные изделия). Необходимо для жизнедеятельности животных организмов; входит в состав гемоглобина.
уран
Энциклопедия Кольера
1. в греческой мифологии
в греческой мифологии, персонификация неба, супруг Геи (Земли), от брака с которой родились титаны, киклопы и сторукие великаны. Уран был свергнут и оскоплен своим сыном Кроном, отцом олимпийских богов. Из его семени родилась Афродита, а из крови - эринии (фурии) и гиганты.
2. химический элемент
U (uranium),
металлический химический элемент семейства актиноидов, которые включают Ac, Th, Pa, U и трансурановые элементы (Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr). Уран приобрел известность благодаря использованию его в ядерном оружии и атомной энергетике. Оксиды урана применяются также для окрашивания стекла и керамики.
Нахождение в природе. Содержание урана в земной коре составляет 0,003%, он встречается в поверхностном слое земли в виде четырех видов отложений. Во-первых, это жилы уранинита, или урановой смолки (диоксид урана UO2), очень богатые ураном, но редко встречающиеся. Им сопутствуют отложения радия, так как радий является прямым продуктом изотопного распада урана. Такие жилы встречаются в Заире, Канаде (Большое Медвежье озеро), Чехии и Франции. Вторым источником урана являются конгломераты ториевой и урановой руды совместно с рудами других важных минералов. Конгломераты обычно содержат достаточные для извлечения количества золота и серебра, а сопутствующими элементами становятся уран и торий. Большие месторождения этих руд находятся в Канаде, ЮАР, России и Австралии. Третьим источником урана являются осадочные породы и песчаники, богатые минералом карнотитом (уранил-ванадат калия), который содержит, кроме урана, значительное количество ванадия и других элементов. Такие руды встречаются в западных штатах США. Железоурановые сланцы и фосфатные руды составляют четвертый источник отложений. Богатые отложения обнаружены в глинистых сланцах Швеции. Некоторые фосфатные руды Марокко и США содержат значительные количества урана, а фосфатные залежи в Анголе и Центральноафриканской Республике еще более богаты ураном. Большинство лигнитов и некоторые угли обычно содержат примеси урана. Богатые ураном отложения лигнитов обнаружены в Северной и Южной Дакоте (США) и битумных углях Испании и Чехии.
Открытие. Уран был открыт в 1789 немецким химиком М.Клапротом, который присвоил имя элементу в честь открытия за 8 лет перед этим планеты Уран. (Клапрот был ведущим химиком своего времени; он открыл также другие элементы, в том числе Ce, Ti и Zr.) В действительности вещество, полученное Клапротом, было не элементным ураном, но окисленной формой его, а элементный уран был впервые получен французским химиком Э.Пелиго в 1841. С момента открытия и до 20 в. уран не имел того значения, какое он имеет сейчас, хотя многие его физические свойства, а также атомная масса и плотность были определены. В 1896 А.Беккерель установил, что соли урана обладают излучением, которое засвечивает фотопластинку в темноте. Это открытие активизировало химиков к исследованиям в области радиоактивности и в 1898 французские физики супруги П.Кюри и М.Склодовская-Кюри выделили соли радиоактивных элементов полония и радия, а Э.Резерфорд, Ф.Содди, К.Фаянс и другие ученые разработали теорию радиоактивного распада, что заложило основы современной ядерной химии и атомной энергетики.
Первые применения урана. Хотя радиоактивность солей урана была известна, его руды в первой трети нынешнего столетия использовались лишь для получения сопутствующего радия, а уран считался нежелательным побочным продуктом. Его использование было сосредоточено в основном в технологии керамики и в металлургии; оксиды урана широко применяли для окраски стекла в цвета от бледножелтого до темнозеленого, что способствовало развитию недорогих стекольных производств. Сегодня изделия этих производств идентифицируют как флуоресцирующие под ультрафиолетовыми лучами. Во время Первой мировой войны и вскоре после нее уран в виде карбида применяли в производстве инструментальных сталей, аналогично Mo и W; 4-8% урана заменяли вольфрам, производство которого в то время было ограничено. Для получения инструментальных сталей в 1914-1926 ежегодно производили по нескольку тонн ферроурана, содержащего до 30% (масс.) U. Однако такое применение урана продолжалось недолго.
Современное применение урана. Промышленность урана начала складываться в 1939, когда было осуществлено деление изотопа урана 235U, что привело к технической реализации контролируемых цепных реакций деления урана в декабре 1942. Это было рождение эры атома, когда уран из незначительного элемента превратился в один из наиболее важных элементов в жизни общества. Военное значение урана для производства атомной бомбы и использование в качестве топлива в ядерных реакторах вызвали спрос на уран, который возрос в астрономических размерах. Интересна хронология роста потребности в уране по истории отложений в Большом Медвежьем озере (Канада). В 1930 в этом озере была обнаружена смоляная обманка - смесь оксидов урана, а в 1932 на этом участке была налажена технология очистки радия. Из каждой тонны руды (смоляной обманки) получали 1 г радия и около половины тонны побочного продукта - уранового концентрата. Однако радия было мало и его добыча была прекращена. С 1940 по 1942 разработку возобновили и начали отправку урановой руды в США. В 1949 аналогичная очистка урана с некоторыми усовершенствованиями была применена для производства чистого UO2. Это производство росло, и в настоящее время оно является одним из наиболее крупных производств урана. СВОЙСТВА УРАНА
Атомный номер 92 Атомная масса 238,03 Изотопы
стабильные нет
нестабильные 226-242 в т. ч. природные 234, 235, 236 (следы), 238
Температура плавления, ° С 1132 Температура кипения, ° С 3818 Плотность, г/см3 18,7 Твердость (по Моосу) 4,0 Содержание в земной коре, % (масс.) 0,003 Степени окисления +3, +4, +5, +6
Свойства. Уран - один из наиболее тяжелых элементов, встречающихся в природе. Чистый металл очень плотный, пластичный, электроположительный с малой электропроводностью и высокореакционноспособный. Уран имеет три аллотропные модификации: a-уран (орторомбическая кристаллическая решетка), существует в интервале от комнатной температуры до 668° С; b-уран (сложная кристаллическая решетка тетрагонального типа), устойчивый в интервале 668-774° С; g-уран (объемноцентрированная кубическая кристаллическая решетка), устойчивый от 774° С вплоть до температуры плавления (1132° С). Поскольку все изотопы урана нестабильны, все его соединения проявляют радиоактивность. Изотопы урана 238U, 235U, 234U встречаются в природе в соотношении 99,3:0,7:0,0058, а 236U - в следовых количествах. Все другие изотопы урана от 226U до 242U получают искусственно. Изотоп 235U имеет особо важное значение. Под действием медленных (тепловых) нейтронов он делится с освобождением огромной энергии. Полное деление 235U приводит к выделению "теплового энергетического эквивалента" 2Ч107 кВтЧч/кг. Деление 235U можно использовать не только для получения больших количеств энергии, но также для синтеза других важных актиноидных элементов. Уран природного изотопного состава можно использовать в ядерных реакторах для производства нейтронов, образующихся при делении 235U, в то же время избыточные нейтроны, не востребуемые цепной реакцией, могут захватываться другим природным изотопом, что приводит к получению плутония:
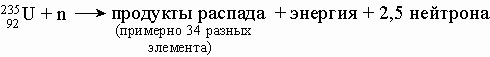
При бомбардировке 238U быстрыми нейтронами протекают следующие реакции:
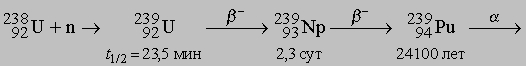
Согласно этой схеме, наиболее распространенный изотоп 238U может превращаться в плутоний-239, который, подобно 235U, также способен делиться под действием медленных нейтронов. В настоящее время получено большое число искусственных изотопов урана. Среди них 233U особенно примечателен тем, что он также делится при взаимодействии с медленными нейтронами. Некоторые другие искусственные изотопы урана часто применяются в качестве радиоактивных меток (индикаторов) в химических и физических исследованиях; это прежде всего b-излучатель 237U и a-излучатель 232U.
Соединения. Уран - высокореакционноспособный металл - имеет степени окисления от +3 до +6, близок бериллию в ряду активности, взаимодействует со всеми неметаллами и образует интерметаллические соединения с Al, Be, Bi, Co, Cu, Fe, Hg, Mg, Ni, Pb, Sn и Zn. Тонкораздробленный уран особенно реакционноспособен и при температурах выше 500° С часто вступает в реакции, характерные для гидрида урана. Кусковой уран или стружка ярко сгорает при 700-1000° С, а пары урана горят уже при 150-250° С, с HF уран реагирует при 200-400° С, образуя UF4 и H2. Уран медленно растворяется в концентрированной HF или H2SO4 и 85%-ной H3PO4 даже при 90° С, но легко реагирует с конц. HCl и менее активно с HBr или HI. Наиболее активно и быстро протекают реакции урана с разбавленной и концентрированной HNO3 с образованием нитрата уранила (см. ниже). В присутствии HCl уран быстро растворяется в органических кислотах, образуя органические соли U4+. В зависимости от степени окисления уран образует несколько типов солей (наиболее важные среди них с U4+, одна из них UCl4 - легко окисляемая соль зеленого цвета); соли уранила (радикала UO22+) типа UO2(NO3)2 имеют желтую окраску и флуоресцируют зеленым цветом. Соли уранила образуются при растворении амфотерного оксида UO3 (желтая окраска) в кислой среде. В щелочной среде UO3 образует уранаты типа Na2UO4 или Na2U2O7. Последнее соединение ("желтый уранил") применяют для изготовления фарфоровых глазурей и в производстве флуоресцентных стекол.
См. также КЕРАМИКА ПРОМЫШЛЕННАЯ.
Галогениды урана широко изучались в 1940-1950, так как на их основе были разработаны методы разделения изотопов урана для атомной бомбы или ядерного реактора. Трифторид урана UF3 был получен восстановлением UF4 водородом, а тетрафторид урана UF4 получают разными способами по реакциям HF с оксидами типа UO3 или U3O8 или электролитическим восстановлением соединений уранила. Гексафторид урана UF6 получают фторированием U или UF4 элементным фтором либо действием кислорода на UF4. Гексафторид образует прозрачные кристаллы с высоким коэффициентом преломления при 64° С (1137 мм рт. ст.); соединение летуче (в условиях нормального давления возгоняется при 56,54° С). Оксогалогениды урана, например, оксофториды, имеют состав UO2F2 (фторид уранила), UOF2 (оксид-дифторид урана).
См. также
ЛИТЕРАТУРА
Химия урана. М., 1981 Химия актиноидов. М., т. 1, 1991; т. 2, 1997; т. 3, 1999
Полезные сервисы
радий
Энциклопедический словарь
РА́ДИЙ -я; м. [лат. Radium от radius - луч] Химический элемент (Ra), радиоактивный серебристо-белый металл (применяется в медицине и технике как источник нейтронов).
◁ Ра́диевый, -ая, -ое. Р-ая руда.
* * *
ра́дий (лат. Radium), Ra, химический элемент II группы периодической системы, относится к щёлочно-земельным металлам. Радиоактивен; наиболее устойчивый изотоп 226Ra (период полураспада 1600 лет). Название от лат. radius - луч. Серебристо-белый блестящий металл; плотность 5,5-6,0 г/см3, tпл 969°C. Химически очень активен. В природе встречается в урановых рудах. Исторически первый элемент, радиоактивные свойства которого нашли практическое применение в медицине и технике. Изотоп 226Ra в смеси с бериллием идёт на приготовление простейших лабораторных источников нейтронов.
* * *
РАДИЙ - РА́ДИЙ (лат. Radium), Rа (читается «радий»), радиоактивный химический элемент, атомный номер 88. Стабильных нуклидов не имеет. Расположен во IIA группе, в 7 периоде периодической системы. Относится щелочноземельным элементам. Электронная конфигурация внешнего слоя атома 7s2. В соединениях проявляет степень окисления +2 (валентность II). Радиус нейтрального атома 0,235 нм, радиус иона Rа2+0,162 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома соответствуют 5,279, 10,147 и 34,3 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 0,97.
История открытия
Радий (как и полоний (см. ПОЛОНИЙ)) был открыт в конце 19 века во Франции А. Беккерелем (см. БЕККЕРЕЛЬ Антуан Анри)и супругами П. и М. Кюри (см. КЮРИ Пьер). Название «радий» связано с излучением ядер атомов Ra (от латинского radius - луч). Титаническая работа супругов Кюри по извлечению радия, по получению первых миллиграмм чистого хлорида этого элемента RaCl2 стала символом подвижнической работы ученых-исследователей. За работы по изучению радиоактивности супруги Кюри в 1903 получили Нобелевскую премию по физике, а М. Кюри в 1911 - Нобелевскую премию по химии. В России первый препарат радия был получен в 1921 В. Г. Хлопиным (см. ХЛОПИН Виталий Григорьевич) и И. Я. Башиловым. (см. БАШИЛОВ Иван Яковлевич)
Нахождение в природе
Содержание в земной коре 1·10-10 % по массе. Радионуклиды Ra входят в состав природных радиоактивных рядов урана-238, урана-235 и тория-232. Наиболее устойчивый радионуклид радия a-радиоактивный226Ra, с периодом полураспадаТ 1/2 = 1620 лет. В 1 т урана (см. УРАН (химический элемент)) в урановых рудах содержится около 0,34 г радия. В ничтожных концентрациях присутствует в природных водах.
Получение
Радий выделяют из отходов переработки урановых руд осаждением, дробной кристаллизациией и ионным обменом (см. ИОННЫЙ ОБМЕН). Металлический радий получают электролизом раствора RaCl2с использованием ртутного катода или восстановлением оксида радия RaO металлическималюминием. (см. АЛЮМИНИЙ)
Физические и химические свойства
Радий - серебристо-белый металл, светится в темноте. Кристаллическая решетка металлического радия кубическая объемноцентрированная, параметр а = 0,5148 нм. Температура плавления 969°C, температура кипения 1507°C, плотность 5,5-6,0 кг/дм3. Ядра Ra-226 испускают альфа-частицы с энергией 4,777МэВ и гамма-кванты с энергией 0,188 МэВ. За счет радиоактивного распада ядер Ra-226 и дочерних продуктов распада 1 г Ra выделяет 550 Дж/ч теплоты. Радиоактивность 1 г Ra составляет около 3,7·1010 распадов в 1 с (3,7·1010 беккерелей). При радиоактивном распаде Ra-226 превращается в радон-222. За 1 сутки из 1 г Ra-2216 образуется около 1 мм3 Rn.
По химическим свойствам похож на барий (см. БАРИЙ), но более активен. На воздухе покрывается пленкой, состоящей из оксида, гидроксида, карбоната и нитрида радия. Бурно реагирует с водой, образуя сильное основание Ra(OH)2:
Ra + 2H2O = Ra(OH)2 + H2
Оксид радия RaO - типичный основный оксид. При сгорании его на воздухе или в кислороде (см. КИСЛОРОД) образуется смесь оксида RaO и пероксида RaO2. Большинство солей радия бесцветны, но при разложении под действием собственного излучения они приобретают желтую или коричневую окраску. Синтезированы сульфид RaS, нитрид Ra3N2, гидрид RaH2, карбид RaC2..
Хлорид RaCl2, бромид RaBr2 и иодид RaI2, нитрат Ra(NO3)2. хорошо растворимые соли. Плохо растворимы сульфат RaSO4, карбонат RaСО3 и фторид RaF2. По сравнению с другими щелочноземельными металлами радий (ион Ra2+) обладает более слабой склонностью к комплексообразованию.
Применение
Соли радия используются в медицине как источник радона (см. РАДОН) для приготовления радоновых ванн.
Содержание в организме
Радий сильно токсичен. Около 80% поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы и опухоли.
Особенности работы
В России отработанные препараты радия сдаются службе по приему радиоактивных отходов (НПО «Радон»). Допустимая концентрация в атмосферном воздухе составляет для разных нуклидов радия от 10-4 до 10-5 Бк/л, в воде - от 2 до 13 Бк/л.