м.
Химический элемент, светло-серый тяжёлый и тугоплавкий металл, устойчивый к химическим реагентам.
РЕ́НИЙ -я; м. Химический элемент (Rе), тугоплавкий металл светло-серого цвета (используется в сплавах для антикоррозийных покрытий, деталей сверхзвуковых самолётов, ракет, точных приборов и т.п.).
◁ Ре́ниевый -ая, -ое. ● По названию Рейнской области в Германии.
* * *
ре́ний (лат. Rhenium), химический элемент VII группы периодической системы. Назван от лат. Rhenus - р. Рейн (открыт в Германии в 1925). Светло-серый металл, один из самых тяжёлых и тугоплавких, плотность 21,01 г/см3, tпл 3180°C. Химически очень стоек. В природе рассеян, собственный минерал джезказганит весьма редок; добывают из молибденовых руд. Сплавы рения с другими тугоплавкими металлами (W, Мо, Та) высокожаропрочны, идут на детали сверхзвуковых самолётов и ракет, сплавы с W и Mo - для нитей накаливания и термопар. Рениевые покрытия защищают металлы от коррозии и износа. Катализатор дегидрогенизации и крекинга нефти.
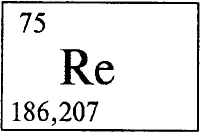
* * *
РЕНИЙ - РЕ́НИЙ (лат. rhenium, от латинского названия реки Рейн - Rhenus), Re, читается «рений», химический элемент с атомным номером 75, атомная масса 186,207. Встречается в природе в виде двух изотопов: стабильного 185Re (37,4% по массе) и слаборадиоактивного - 187Re (62,6%) (T1/2 = 5·1010 лет). Конфигурация двух внешних электронных слоев 5s2p6d56s2. Рений расположен в группе VIIB периодической системы элементов Менделеева, в 6 периоде. Образует соединения в степенях окисления от -1 до +7 (валентности от I до VII). Наиболее устойчивы соединения в высшей степени окисления (+7).
Радиус атома рения 0,137 нм, радиус иона Re4+ - 0,077 нм (координационное число 4), Re5+ - 0,072 нм (6), Re6+ - 0,069 нм (6), Re7+ - 0,052 нм (6). Энергии последовательной ионизации нейтрального атома рения равны, соответственно, 7,88, 16,6, 26,0, 37,7, 51, 64 и 79 эВ. Сродство к электрону 0,15 эВ. Работа выхода электрона 4,8 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,9.
История открытия
Существование рения, как и его соседа по подгруппе - технеция (см. ТЕХНЕЦИЙ), было предсказано Д. И. Менделеевым (см. МЕНДЕЛЕЕВ Дмитрий Иванович), который оставил для этих двух элементов пустые места в периодической таблице и называл их эка-марганец (Тс) и дви-марганец (Re).
Существование рения впервые зафиксировали в 1925 немецкие физикохимики супруги Вальтер и Ида Ноддак (см. НОДДАК) на основе данных спектрального анализа молибденовой руды. В 1926-1928 они получили первые миллиграммы препаратов рения.
Нахождение в природе
Рений - очень редкий и рассеянный элемент, его содержание в земной коре составляет 7·10-8% по массе. Самостоятельных минералов он не образует. В природе содержится как небольшая примесь в минералах, содержащих молибден, медь, цирконий, ниобий или платину. Содержание рения в этих рудах очень мало, например, в молибдените MoS2, где рений изоморфно замещает молибден, его содержание составляет 0,6-20 г/т.
Получение
Получение рения начинается со стадии концентрирования исходного сырья. При окислительном обжиге молибденитовых концентратов при 550-650°C рений удаляется с печными газами в виде летучего оксида Re2O7. Оксид концентрируют в пылеуловителях и далее переводят в раствор в виде рениевой кислоты HReO4 при их промывке:
Re2O7 + H2O = 2HReO4.
Из полученного раствора добавлением аммиака осаждают перренат аммония NH4ReO4, который затем восстанавливают при нагревании водородом:
2NH4ReO4 + 4H2 = N2 + 2Re + 8H2O.
Полученный рениевый порошок прессуют и затем спекают в слитки в токе водорода.
Физические и химические свойства
Рений - тяжелый, серебристо-серый металл с гексагональной решеткой, a = 0,2760 нм, с = 0,0458 нм. Плотность металла 21,04 г/см3. Температура плавления 3180°C, кипения около 5600°C. По тугоплавкости рений уступает только вольфраму (см. ВОЛЬФРАМ). Рений проявляет свойства парамагнетика (см. ПАРАМАГНЕТИК). Металлический рений довольно пластичен. В ряду стандартных потенциалов рений расположен правее водорода и с неокисляющими кислотами и водой не реагирует.
У рения наименьшая химическая активность по сравнению с его соседями по группе марганцем (см. МАРГАНЕЦ (химический элемент)) и технецием. Так, в отличие от марганца, реагирующего с кислотами, рений реагирует только с азотной и горячей серной кислотами и раствором перекиси водорода. При этом в результате окисления рения образуется рениевая кислота HReO4, например:
3Re + 7HNO3 = 3HReO4 + 7NO + 2H2O.
С растворами щелочей рений взаимодействует медленно. С расплавами щелочей, особенно в присутствии окислителей, рений активно реагирует с образованием солей Re(VII):
2KOH + 7H2O2 + 2Re = 2KReO4 + 8H2O.
При температурах выше 300°C рений сгорает в атмосфере, содержащей кислород, причем образуется как высший оксид Re2O7, так и оксид ReO3.
Во влажном воздухе рений медленно окисляется до HReO4.
С галогенами при нагревании рений реагирует, образуя галогениды ReF5, ReF6, ReF7, ReCl5, ReCl4 и ReBr5. Рений - это единственный элемент, который образует устойчивый гептафторид ReF7. С иодом рений не взаимодействует.
В низших степенях окисления рений образует многочисленные кластерные соединения, в которых имеется связь рений - рений. Например, при взаимодействии с монооксидом углерода СО образуется биядерный декакарбонил рения Re2(CO)10:
Галогениды трехвалентного рения представляют собой трехъядерные кластеры Re3X9. Межъядерное расстояние Re-Re в ReCl3 равно 0,248 нм, что значительно (на 0,027 нм) меньше, чем расстояние Re - Re в металлическом рении. Поэтому связь между атомами рения в таком кластере рассматривают как двойную: Re=Re:
При восстановлении ионов ReO4- водородом или другими восстановителями в среде соляной HCl или бромоводородной HBr кислот получены кластеры Re2X82-. Короткое расстояние между атомами рения (0,224 нм) свидетельствует о том, что в данном случае между атомами рения наблюдается четверная связь. Строение кластерного иона Re2Cl82- таково:
Для рения известно большое число разнообразных ренийорганических соединений.
Применение
Основное применение (около 65%) рений находит в сплавах с платиной (см. ПЛАТИНА), используемых как катализаторы в нефтеперерабатывающей промышленности. Рений вводят в состав некоторых жаропрочных сплавов с молибденом и вольфрамом. В электротехнике рений используют при изготовлении контактов и нанесении покрытий.
Физиологическое действие
Растворимые соединения рения мало токсичны, однако его металлическая пыль может вызывать интоксикации и заболевания дыхательных путей.
-я, м.
Химический элемент, металл светло-серого цвета, по тугоплавкости уступающий только вольфраму.
[По названию Рейнской области в Германии]
РЕНИЙ (Rhenium), Re, химический элемент VII группы периодической системы, атомный номер 75, атомная масса 186,207; металл. Открыт немецкими учеными В. Ноддаком и И. Таке в 1925.
ре́ний
(назв. по Рейнской обл. в Германии) хим. элемент, символ Re (лат. rhenium), светлосерый очень тугоплавкий металл, устойчивый к действию хим. реагентов; примен. как катализатор хим. процессов, в сплавах для изготовления деталей сверхзвуковых самолетов, ракет и точных приборов, для антикоррозионных покрытий (ренирование) и др.
- Химический элемент, металл.
- Он стал последним открытым элементом, у которого известен стабильный изотоп.
- Химический элемент, получивший своё название от реки Рейн.
- В таблице Менделеева он находится между вольфрамом и осмием, хотя, с точки зрения географии, логично было бы поместить его между францием и германием.
- Химический элемент, Re.