м.
Очень стойкий металл серебристого цвета из группы платиновых металлов.
РО́ДИЙ, родия, муж. (от греч. rhodios - розовый, из роз) (хим., тех.). Серебристобелый, ковкий и очень стойкий металл, добиваемый при обработке платины и применяемый для изготовления частей точных приборов и механизмов.
РО́ДИЙ -я; м. [лат. Rhodium] Химический элемент (Rh), тяжёлый тугоплавкий металл серебристо-белого цвета из группы платиновых металлов; применяется в сплавах с платиной (катализаторы, термопары), идёт на покрытие зеркальных поверхностей в астрономических приборах).
◁ Ро́диевый, -ая, -ое.
* * *
ро́дий (лат. Rhodium), химический элемент VIII группы периодической системы, относится к платиновым металлам. Название от греческого rhodon - роза, по розовато-красному цвету его солей. Плотность 12,41 г/см3, tпл 1963°C. Применяют в сплавах с платиной (катализаторы, термопары и др.); идёт на покрытие зеркальных поверхностей в астрономических приборах.
* * *
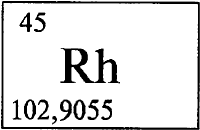
РОДИЙ - РО́ДИЙ (лат. Rhodium), Rh (читается «родий»), химический элемент с атомным номером 45, атомная масса 102,9055. В природе представлен одним стабильным нуклидом 103Rh. Расположен в VIIIВ группе, 5 периода периодической системы. Принадлежит к числу платиновых (см. ПЛАТИНОВЫЕ МЕТАЛЛЫ) металлов. Входит в триаду родий-рутений (см. РУТЕНИЙ) -палладий (см. ПАЛЛАДИЙ (химический элемент)).
Конфигурация двух внешних электронных слоев 4s2p6d85s1. Получены соединения со степенями окисления от 0 до +6 (валентности от 0 до VI). Наиболее устойчивы соединения со степенью окисления родия +3.
Радиус атома 0,1342 нм, радиус ионов (для координационного числа 6): Rh3+ - 0,081 нм, Rh4+ - 0,074 нм, Rh5+- 0,069 нм. Энергии последовательной ионизации нейтрального атома соответствуют 7,46, 18,08 и 31,04 эВ. Сродство к электрону 1,68 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 2,28.
История открытия
В 1803 английский ученый У. Г. Волластон (см. ВОЛЛАСТОН Уильям Хайд) исследовал фильтрат, полученный после растворения самородной южноамериканской платины вцарской водке (см. ЦАРСКАЯ ВОДКА). В 1804 он выделил из этого фильтрата розовато-красный порошок, последующее прокаливание которого в атмосфере водорода привело к получению порошка нового металла - родия. Название происходит от греческого rhodon - роза, по розовато-красному цвету его солей
Содержание в природе
Содержание родия в земной коре 1·10-7% по массе. В природе встречается в виде сплавов с платиновыми металлами, входит в состав самородной платины и минералов группы осмистого иридия. В виде примесей встречается в мышьяковистых, сурьмяных и сернистых соединений платиновых металлов, сопутствующих медно-никелевым сульфидным рудам.
Получение
Промышленное извлечение родия основано на классическом выделении и разделении платиновых металлов из руд (см. иридий (см. ИРИДИЙ)) и реже на экстракции комплексных соединений различными растворителями. После выделения платины и палладия родий концентрируется в маточных растворах. Из этих растворов егޠвыделяют в виде аммиаката [Rh(NH3)3Cl3].
Далее раствор [Rh(NH3)3Cl3] восстанавливают муравьиной кислотой до родиевой черни. При ее нагревании в атмосфере водорода до 1000°C получают родиевую губку. Чистую родиевую губку переплавляют методом индукционного нагрева в атмосфере инертного газа.
Физические и химические свойства
Родий - серебристо-белый металл. Обладает гранецентрированной кубической решеткой типа меди, параметр элементарной ячейки а = 0,3803 нм. Плотность при 20°C 12,41 г/см3. Температура плавления 1963 °C, кипения 3727 °C. Проявляет свойства парамагнетика (см. ПАРАМАГНЕТИК). Отражательная способность поверхности родия 80% для видимой части спектра. В ряду напряжений металлов родий стоит правее водорода и с неокисляющими кислотами и водой не реагирует.
Родий характеризуется высокой химической устойчивостью. С неметаллами он взаимодействует только при температуре красного каления. Мелкоизмельченный родий медленно окисляется только при температуре выше 600°C:
4Rh + 3O2 = 2Rh2O3.
При нагревании родий медленно взаимодействует с концентрированной серной кислотой, раствором гипохлорита (см. ГИПОХЛОРИТЫ) натрия NaClO и бромоводорода HBr. При спекании реагирует с расплавами KHSO4, Na2O2 и BaO2:
2Rh + 6KHSO4 = 2K3Rh(SO4)3 + 3H2;
2Rh + 3BaO2 = Rh2O3 + 3BaO.
В присутствии хлоридов щелочных металлов, когда есть возможность образовывать комплексы [RhX3]3-, родий взаимодействует с хлором, например:
2Rh + 6NaCl + Cl2 = 2Na3[RhCl6].
При действии на водные растворы солей и комплексов родия (III) щелочами образуется осадок гидроксида родия Rh(OH)3:
Na3[RhCl6] + 3NaOH = Rh(OH)3Ї + 6NaCl.
Гидроксид и оксид родия (III) проявляют основные свойства и взаимодействуют с кислотами с образованием комплексов Rh(III):
Rh2O3 + 12HCl = 2H3RhCl6 + 3H2O;
Rh(OH)3 + 6HCl = H3RhCl6 + 3H2O.
Высшую степень окисления +6 родий проявляет в гексафториде RhF6, который образуется при прямом сжигании родия во фторе. Соединение неустойчиво. В отсутствие паров воды гексафторид окисляет свободный хлор или NO:
2RhF6 + 3Cl2 = 2RhF3 + 6ClF.
В низших степенях окисления (I) и (II) родий образует комплексные соединения.
Применение
Основное применение родия - производство сплавов на основе платины для стеклоплавильных аппаратов, изготовление тиглей в производстве оптического стекла и монокристаллов; нанесение защитных покрытий на электрические контакты, нанесение зеркальных покрытий в производстве рефлекторов, прожекторов, технических зеркал; получение сплавов для дожигания выхлопных газов автомобильных двигателей. Родий находит также применение при изготовлении высокотемпературных термопар в виде сплава с платиной или иридием, в качестве катализатора в органическом синтезе.
Литература
РОДИЙ (лат. Rhodium) - Rh, химический элемент VIII группы периодической системы, атомный номер 45, атомная масса 102,9055, относится к платиновым металлам. Название от греч. rhodon - роза, по розовато-красному цвету его солей. Плотность 12,41 г/см³, tпл 1963 .С. Применяют в сплавах с платиной (катализаторы, термопары и др.); идет на покрытие зеркальных поверхностей в астрономических приборах.
-я, м.
Химический элемент, тяжелый тугоплавкий металл серебристо-белого цвета из группы платиновых металлов.
[От греч. ’’ρόδον - роза]
РОДИЙ (новолатинское Rhodium, от греческого rhodios - розовый), Rh, химический элемент VIII группы периодической системы, атомный номер 45, атомная масса 102,9055; относится к платиновым металлам. Открыт английским химиком У. Волластоном в 1804.
РОДИЙ (ново-лат. rhodium, от греч. rhodon - роза). Хрупкий, белый металл, открытый в платиновой руде Волластоном.
- Самый ценный металл.
- Платиновый металл.
- Название этого химического элемента произошло от греческого слова «роза».
- Химический элемент, Rh.