ПОДГРУППА IIIA. СЕМЕЙСТВО АЛЮМИНИЯ
БОР, АЛЮМИНИЙ, ГАЛЛИЙ, ИНДИЙ, ТАЛЛИЙ
Внешняя электронная конфигурация у всех элементов подгруппы s2p1, но наличие внутренней электронной структуры типа электронной конфигурации благородного газа у B и Al и отсутствие ее у Ga, In и Tl, имеющих по 18 электронов, приводит к различию свойств и делению семейства на две группы. У более легких B и Al отличие в поведении валентных s- и p-электронов незначительно, и они проявляют одну стабильную степень окисления III. С ростом атомного номера и соответственно размеров и массы увеличивается возможность проявления меньшей степени окисления (I и II) без использования в химической связи третьего электрона. Наиболее полно эта тенденция проявляется в химии последнего элемента подгруппы таллия, соединения которого со степенью окисления I более устойчивы, чем со степенью окисления III. Отличительной особенностью подгруппы IIIA является практически полное отсутствие металлических свойств у бора и типичные металлические свойства у таллия. Элементы, стоящие между ними в подгруппе, проявляют промежуточные свойства, демонстрируя постепенный переход от неметаллических свойств к металлическим.
Извлечение и применение. Наиболее распространенным и важным в промышленном отношении элементом подгруппы является алюминий. Алюминий проявляет характерные свойства металла, такие, как отражательная способность, проводимость, прочность, деформируемость. Al образует ион в степени окисления III, размер и зарядовая плотность которого обусловливают прочную связь с кислородом гидроксид-иона OHили воды H2O; в последнем случае отщепляется протон H+. Степень диссоциации образующегося Al(OH)3 небольшая, гидроксид проявляет свойства кислоты и основания. Это явление называется амфотерностью и выражается следующим равновесием:
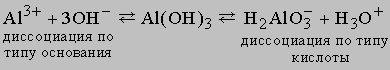
Al(OH)3, как и B(OH)3, растворяется в избытке гидроксида натрия. B(OH)3, или H3BO3, проявляет кислотные свойства настолько, что не растворяется в кислотах, а Al(OH)3 легко растворяется в кислотах. Металлический алюминий получают из природного минерала боксита (основной состав Al2O3), который подвергают обогащению или очистке. Полученный чистый оксид добавляют к расплаву криолита Na3AlF6 в электролизной ванне (катод), сделанной из стали, футерованной графитом. Анодом служат стержни из углерода. В расплаве происходит восстановление оксида до Al, который плавится. По этой технологии (процесс Холла Эру) получают алюминий чистотой 98%. Дальнейшую очистку алюминия проводят повторным электролизом по методу Хупса.
См. также АЛЮМИНИЕВАЯ ПРОМЫШЛЕННОСТЬ.
Бор в виде аморфного коричневатого порошка получают восстановлением B2O3 активным металлом (щелочным или магнием). При этом бор загрязняется примесями боридов, например Mg3B2. Наиболее чистый бор получают восстановлением из BBr3 на раскаленной нити в атмосфере водорода. Другие элементы этой подгруппы получают восстановлением их оксидов водородом или углеродом. Из всех элементов подгруппы только алюминий получают в больших количествах для разнообразного применения в авиационной и ракетно-космической технике, строительном деле, мосто- и судостроении. Электрохимическое полирование металла позволяет использовать его в производстве больших и малых зеркал. Анодирование алюминия в присутствии органических красителей расширяет возможности его применения в столовой утвари. В большом количестве производят оксид и сульфат алюминия. Оксид природный и синтетический используют как абразив (алунд, корунд, наждак смесь с оксидами железа). Сочетание природного оксида алюминия со следами некоторых металлических примесей придает неповторимую окраску таким драгоценным и полудрагоценным камням, как сапфир, рубин, топаз, аметист и изумруд. Эти драгоценные камни успешно синтезируют в лабораториях для изготовления украшений, а также в промышленных целях. При окислении алюминия кислородом выделяется много тепла и происходит сильный разогрев, поэтому алюминий является хорошим восстановителем для получения металлического железа из оксида путем прокаливания смеси Al с оксидом железа. При этом получается расплав железа, который используют в сварке (термитный сварочный процесс). Сульфат алюминия Al2(SO4)3 в виде простой или двойной соли (квасцы) применяют в дублении. (Квасцы смешанные сульфаты одновалентного и трехвалентного металлов, MI2SO4*MIII2(SO4)3*24H2O, где MIII любой металл из подгруппы IIIA, кроме бора.)
Из данных табл. 4 видно, что наиболее необычными свойствами обладает галлий. Металл плавится при почти комнатной температуре и сохраняет жидкое состояние до АЛЮМИНИЯ СЕМЕЙСТВО2000° С. Этот интервал жидкого состояния является максимальным среди всех известных металлов.
Химические свойства. Все элементы подгруппы IIIA образуют оксиды и гидроксиды со степенью окисления III, но свойства в ряду элементов заметно различаются с изменением атомного номера. Так, B(OH)3 больше кислота, чем основание, а Al(OH)3 проявляет cвойства кислоты и основания в равной степени, остальные три элемента проявляют основные свойства, а таллий даже образует растворимое в воде сильное основание TlOH со степенью окисления I. Галогениды всех элементов этой подгруппы имеют состав MX3, а таллий кроме того образует и TlX, например TlCl, во многом сходный с AgCl. Галогениды алюминия в жидком и даже в газообразном состоянии сильно димеризованы. Например, хлорид алюминия является димером Al2Cl6, в котором два тетраэдра соединены атомами хлора:
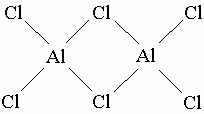
Некоторые данные свидетельствуют от образовании AlCl в газовой фазе при высокой температуре из смеси Al + AlCl3. Однако образующийся монохлорид алюминия неустойчив и легко разлагается на исходные вещества. Галогениды бора BX3 как более тяжелые соединения не имеют такой тенденции к образованию димеров. В галогенидах бора нет полностью завершенного октета электронов (как у галогенидов алюминия), они являются сильными акцепторами электронов, т.е. кислотами Льюиса. Типичный пример трифторид бора BF3. Ионы и молекулы доноры электронов предоставляют электронную пару трифториду бора, образуя с ним прочный комплексный ион, при этом в другой части частицы-донора связи ослабевают. Например,
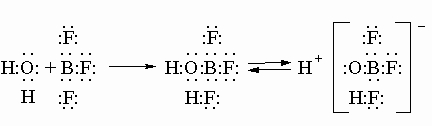
Галогениды металлов подгруппы IIIA используются как катализаторы в нефтехимической и других отраслях промышленности, а также в лабораторных исследованиях для связывания электронной пары.
Соединения бора. Водородные соединения бора (бороводороды, или бораны) рассматриваются отдельно (см. ВОДОРОД). Аммиачный комплекс бороводорода превращается при нагревании в боразин B3H6N3, который называют также неорганическим бензолом или боразолом из-за его сходства с бензолом. Представляет интерес нитрид бора BN (боразон): при высоких давлениях и температуре гексагональная модификация BN превращается в алмазоподобную тетраэдрическую, отличающуюся высокой твердостью, близкой к твердости алмаза.
